大鼠高胰岛素-正血糖钳夹实验方法的比较
安玉秀 张敏娟(青海省人民医院,青海 西宁 80007)
目前已发展出四种葡萄糖钳夹方法:高胰岛素-正葡萄糖、高葡萄糖、低葡萄糖、扩展葡萄糖钳夹技术〔1〕。而高胰岛素-正葡萄糖钳夹术是评判胰岛素敏感性公认的金标准。大鼠作为研究代谢综合征、糖尿病的较理想动物模型,使用葡萄糖钳夹技术可更好地评价大鼠病理生理变化,以便制备出符合人体病理生理特点的动物模型。在大鼠实验中,该技术通常在全麻下使用颈动静脉插管术,导管需留置动物体内1 w左右再进行实验,以消除麻醉和手术等应激对实验结果的影响,是公认的大鼠葡萄糖钳夹实验的经典方法。国内通常采用颈动静脉或者股动静脉插管,术后麻醉状态下进行葡萄糖钳夹术,也有在局麻下采用尾动静脉插管,使大鼠在清醒状态下行高胰岛素-正葡萄糖钳夹实验。实验方法虽有所简化,可避免上述不利影响,但仍有诸多不足。本实验试用双尾静脉穿刺,大鼠在非麻醉下行钳夹实验,并与清醒状态下颈动静脉插管钳夹实验、麻醉状态下颈动静脉插管钳夹实验及局麻下尾动静脉插管钳夹实验进行比较,以评价各种实验方法的优缺点。
1 材料与方法
1.1 动物及分组 健康成年SPF级雌性SD大鼠40只,体重(180±10)g,6~7周龄,购自甘肃中医学院试验动物中心。分为正常饮食(ND)组和高脂高糖饮食(HD)组,各20只。ND组和HD组再各分为4组,每组4只,分别接受4种不同的插管及穿刺方法,ND组和HD组各余4只作为备用鼠。ND组给予标准基础饲料(北京科澳协力饲料有限公司提供);HD组给予高脂高糖饲料(北京科澳协力饲料有限公司提供,饲料组成:10%猪油、20%葡萄糖、5%蛋黄粉、65%常规饲料)。动物饲养于甘肃中医学院试验动物中心SPF级实验室,明暗周期为昼12 h夜12 h,室温(20~25)℃,空气湿度(40~70)%,喂养8 w后进行实验。
1.2 实验室检测 基础血糖(BBG)及稳态血糖、基础血清胰岛素(BIns)、游离脂肪酸(FFA)、甘油三酯(TG)及总胆固醇(TC)的测定均在甘肃中医学院生化实验室。①BBG及稳态血糖的测定采用己糖激酶法,药盒购自北京中生北控生物科技股份有限公司;②BIns水平的测定,采用放射免疫法,药盒购自北京倍爱康生物技术有限公司;③钳夹实验期间血糖的测定采用美国强生公司稳步型快速血糖仪;④血脂的测定使用全自动生化分析仪。
1.3 实验方法
1.3.1 大鼠的固定 参照黄月玲等采用的深色软布与硬木板做成的简易大鼠固定器〔2〕,便于对鼠尾进行操作。
1.3.2 双尾静脉穿刺高胰岛素-正葡萄糖钳夹实验尾静脉穿刺术 将大鼠置于固定器内,鼠尾酒精擦洗或40℃水浴,使血管扩张,可见到皮下尾静脉,24 G静脉留置针接装有50 U/ml的肝素生理盐水注射器,针体插入一尾静脉末1/3处后,轻轻拔出针心,接注满肝素生理盐水的肝素帽,用于采血,胶布把鼠尾固定于手术台。用装有50 U/ml肝素生理盐水的22 G头皮针插入另一尾静脉根部1/3处,针尾接肝素帽,用于输注胰岛素和葡萄糖。
1.3.3 颈动静脉插管高胰岛素-正血糖钳夹实验置管术 参照李玲所选用方法〔3〕,术前先将手术器械、手术铺巾和纱布进行高温高压灭菌。大鼠禁食12 h后2%戊巴比妥钠按0.23 ml/100 g体重腹腔内注射麻醉,显效后,背卧于手术台,颈部剪毛,碘伏消毒皮肤,在颈部正中纵行切开皮肤,暴露并分离左颈动脉和右颈内静脉,分别插入PE-50导管,插入动脉时顺便采血0.5 ml用于测量血脂等,导管插入后用装有肝素生理盐水的注射器注入0.2 ml检查导管是否通畅,如通畅经导管再注入肝素-青霉素-生理盐水0.3 ml,最后用80%聚乙烯吡咯烷酮溶液充满,用大头针封闭,并经皮下隧道延续至颈背,缝合皮肤,将导管固定在皮肤上。颈静脉用于注入胰岛素和葡萄糖,颈动脉用于采血标本。在麻醉状态下行葡萄糖钳夹试验,结束后待大鼠自然苏醒,1 w后再行清醒状态下钳夹实验。
1.3.4 尾动静脉插管高胰岛素-正血糖钳夹实验置管术 参照尚敬等方法〔4〕。①尾动脉插管术:将大鼠置于固定器内,2%利多卡因0.5 ml在大鼠尾根部环状皮下注射局麻,待尾部反射消失(用针尖刺激鼠尾无反应)后,将鼠套翻转,鼠尾腹面向上,在尾根部中线左侧0.3 cm处沿尾纵轴作一长约1.5 cm切口,再横向作一切口约0.5 cm,两切口呈“L”型。分离皮肤,可见尾动脉鞘,用眼科剪及玻璃分针分离尾动脉约1 cm,丝线结扎远心端。24 G静脉留置针接装有50 U/ml的肝素生理盐水注射器,针体插入尾动脉后,轻轻拔出针心,丝线结扎固定导管,皮下缝线及胶布固定针体。此后每小时左右尾根部补加2%利多卡因保持局麻。②尾静脉插管术:鼠尾远侧1/3处酒精或热水局部擦洗,使血管扩张,可以见到皮下尾静脉,用22 G头皮针插入尾静脉留置,胶布把鼠尾固定于手术台。头皮针内装有50 U/ml的肝素生理盐水,尾部接肝素帽,用于输注葡萄糖和胰岛素。
1.3.5 高胰岛素-正葡萄糖钳夹术 参照Kraegen等〔5〕的实验方法。4种实验方法,除了采血部位及血管不同外,钳夹实验其余步骤均相同,以双尾静脉穿刺高胰岛素-正葡萄糖钳夹实验为例,简介高胰岛素-正葡萄糖钳夹术步骤。待大鼠安静后,首次0 min用1 ml注射器经尾末1/3处静脉留置针取尾静脉血0.5 ml行胰岛素和血糖检测,此时所测血糖为BBG,胰岛素值为BIns,以后每次取血前先抽0.3 ml(避免死腔血对血糖测定的影响,尽量避免回抽的血与肝素生理盐水混合),再换用另一1 ml空针取血0.1 ml测定血糖,取血后将先前回抽的0.3 ml回输入尾静脉。接在靠近尾根部静脉处的头皮针用于输注普通胰岛素注射液(浓度为0.05 U/ml,每毫升加肝素50 U)和27.5%葡萄糖注射液,胰岛素和葡萄糖分别用数字式微量注射泵(WZS-50F型,浙江大学医学仪器厂)注射。然后以0.12 U·kg-1·h-1的恒定速度输入胰岛素,5 min后,用美国强生稳步血糖仪测量血糖,若此时血糖低于BBG 0.5 mmol/L,则开始输入27.5%葡萄糖注射液。以后每5分钟测血糖1次,不断调整葡萄糖输入速率(GIR),使血糖保持在(BBG±0.5)mmol/L范围内。60 min后,若连续3次测血糖保持在上述范围内,便可认为达到稳态,此时取动脉血0.5 ml测量血浆胰岛素(钳夹稳态胰岛素),继续上述过程,直到120 min结束,共采血24次。
1.4 钳夹技术稳定性和准确性检验
1.4.1 钳夹技术结果的稳定性 计算各组大鼠GIR60-120的均数和标准差;再以标准差/均数计算变异系数(CV),分别合并接受同一实验的两组大鼠的变异系数(CVGIR),求其均数为平均CVGIR,该指标反映钳夹技术结果的稳定性。
1.4.2 钳夹技术的准确性 计算每组大鼠60~120 min的13个血糖(BG)的平均值为BG60-120;分别计算出所有大鼠24次BG的均数和标准差,再按照标准差/均数计算CVBG,合并同一方法组大鼠的CVBG为平均CVBG,反映钳夹技术的准确性。
2 结果
2.1 一般资料比较 体重、BBG和FFA,HD组大鼠分别为(269.17±11.25)g、(4.84±0.63)mmol/L和 (0.82±0.21)mmol/L,ND 组大鼠分别为(245.28±15.12)g、(4.22±0.54)mmol/L和(0.61±1.24)mmol/L;HD组大鼠体重、BBG和FFA略高于ND组,但均无差异(P>0.05);而HD组BIns、TC、TG组分别为(12.4±1.83)pmol/L、(2.27±0.35)mmol/L、(1.71±0.17)mmol/L,显著高于 ND 组(8.10±1.98)pmol/L、(0.66±0.13)mmol/L、(0.37±0.26)mmol/L(P <0.01)。
2.2 葡萄糖钳夹实验准确性和稳定性检验 如表1所示,麻醉状态下颈动静脉插管高胰岛素-正葡萄糖钳夹实验平均CVBG和平均CVGIR分别为7.1%和19.9%,CVGIR显著高于其他三种方法(P<0.01);而其他三种方法平均CVBG和平均CVGIR与Garvan实验室〔4〕经典方法下的钳夹实验数据基本一致,证实麻醉状态下颈动静脉插管高胰岛素-正葡萄糖钳夹实验结果不稳定,清醒状态下的三种钳夹实验结果具有较好的稳定性和准确性。
2.3 两组胰岛素敏感性比较 ND GIR60-120组大鼠为(12.6± 1.7)mg·kg-1·h-1,显著高于 HD 组的(7.5±1.3)mg·kg-1·h-1(P <0.01),提示 ND 组胰岛素敏感性高于HD组,HD组大鼠存在胰岛素抵抗。
2.4 四种钳夹实验比较 大鼠非麻醉状态下双尾静脉穿刺约需时5 min,尾动静脉插管术手术时间20 min,颈动静脉插管约需40 min;尾静脉穿刺和尾动静脉插管无大鼠死亡,所有大鼠均顺利完成钳夹实验,而颈动静脉插管实施中有2只大鼠死亡,术后有1只大鼠咬断留置导管,从备用鼠中增加3只,以保证有8只大鼠完成实验;除麻醉状态下颈动静脉插管大鼠血糖较其他组稍高,其他三组术后血糖无明显波动;双尾静脉穿刺钳夹实验(M1)平均CVGIR为14.9%,平均 CVBG为5.7%,尾动静脉插管钳夹实验(M2)平均CVGIR为15.4%,平均CVBG为5.3%,清醒状态下颈动静脉插管钳夹实验(M3)平均CVGIR为14.1%,平均CVBG为5.4%,三种实验方法结果比较差异无统计学意义(P>0.01);麻醉状态下颈动静脉插管钳夹实验(M4)平均CVGIR为19.9%,与前三种方法(平均CVGIR)比较,差异均有统计学意义(P<0.01)(见表1)。
表1 不同实验方法比较(,n=4)
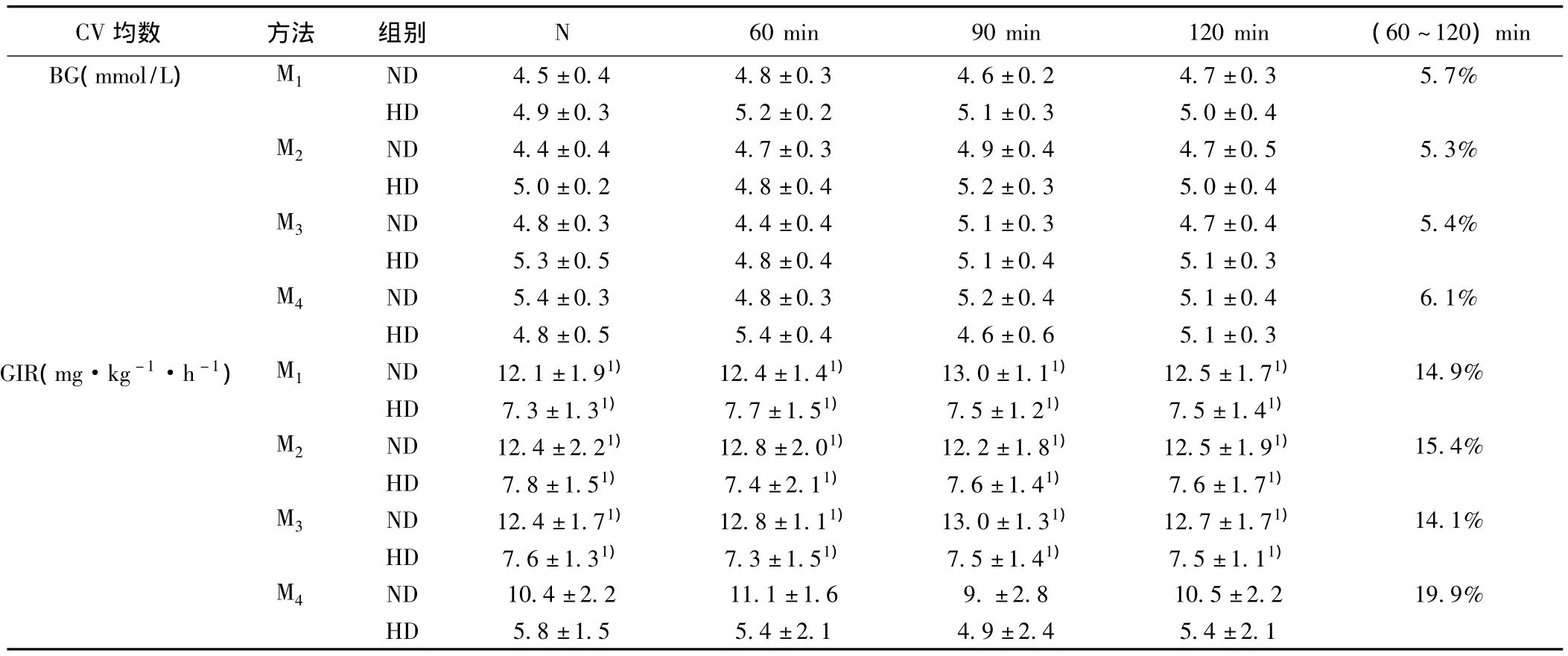
表1 不同实验方法比较(,n=4)
与M4比较:1)P<0.01
ND 4.5±0.4 4.8±0.3 4.6±0.2 4.7±0.3 5.7%HD 4.9±0.3 5.2±0.2 5.1±0.3 5.0±0.4 M2 ND 4.4±0.4 4.7±0.3 4.9±0.4 4.7±0.5 5.3%HD 5.0±0.2 4.8±0.4 5.2±0.3 5.0±0.4 M3 ND 4.8±0.3 4.4±0.4 5.1±0.3 4.7±0.4 5.4%HD 5.3±0.5 4.8±0.4 5.1±0.4 5.1±0.3 M4 ND 5.4±0.3 4.8±0.3 5.2±0.4 5.1±0.4 6.1%HD 4.8±0.5 5.4±0.4 4.6±0.6 5.1±0.3 GIR(mg·kg-1·h-1) M1 ND 12.1±1.91) 12.4±1.41) 13.0±1.11) 12.5±1.71) 14.9%HD 7.3±1.31) 7.7±1.51) 7.5±1.21) 7.5±1.41)M2 ND 12.4±2.21) 12.8±2.01) 12.2±1.81) 12.5±1.91) 15.4%HD 7.8±1.51) 7.4±2.11) 7.6±1.41) 7.6±1.71)M3 ND 12.4±1.71) 12.8±1.11) 13.0±1.31) 12.7±1.71) 14.1%HD 7.6±1.31) 7.3±1.51) 7.5±1.41) 7.5±1.11)M4 ND 10.4±2.2 11.1±1.6 9.±2.8 10.5±2.2 19.9%均数BG(mmol/L) M1 CV 方法 组别 N 60 min 90 min 120 min (60~120)min HD 5.8±1.5 5.4±2.1 4.9±2.4 5.4±2.1
3 讨论
胰岛素抵抗是2型糖尿病和代谢综合征共同的重要病理生理基础,而大鼠作为研究糖尿病和代谢综合征较为理想和廉价的动物模型,研究其胰岛素抵抗具有重要的现实意义。目前为止,在众多评价胰岛素敏感性的方法中高胰岛素-正血糖钳夹技术是最具权威的“金标准”〔1〕。自1983年Kraegen等建立大鼠高胰岛素-正糖钳夹技术以来,国外已经广泛使用,成为研究胰岛素抵抗的基本技术之一〔4〕。但是,这项技术目前在国内未能普遍应用,其重要原因之一是传统高胰岛素-正糖钳夹采用颈动静脉插管技术,大鼠颈动静脉插管术后需在体内留置导管1 w左右,等待大鼠术后应激反应完全消失,并恢复正常生理状态后才能进行钳夹实验,这样做的优点是结果准确可靠,可重复性好,成为钳夹实验的经典方案〔5〕。但是,实验大鼠除了死于复杂的插管手术外,术后感染、术后大鼠咬断导管或者所留置导管堵塞等意外也常常导致整个实验失败。因此,传统颈动静脉插管技术建立的钳夹实验具有实验周期长、动物死亡率高、消耗大、实验条件要求高的缺点。国内有人采用麻醉状态下颈动静脉插管术进行钳夹实验并与清醒状态下颈动静脉插管钳夹实验进行比较,结果显示麻醉状态下大鼠胰岛素敏感性较清醒状态下明显降低〔3〕。分析原因麻醉状态下脑组织和维持身体姿势的骨骼肌摄取葡萄糖量明显降低,加上插管手术时对神经肌肉血管的牵拉都会导致机体应激而使大鼠血糖升高,因此麻醉状态下的钳夹实验结果不稳定,并不能很好地反映机体的真实状况〔5,6〕,本实验结果显示麻醉状态下大鼠胰岛素敏感性较清醒状态下明显降低,与文献中实验结果相吻合。此外,国内也有人采用了尾动静脉插管术进行实验,利用尾静脉输入药物,尾动脉抽吸待测血样,很好地解决了实验所面临的困难〔4〕,本实验证实结果与经典钳夹实验结果一致。但尾动脉插管需要有经过训练的专业人员进行,而且需要在局麻下进行,仍会对大鼠造成一定伤害,可重复性较差。而采用双尾静脉穿刺行钳夹实验,不需要局麻,不需要专门训练,操作简便,可重复性好,可在同一批鼠上多次重复进行,以利于实验结果前后比较,本实验证实结果与经典钳夹实验结果一致。
有人会顾虑尾静脉抽取的血样可能受到另外一条静脉输入葡萄糖的影响,其血糖测定结果可能不可靠。大鼠正常情况下尾静脉有3根,左右两侧和背部各1根,左右两侧静脉较表浅且容易显露和固定,常首选,背部正中位置较深,次选用〔7〕。操作时选用2根尾静脉,1根在靠近尾末1/3穿刺抽取血样,1根在靠近尾根1/3处穿刺给药,理论上药物从一条下游静脉倒流入另一条上游静脉的可能性很小。本研究就双尾静脉穿刺钳夹实验和经典钳夹试验及尾动静脉插管葡萄糖钳夹实验做一比较,结果显示双尾静脉穿刺与尾动静脉插管钳夹试验都能很好地反映胰岛素敏感性,与经典钳夹实验差异没有统计学意义。我们在非麻醉下行大鼠双尾静脉穿刺后,检测大鼠血糖在正常范围内,提示静脉穿刺几乎未给大鼠造成应激反应,基本满足了实验对大鼠机体处于正常生理状态的要求;另外,穿刺选用了临床上常用的24 G静脉留置针和22 G头皮针,可以轻易地穿刺极细的尾静脉,方便采集血样和输入葡萄糖及胰岛素。操作仅需时约5 min,术后可立刻进行实验,实现了即穿刺即实验,缩短了实验周期,使钳夹实验的操作简便易行。
现阶段对胰岛素抵抗的研究多以鼠类模型居多,高脂喂养大鼠造成胰岛素抵抗模型被广泛使用,其成模率高、模型稳定,是研究胰岛素抵抗的经典模型。文中参照Storlien等〔8〕的经典造模方案。HD组大鼠体重较ND组大鼠为高,钳夹实验结果显示,HD组存在明显胰岛素抵抗,提示本实验高脂高糖喂养造胰岛素抵抗模型成功。用双尾静脉穿刺葡萄糖钳夹试验得到的平均CVBG是5.7%,平均CVGIR是14.9%,数据接近国外用传统插管技术钳夹实验的报道,提示本插管术后的钳夹实验结果可靠,其稳定性和准确性均较好。综上所述,本实验采用的在非麻醉状态下双尾静脉穿刺大鼠高胰岛素-正糖钳夹实验,具有简便易行、实验周期短、重复性好,大鼠恢复快、无大鼠死亡的优点。本改进方法具有一定的可行性和可靠性,值得推广。
1 陈 蕾,贾伟平,项坤三.葡萄糖钳夹技术在糖尿病研究中的应用〔J〕.中华内分泌代谢杂志,2003;19(1):74-6.
2 黄月玲,叶炳飞,戴丽军.一种简易大鼠固定装置的制作和使用方法〔J〕.中国实用医药,2007;2(22):62-3.
3 李 玲.大鼠清醒和麻醉状态下胰岛素钳夹实验结果的比较〔J〕.中国糖尿病杂志,2003;11(1):51-3.
4 尚 敬,孙 晖,陈璐璐.清醒状态下大鼠尾动静脉插管高胰岛素-正糖钳夹实验〔J〕.上海交通大学学报(医学版),2006;26(8):968-71.
5 Kraegen EW,James DE,Bennett SP,et al.In vivo insulin sensitivity in the rat determined by euglycemic clamp〔J〕.Am J Physiol,1983;245(1):E1-E7.
6 罗四川,李启富,刘红梅.清醒状态大鼠高胰岛素-正常血糖钳夹术的建立及其意义〔J〕.重庆医科大学学报,2004;29(3):334-6.
7 陈学新,郑月梅,熊利泽.SD大鼠尾静脉穿刺置管实用技术〔J〕.宁夏医学院学报2008;30(1):114-6.
8 Storlien LH,OakesND,Pan DA,et al.Syndromes of insulin resistance in the rat.Inducement by diet and amelioration with benfluorex〔J〕.Diabetes,1993;42(3):457-62.

