玉米对Cs+的富集能力及Cs+对其抗氧化指标影响的研究
安 冰,唐运来,*,陈 梅,王 丹,罗学刚
(1.西南科技大学 生命科学与工程学院,四川 绵阳 621000;2.西南科技大学 核废物与环境安全国防重点学科实验室,四川 绵阳 621000)
随着核工业的发展、核技术的广泛应用以及其他工业、农业、能源、军事、交通、医疗卫生等行业的发展,人类生态环境中核素的本底不断增加[1-3]。植物修复、放射性废物处置与辐射生物学等研究受到了国内外前所未有的重视,发掘具有超积累能力的生物种质资源、揭示其富集机制、提高修复效率并将之应用于植物修复与污染防护,是该课题的研究热点之一。
137Cs是放射性尘埃和核燃料废物中重要核素之一,其半衰期为30.17a,也是生物学上最危险核素之一。核素铯在土壤中的迁移速度很慢,且作为钾的营养类似物被作物吸收,从而进入生态系统食物链,对人类健康产生严重危害[4]。目前,国内外关于核素铯污染植物修复的研究尚处初级阶段,主要是富集植物的筛选,对铯的(超)积累耐性机制(分子和生理机制)仍不很清楚,在研究中发现不同种、科、属的植物对铯的积累不同,它们之间存在很大差异,而同种植物的不同器官对铯的积累也不尽相同,且土壤理化性质对植物富集铯也有一定影响。本实验主要研究玉米对铯的富集情况及其抗氧化体系对不同浓度铯处理的影响差异,以期为铯污染的植物修复技术提供一定的理论依据。
1 材料与方法
1.1 实验材料与处理方法
供试作物为川单25号,用Hoagland营养液进行室内盆栽水培,隔天换一次营养液,室内恒温24°C,光周期为10h/d。三叶期开始用CsCl处理,处理浓度分别为0、0.5、1、5、10和20mmol/L,在处理7、14、21和28d后,分别采样进行各指标的测定,每一指标的测定设置3个重复。
1.2 Cs+含量及生理生化指标测定
取不同Cs+浓度处理的玉米根、茎、叶烘干至恒重研细,分别取干粉0.1g待测。采用湿法(HNO3-HClO4)硝解,美国PE AA700型原子吸收光谱测定Cs+含量,叶、茎、根中的Cs+含量分别为WL、WS和WR。计算如下:富集系数BL、BS、BR=WL、WS、WR(g/kg)/施入 Cs+的量 (g/L);转运系数 TL、TS=WL、WS(g/kg)/WR(g/kg)。
每处理选择若干株,采取相同部位的叶带回实验室,丙二醛(MDA)含量参照 Hodges等[5]的方法测定;过氧化氢(H2O2)含量参照Brennan等[6]的方法测定;过氧化物酶(POD)和过氧化氢酶(CAT)活性采用Prochazkova等[7]的方法测定。
1.3 统计分析
用统计软件SPSS 11.5对所有测定的指标进行方差分析,从而确定各处理间的差异,并用绘图软件Sigmaplot 10.0作图。
2 结果与分析
2.1 不同浓度Cs+处理对玉米幼苗富集Cs+能力的影响
不同浓度Cs+处理玉米幼苗Cs+的富集与分布吸收情况示于图1。从图1a可看出,玉米幼苗对Cs+具有一定的富集能力,玉米幼苗富集Cs+的能力与Cs+浓度和处理时间呈正相关,根为主要的富集器官,即根的Cs+富集含量最高,茎次之,叶最低,28d处理时Cs+富集含量最高,7d最少。当处理浓度为20mmol/L时,玉米Cs+含量均达到最大,随处理时间的延长,叶Cs+含量分别为0.5mmol/L处理浓度的3.0、7.6、68.2和24.0倍;茎 Cs+含量分别为0.5mmol/L处理浓度的3.1、40.8、66.7和18.0倍;根Cs+含量分别为0.5mmol/L处理浓度的7.4、22.5、22.8和16.3倍。在所有处理浓度中,根Cs+含量均远大于茎和叶中的含量,其中最大处理浓度时,随处理时间的延长,根Cs+含量分别为叶的1.6、5.9、0.6和5.1倍,为茎的1.3、0.4、0.3和1.6倍。可见,Cs+主要富集在玉米幼苗的根部,茎其次,叶最少。
随处理时间的延长,玉米根、茎、叶的富集系数与胁迫时间呈正相关,均为BR>BS>BL,28d时达最大,说明随时间的延长,富集能力不断上升。Cs+和K+在化学性质上有相似性,在离子运输过程中,二者存在竞争作用[8],本实验中,Hoagland营养液中 K+浓度为5mmol/L。结果表明,处理7d和28d时,Cs+浓度为0.5mmol/L玉米幼苗对Cs+的富集系数最大;处理14d和21d时,Cs+浓度为1.0mmol/L时富集系数最大。可能是因为K+和Cs+一定浓度比时,会促进Cs+的吸收和富集,这与Soudek等[9]的研究结果一致。在所有处理浓度中,处理21d和28d时根、茎、叶富集系数明显大于处理7d和14d时的富集系数,富集能力最强,这可能是因为Cs+破坏了玉米的离子交换吸收系统,导致玉米对Cs+的富集能力仅随Cs+浓度的增加而增加,而不受竞争抑制的影响。

图1 不同浓度Cs+处理玉米幼苗Cs+的富集与分布吸收情况Fig.1 Absorbtion and distribution of Cs+in maize seeding under different concentrations of Cs+ treatment
与此同时,地下部分向地上部分的转运系数逐渐增大,均表现为TS>TL。如图1c所示,在1mmol/L处理14、21和28d时,TS及TL几乎都达到最高,随后呈下降趋势,但均维持在较高水平,且TS>TL,说明根系吸收的Cs+主要转移并储存在玉米茎中,随着胁迫时间的延长,根系吸收Cs+的总量增加,根系向地上部分转运Cs+的能力也不断下降。玉米幼苗叶、茎在胁迫28d时TS和TL均达到最小,表明胁迫在14d和21d时,Cs+从根系转移到茎、叶的能力最强,在28d时植物体内运载Cs+的载体逐渐饱和,转运能力持平或下降。
除了籽粒苋、苋菜等少数植物能超量积累Cs+外,叶菜、瓜果类蔬菜作物,大豆、玉米等粮食作物以及油菜等油料作物对Cs+的富积能力均不强[9-10]。本实验结果也表明,玉米根、茎、叶的富集系数均小于0.36,属于低富集植物。玉米根、茎、叶中Cs+含量与处理浓度和处理时间成正比,富集量为WR>WS>WL,这与Eapen和Fircks等[11-12]研究结果一致。目前,植物对铯的(超)积累耐性机制(分子和生理机制)仍不很清楚,尚需更深入的研究,生物学性状优良的铯积累植物甚至超积累植物有待于进一步的筛选。
2.2 Cs+胁迫对玉米幼苗叶CAT活性的影响
不同浓度Cs+处理对玉米幼苗叶CAT、POD活性和MAD、H2O2含量的影响示于图2。图2a表明,在无Cs+的情况下,玉米幼苗叶的CAT活性一直维持在一较低水平,随后活性随Cs+浓度的升高而迅速增加,在1mmol/L处理浓度时,CAT活性达到最大,较对照分别提高了1.1、1.2、1.3和1.3倍,这表明CAT具有较强的抵御Cs+诱导的氧化胁迫的作用;当Cs+浓度继续升高时,活性开始下降,在最大浓度20mmol/L时,CAT活性比最高时分别下降了32.2%、34.3%、34.8%和24.0%,说明 CAT受到抑制,抗氧化体系在一定程度上被破坏。
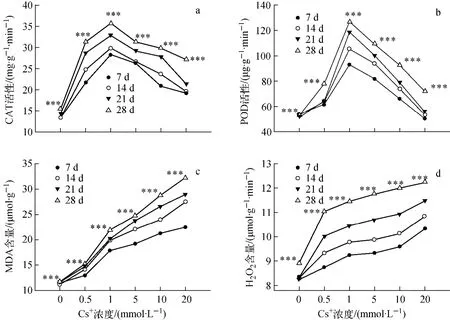
图2 不同浓度Cs+处理对玉米幼苗叶CAT、POD活性和MDA、H2O2含量的影响Fig.2 Effects of different Cs+concentrations on CAT,POD activities and MAD,H2O2contents in leaves of maize seedlings
2.3 Cs+胁迫对玉米幼苗叶POD活性的影响
由图2b可见,玉米幼苗叶的POD活性随Cs+处理浓度的增大表现为先应激性上升后下降,且与胁迫时间呈正相关。浓度达1mmol/L时,玉米幼苗叶的POD活性达到最强,分别较对照提高了0.7、1.0、1.3和1.4倍,具有明显的激活效应;随后POD的活性呈下降趋势,在处理浓度最大时,分别较最高时下降了28.9%、29.6%、33.5%和27.0%,即受到了抑制,表明POD清除过氧化物的能力有限。POD是一含铁的金属蛋白质,它能催化H2O2氧化酶类的反应,使植物免于毒害,其作用如同氢的接受体,是植物体内重要的代谢酶,参与许多重要的生理活动。同时也是植物体内抗氧化酶系统的重要组成部分,它能催化有毒物质的分解,其活性高低能反应植物受害的程度[13-14],出现图2b这种趋势的原因可能是由于Cs+进入玉米组织中,通过一系列生理生化反应产生了一些对植物体有毒害的过氧化物。随处理浓度的增加,过氧化物在体内逐渐增加,由于POD具有催化这些自身有害过氧化物的氧化分解功能,因此会有随着底物过氧化氢浓度的增加,POD的活性也在增加,增加到一定程度时不再增加,超出了POD清除有害过氧化物的能力。
CAT和POD在植物体内的活性氧清除系统中占有重要地位[15-19],抗氧化酶和小分子抗氧化物能清除在细胞内生成的活性氧,构成对活性氧的防御体系,通过酶促作用被清除的活性氧仅限于超氧化物、过氧化物及部分自由基。许多研究证实,重金属胁迫导致植物体内的活性氧的产生和清除失衡,造成植物体内自由基累积,导致对植物的损伤。在一定范围内,CAT能把具潜在危害的O-2和H2O2转化为无害的O2和H2O,且减少具毒性的、高活性的抗氧化酶,能有效清除H2O2,CAT和POD协调一致,将自由基控制在较低水平,使细胞免受伤害。本实验中,在低浓度Cs+处理下,玉米叶内Cs+含量较低,其POD和CAT活性均高于对照,说明植物为了保护细胞免受氧化胁迫的伤害而提高2种保护酶的活性。但随着Cs+处理浓度的进一步提高,玉米叶内Cs+含量不断升高,POD和CAT活性依次下降,表现为抑制作用逐渐加强,该结果与刘莉[20]的报道相同。生物膜伤害的一个重要原因就是活性氧消除系统功能的下降[21]。
2.4 Cs+胁迫对玉米幼苗叶H2O2和 MDA含量的影响
由图2c和2d可看出,随着Cs+处理浓度的升高和处理时间的延长,叶内MDA和H2O2含量逐渐上升。Cs+可诱导植物的自由基过氧化损伤,加剧植物体内膜脂过氧化作用,使膜上不饱和脂肪酸发生一系列活性氧反应。在一定胁迫强度内,细胞的各种保护机制使MDA含量维持在一定水平,但胁迫强度超过一定值后,细胞内代谢失调,自由基积累,膜脂过氧化作用加大,MDA含量升高。因此,在一定程度上,MDA含量的高低可表示细胞膜脂过氧化的程度和植物对逆境条件反应的强弱[22]。
逆境胁迫下植物细胞内活性氧自由基代谢失衡引起自由基的积累和膜脂过氧化使膜系统的结构和功能受到损伤是造成细胞伤害的重要原因[23]。随着Cs+浓度的增加和处理时间的延长,过多的H2O2不能被及时清除,它们可能质子化成毒性更强的·OH自由基,对膜脂产生不可逆的过氧化伤害,这与MDA含量随Cs+浓度增加而持续升高的结果相符。
本实验中随着玉米叶内Cs+富集量的升高,MDA和H2O2含量呈逐渐上升趋势,说明随着Cs+处理浓度的增加,导致氧化胁迫和膜脂过氧化程度加剧,同时伴随CAT和POD活性的提高,对Cs+诱导的氧化胁迫产生适应性保护反应。在其他重金属胁迫对植物抗逆生理指标的影响研究方面也有类似报道[24-25]。
[1]LANGE C C,WACKETT L P,MINTON K W,et al.Engineering a recombinant Deinococcus radiodurans for organopollutant degradation in radioactive mixed waste environments[J].Nature Biotechnology,1998,16(10):929-933.
[2]林春梅.重金属污染土壤生物修复技术研究现状[J].环境与健康杂志,2008,3(25):273-275.LIN Chunmei.The research status of bio-remediation of heavy metals contaminated soils[J].Journal of Environment and Health,2008,3(25):273-275(in Chinese).
[3]SHARMA R K,AGRAWAL M,MARSHALL F.Heavy metal contamination of soil and vegetables in suburban areas of Varanasi,India[J].Ec-otoxicology and Environmental Safety,2007,66(2):258-266.
[4]LASAT M M,WENDELL N,KOCHIAN L V.Potential for phytoremediation of137Cs from a contaminated soil[J].Plant and Soil,1997,195(1):99-106.
[5]HODGES D M,DELONG J M,FORNEY C F,et al.Improving the thiobarbituric acid-reactivesubstances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J].Planta,1999,207(4):604-611.
[6]BRENNAN T,FREKEL C.Involvement of hydrogen peroxide in the regulation of senescence in pear[J].Plant Physiology,1977,59:411-416.
[7]PROCHAZKOVA D,SAIRAM R K,SRIVASTAVA G C,et al.Oxidative stress and antioxidant activity as the basis of senescence in maize leaves[J].Plant Science,2001,161(4):765-771.
[8]SANCHES N,ANJOS R M,MOSQUERA B.40K/137Cs discrimination ratios to the aboveground organs of tropical plants[J].Journal of Environmental Radioactivity,2008,99(7):1 127-1 135.
[9]SOUDEK P,VALENOVÁS,VAVRˇÍKOVÁZ,et al.137Cs and90Sr uptake by sunflower cultivated under hydroponic conditions[J].Journal of Environmental Radioactivity,2006,88(3):236-250.
[10]郑洁敏,李红艳,牛天新,等.盆栽条件下三种植物对污染土壤中放射性铯的吸收试验[J].核农学报,2009,23(1):123-127.ZHENG Jiemin,LI Hongyan,NIU Tianxin,et al.Uptake of radiocesium by three plants grown in134Cs contaminated soil under pot experiment condition[J].Journal of Nuclear Agricultural Sciences,2009,23(1):123-127(in Chinese).
[11]EAPEN S,SINGH S,THORAT V,et al.Phytoremediation of radiostrontium (90Sr)and radiocesium (137Cs)using giant milky weed(Calotropis gigantea R.Br.)plants[J].Chemosphere,2006,65(11):2 071-2 073.
[12]FIRCKS Y,ROS N K,SENNERBY F L.Uptake and distribution of137Cs and90Sr in Salix viminalis plants[J].Journal of Environmental Radioactivity,2002,63(1):1-14.
[13]孙光闻,朱祝军,方学智.镉对白菜活性氧代谢及H2O2清除系统的影响[J].中国农业科学,2004,37(12):2 012-2 015.SUN Guangwen,ZHU Zhujun,FANG Xuezhi.Effects of different cadmium levels on active oxygen metabolism and H2O2-scavenging system in brassica campestris L.ssp.Chinensis[J].Scientia Agricultura Sinica,2004,37(12):2 012-2 015(in Chinese).
[14]BARCEL J,POSCHENRIEDER C.Plant waterrelation as affected by heavy metal stress:A review[J].Journal of Plant Nutrition,1990,13(1):1-37.
[15]BOWLER C,Van MONTAGU M,INZ D.Superoxide dismutase and stress tolerance[J].Annual Review of Plant Physiology and Plant Molecular Biology,1992,43:83-116.
[16]黄玉山,罗广华,关棨文.镉诱导植物的自由基过氧化损伤[J].植物学报,1997,39(6):522-526.HUANG Yushan,LUO Guanghua,GUAN Qiwen.Peroxidation damage of oxygen free radicals induced by cadmium to plant[J].Acta Botanica Sinica,1997,39(6):522-526(in Chinese).
[17]VANDENHOVEA H,CUYPERSB A,HEESA M V,et al.Oxidative stress reactions induced in beans (Phaseolus vulgaris)following exposure to uranium[J].Plant Physiology and Biochemistry,2006,44(11-12):795-805.
[18]JIN X F,YANG X E,EJAZUL I,et al.Effects of cadmium on ultrastructure and antioxidative defense system in hyperaccumulator and non-hyperaccumulator ecotypes of Sedum alfredii Hance[J].Journal of Hazardous Materials,2008,156(1-3):387-397.
[19]MARC D,ERIC B,SYLVIE C,et al.Antioxidant enzyme activities as affected by trivalent and hexavalent chromium species in Fontinalis antipyretica Hedw[J].Chemosphere,2008,73(3):281-290.
[20]刘莉.镉对不同作物幼苗生长和生理特性的影响[D].杭州:浙江大学,2005.
[21]MACFARLANE G R,BURCHETT M D.Photosynthetic pigments and peroxidase activity as indicators of heavy metal stress in the grey mangrove,avicennia marina(Forsk),marine pollution [J].Marine Pollution Bulletin,2001,42(3):233-240.
[22]曹莹,黄瑞冬,曹志强.铅胁迫对玉米生理生化特性的影响[J].玉米科学,2005,13(3):61-64.CAO Ying,HUANG Ruidong,CAO Zhiqiang.Effects of Pb stress on the physiological and biochemical traits of maize[J].Journal of Maize Sciences,2005,13(3):61-64(in Chinese).
[23]WU F B,ZHANG G P,DOMINY P.Four barley genotypes respond differently to cadmium:Lipid peroxidation and activities of antioxidant capacity[J].Environmental and Experimental Botany,2003,50(1):67-78.
[24]LI M,XIE X T.Effects of strontium-induced stress on marine microalgae Platymonas subcordiformis[J].Chinese Journal of Oceanology and Limnology,2006,24(2):154-160.
[25]徐爱春.柳树无性系镉积累和生理变化规律研究[D].北京:中国林业科学研究院,2007.

