丙泊酚对血管紧张肽Ⅱ诱导心肌细胞肥大及ROS/JNK1/2通路的影响
周武,张俊峰,王涛
(1.湖北省新华医院麻醉科,武汉 430015;2.华中科技大学同济医学院药学院,武汉 430030)
心肌细胞肥大是高血压等多种常见心血管疾病的并发症,其发展可加重心肌组织缺血缺氧状态,增加猝死发生率;降低心室顺应性,并影响心肌细胞间力的产生与传输,终致心律失常及不可逆心力衰竭[1]。血管紧张肽 Ⅱ(angiotensinⅡ,AngⅡ)可促进活性氧(reactive oxygen species,ROS)生成,活化 c-Jun氨基末端激酶(c-Jun N-teminal kinase1/2,JNK1/2),促进蛋白质合成及体积增大等心肌细胞肥大反应[2-3]。现有研究提示在危重患者体内血管紧张肽系统活性上调[4]。丙泊酚(propofol,Pro)被广泛应用于危重患者手术中的持续静脉镇静。作为一种抗氧化剂,丙泊酚能拮抗活性氧导致的多种细胞损伤,具有一定的心肌保护作用[5]。但其是否能抑制心肌肥大,尚未可知。笔者在本研究拟探讨丙泊酚对AngⅡ诱导的心肌肥大的影响。
1 材料与方法
1.1 材料
1.1.1 动物 1~2 d龄新生Wistar乳鼠,购于华中科技大学同济医学院实验动物中心。动物许可证号SCXK(鄂)2004-0007。
1.1.2 试剂与仪器 AngⅡ(Sigma公司)、丙泊酚标准品由德国费森尤斯公司惠赠、达尔伯克改良伊格尔培养基(Dulbecco's modified eagle's medium,DMEM)干粉培养基、胰酶、胎牛血清(Gibco公司),[3H]-亮氨酸(中科院上海原子能研究所),硝酸纤维素膜(nitrocellulose filter membrane,NC 膜,Amersham 公司),小鼠抗大鼠JNK1/2单克隆抗体及增强荧光显示剂(Santa Cruz公司)。其余试剂为国产分析纯。垂直电泳仪及转膜系统(Biorad公司)。
1.2 方法
1.2.1 心肌细胞培养及分组 1~2 d龄新生Wistar乳鼠置于超净工作台上,常规取心室肌,用D-Hanks液于4℃漂洗,剪成1mm3体积碎块,0.1%胰酶消化成细胞悬液,差速贴壁1 h后,将心肌细胞用含20%胎牛血清及青霉素、链霉素的DMEM培养液稀释后,均匀接种于6孔板,置于37℃、5%二氧化碳(CO2)培养箱培养2 d,换无血清培养液。参考文献[6]所用浓度,按给予培养基中试剂的不同分为如下几组:①对照组,给予培养基;②Ang Ⅱ(0.1 μmol·L-1)组;③AngⅡ(0.1 μmol·L-1)+Pro(3 μmol·L-1)组;④Ang Ⅱ(0.1 μmol·L-1)+Pro(10 μmol·L-1)组;⑤Ang Ⅱ(0.1 μmol·L-1)+Pro(30 μmol·L-1)组。
1.2.2 相差显微镜下观察细胞直径 含各种浓度干预因素的无血清培养液继续培养24 h。相差显微镜观察并摄相,随机取6个视野,计算细胞直径,并与对照组进行对比。
1.2.3 [3H]-亮氨酸掺入率测定 参考文献[7]方法。细胞用无血清培养液培养24 h后,加入各组处理因素及[3H]-亮氨酸18.3 kBq继续培养24 h。弃培养液,磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗2次,0.25%胰酶消化后收集于玻璃纤维素膜,10%三氯乙酸固定,滤膜烘干后用LS3810液体闪烁仪测定样品的每分脉冲数(cpm)。结果以对照组细胞[3H]-leucine掺入率作100%,各组均以[3H]-leucine掺入百分率表示。
1.2.4 细胞内 ROS水平分析 参考文献[8]方法。在细胞培养第4天,D-Hanks液洗细胞1次,以DCFHDA(5 μmol·L-1)在37℃下避光孵育30 min。各组处理30 min后,PBS漂洗2次,并以0.25%胰酶消化细胞。荧光分光光度计在激发光波长485 nm、发射光波长535 nm下观察细胞内产生荧光强度的变化,反映细胞内ROS水平。
1.2.5 还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced form of nicotinamide-adenine dinucleotide phosphate,NADPH)氧化酶活性(NADPH oxidase,Nox)测定 参考文献[9]方法。胰酶消化细胞后,4℃下2 500×g离心5 min,以 PBS 再悬浮,随后加入 250 μmol·L-1NADPH孵育,在λ=340 nm下观察5 min,通过吸光率的减少来探测NADPH的消耗量。为分析NADPH氧化酶特异的活性,在检测之前30 min加入10 μmol·L-1DPI,来检测DPI抑制后的NADPH消耗率(the rate of consumption of NADPH inhibited by DPI)。用来计算NADPH消耗总量的吸收消光系数(absorption extinction coefficient)是 6.22mmol-1·cm-1,结果以pmol NADPH·min-1·mg-1蛋白表示。
1.2.6 免疫印迹法检测JNK1/2磷酸化 取总蛋白30 μg加入上样缓冲液煮沸3 min变性,经十二烷基磺酸钠/聚丙烯酰胺凝胶电泳,电转移至NC膜,封闭后与稀释一抗4℃孵育过夜,并与稀释二抗室温孵育1 h,再与化学发光试剂温浴1 min后曝光、显影和定影,最后对结果进行吸光度扫描分析。
2 结果
2.1 Pro对AngⅡ诱导的心肌细胞直径增加的影响
刺激因素处理24 h后,相差显微镜测定心肌细胞直径。结果显示,对照组细胞直径为(22.29±23.78)μm;AngⅡ能显著提高细胞直径,各浓度Pro均使AngⅡ诱导心肌细胞直径明显减少,以上结果差异有统计学意义。见图1。
2.2 Pro对AngⅡ诱导的心肌细胞蛋白合成速率上调的影响 结果显示,对照组细胞[3H]-亮氨酸掺入率为(2 175±285.6)cpm;AngⅡ作用24 h后,心肌细胞蛋白质合成速率较对照组明显增加,各浓度Pro能减弱AngⅡ诱导心肌细胞内蛋白合成速率的增加,差异有统计学意义。见图2。
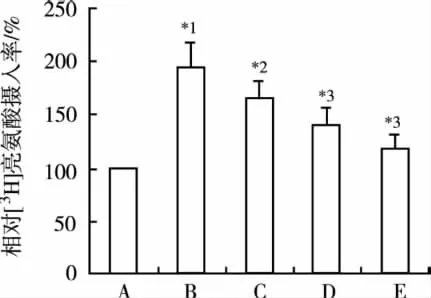
图2 Pro对蛋白质合成速率的影响(n=6)A.对照组;B.Ang Ⅱ(0.1 μmol·L-1)组;C.Ang Ⅱ(0.1 μmol·L-1)+Pro(3 μmol·L-1)组;D.Ang Ⅱ(0.1 μmol·L-1)+Pro(10 μmol·L-1)组;E.Ang Ⅱ(0.1 μmol·L-1)+Pro(30 μmol·L-1)组;与对照组比较,*1P<0.01;与 Ang Ⅱ(0.1 μmol·L-1)组比较,*2P<0.05,*3P<0.01Fig.2 Effects of propofol on protein synthesis rate(n=6)A.the control group;B.Ang Ⅱ(0.1 μmol·L-1)group;C.AngⅡ(0.1 μmol·L-1)+Pro(3 μmol·L-1)group;D.Ang Ⅱ(0.1 μmol·L-1)+Pro(10 μmol·L-1)group;E.Ang Ⅱ(0.1 μmol·L-1)+Pro(30 μmol·L-1)group;Compared with the control group,*1P<0.01;Compared with the Ang Ⅱ group,*2P<0.05,*3P<0.01
2.3 Pro对AngⅡ诱导的心肌细胞ROS水平增加的影响 结果显示,对照组细胞 ROS荧光强度为(16.22±1.89);AngⅡ作用24 h后,心肌细胞蛋白质ROS水平较对照组明显增加。各浓度Pro处理后,ROS水平明显降低,差异有统计学意义。见图3。
2.4 Pro对AngⅡ诱导的心肌细胞NADPH氧化酶活性上调的影响 结果显示,对照组细胞NADPH氧化酶活性为(3.621±0.396)pmol·min-1·mg-1;Ang Ⅱ作用24 h后,心肌细胞Nox活性较对照组明显增加。各浓度Pro处理后,Nox活性明显降低,差异有统计学意义。见图4。
2.5 Pro对AngⅡ诱导的心肌细胞JNK1/2磷酸化增强的影响 为证实Pro对AngⅡ诱导的心肌细胞JNK1/2磷酸化是否有抑制作用,免疫印迹法检测各组p-JNK1/2蛋白表达,结果示:对照组p-JNK1/2蛋白表达(相对吸光度)为(0.45±0.09);AngⅡ作用 24 h后,心肌细胞总-JNK1/2(t-JNK1/2)无显著改变,而p-JNK1/2蛋白表达较对照组明显增加,而各浓度Pro处理后能显著抑制AngⅡ诱导的JNK1/2磷酸化,差异有统计学意义(P<0.05 或 P<0.01)。见图5。
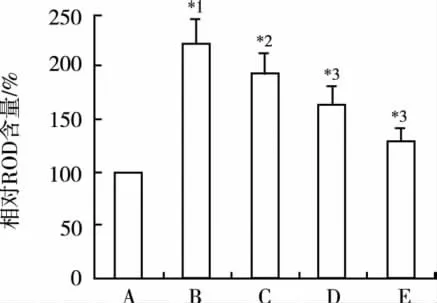
图3 Pro对ROS水平的影响(n=6)A.对照组;B.Ang Ⅱ(0.1 μmol·L-1)组;C.Ang Ⅱ(0.1 μmol·L-1)+Pro(3 μmol ·L-1)组;D.Ang Ⅱ(0.1 μmol·L-1)+Pro(10 μmol ·L-1)组;E.Ang Ⅱ(0.1 μmol·L-1)+Pro(30 μmol·L-1)组;与对照组比较,*1P<0.01;与 Ang Ⅱ(0.1 μmol·L-1)组比较,*2P<0.05,*3P<0.01Fig.3 Effects of propofol on ROS level(n=6)A.the control group;B.Ang Ⅱ(0.1 μmol·L-1)group;C.Ang Ⅱ(0.1 μmol·L-1)+Pro(3 μmol·L-1)group;D.Ang Ⅱ(0.1 μmol·L-1)+Pro(10 μmol·L-1)group;E.Ang Ⅱ(0.1 μmol·L-1)+Pro(30 μmol·L-1)group;Compared with the control group,*1P<0.01;Compared with the Ang Ⅱ group,*2P<0.05,*3P<0.01
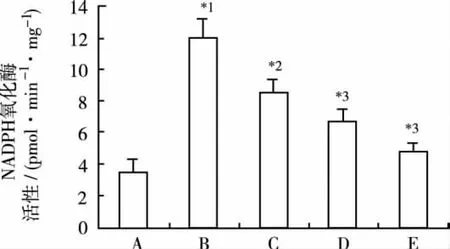
图4 Pro对Nox活性的影响(n=6)A.对照组;B.Ang Ⅱ(0.1 μmol·L-1)组;C.Ang Ⅱ(0.1 μmol·L-1)+Pro(3 μmol ·L-1)组;D.Ang Ⅱ(0.1 μmol·L-1)+Pro(10 μmol ·L-1)组;E.Ang Ⅱ(0.1 μmol·L-1)+Pro(30 μmol·L-1)组;与对照组比较,*1P<0.01;与 Ang Ⅱ(0.1 μmol·L-1)组比较,*2P<0.05,*3P<0.01Fig.4 Effects of propofol on NOX activity(n=6)A.the control group;B.Ang Ⅱ(0.1 μmol·L-1)group;C.Ang Ⅱ(0.1 μmol·L-1)+Pro(3 μmol·L-1)group;D.Ang Ⅱ(0.1 μmol·L-1)+Pro(10 μmol·L-1)group;E.Ang Ⅱ(0.1 μmol·L-1)+Pro(30 μmol·L-1)group;Compared with the control group,*1P<0.01;Compared with the Ang Ⅱ group,*2P<0.05,*3P<0.01
3 讨论
心肌细胞肥大是心肌细胞对高血压、心肌梗死及先天性心脏病等常见临床疾病的一种应答反应。长期应激所致持续性心肌肥大可增加心力衰竭和猝死风险。因此寻找有效的逆转心肌肥大的途径是目前医学研究重点。
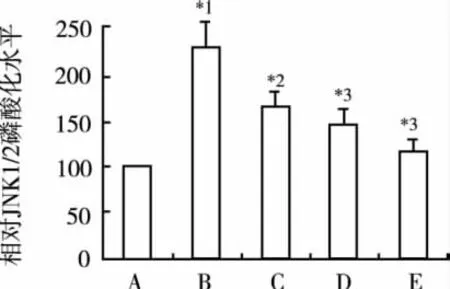
图5 Pro对JNK1/2磷酸化的影响(n=6)A.对照组;B.Ang Ⅱ(0.1 μmol·L-1)组;C.Ang Ⅱ(0.1 μmol·L-1)+Pro(3 μmol·L-1)组;D.Ang Ⅱ(0.1 μmol·L-1)+Pro(10 μmol·L-1)组;E.Ang Ⅱ(0.1 μmol·L-1)+Pro(30 μmol·L-1)组;与对照组比较,*1P<0.01;与 Ang Ⅱ(0.1 μmol·L-1)组比较,*2P<0.05,*3P<0.01Fig.5 Effects of propofol on the phosphorylation of JNK1/2(n=6)A.the control group;B.Ang Ⅱ(0.1 μmol·L-1)group;C.AngⅡ(0.1 μmol·L-1)+Pro(3 μmol·L-1)group;D.Ang Ⅱ(0.1 μmol·L-1)+Pro(10 μmol·L-1)group;E.Ang Ⅱ(0.1 μmol·L-1)+Pro(30 μmol·L-1)group;Compared with the control group,*1P<0.01;Compared with the Ang Ⅱ group,*2P<0.05,*3P<0.01
近年来,丙泊酚被广泛应用于临床,其抗氧化活性逐渐受到人们的重视。丙泊酚结构类似于内源性抗氧化剂维生素E与外源性抗氧化剂丁羟基甲苯,能有效地防治各种氧化应激损伤,机制包括清除自由基、抑制过氧化反应、抑制大鼠心肌线粒体膜通透性转换孔道开放等方面[5]。本研究结果证实,丙泊酚能显著抑制AngⅡ所上调的心肌肥大相关指标,如细胞直径、蛋白合成速率等,诱导乳鼠心肌细胞肥大,体外实验说明其参与了心力衰竭的发生、发展过程,但机制仍有待探讨。
过氧化氢、超氧阴离子及羟基统称为活性氧,能够激活AngⅡ下游的关键信号通路,介导AngⅡ诱导的心肌肥大[10]。NADPH氧化酶是胞内ROS的主要来源。本研究提示丙泊酚能显著抑制AngⅡ所上调的Nox活性及ROS水平,并能抑制ROS下游的JNK1/2磷酸化。既往动物实验以及临床研究中也发现丙泊酚具有较强的抗氧化能力[11-12]。
本研究提示,丙泊酚能抑制AngⅡ诱导的心肌细胞肥大,机制与抑制Nox活性、减少ROS水平并抑制JNK1/2磷酸化有关。但其对其他因素(如内皮素、去甲肾上腺素等)诱导的心肌肥大有无作用,尚待进一步研究。
[1]COHN J N,FERRARI R,SHARPE N.Cardiac remodeling-concepts and clinical implications:a consensus paper from an international forum on cardiac remodeling.behalf on an international forum on cardiac remodeling[J].J Am Coll Cardiol,2000,35(3):569-582.
[2]HINGTGEN S D,TIAN X,YANG J,et al.Nox2-containing NADPH oxidase and Akt activation play a key role in angiotensin Ⅱ– induced cardiomyocyte hypertrophy[J].Physiol Genomics,2006,26(3):180-191.
[3]LIU J C,CHANA P,CHEN J J,et al.Inhibitory effect of trilinolein on norepinephrine-induced b-myosin heavy-chain promoter activity,reactive oxygen species generation,and extracellular signal-regulated kinase phosphor-ylation in neonatal rat cardiomyocytes[J].J Biomed Sci,2004,11(1):11-18.
[4]ANNAT G,VIALE J P,BUI XUAN B,et al.Effect of PEEP ventilation on renalfunction, plasma renin,aldosterone, neurophysins and urinary ADH, and prostaglandins[J].Anesthesiology,1983,58(2):136-141.
[5]XIA Z,LUO T,LIU HM,et al.L-arginine enhances nitrative stress and exacerbates tumor necrosis factor-alpha toxicity to human endothelial cells in culture:prevention by propofol[J].J Cardiovasc Pharmacol,2010,55(4):358-367.
[6]CHENG T H,LEUNG Y M,CHEUNG C W,et al.Propofol depresses angiotensin Ⅱ-induced cell proliferation in rat cardiac fibroblasts[J].Anesthesiology,2010,112(1):108-118.
[7]PEDRAM A,RAZANDI M,AITKENHEAD M,et al.Estrogen inhibitscardiomyocyte hypertrophy in vitro.Antagonism of calcineurin-related hypertrophy through induction of MCIP1[J].J Biol Chem,2005,280(28):26339-26348.
[8]钟蓓华,罗健东,张贵平.辛伐他汀对过氧化氢损伤的心肌细胞的保护作用[J].医药导报,2006,25(1):16-18.
[9]张婧,王建昌,黄秀清,等.外周血单个核细胞NADPH氧化酶活性及表达与颈动脉硬化的关系研究[J].中国老年医学杂志,2008,28(2):146-149.
[10]BENDALL J K,CAVE A C,HEYMES C,et al.Pivotal role of a gp91(phox)–containing NADPH oxidase in angiotensin Ⅱ– induced cardiac hypertrophy in mice[J].Circulation,2002,105(3):293-296.
[11]YUMOTO M,NISHIDA O,NAKAMURA F,et al.Propofol attenuates oxidant-induced acute lung injury in an isolated perfused rabbit-lung model[J].J Anesth,2005,19(4):287-294.
[12]ARNAOUTOGLOU H,VRETZAKIS G,SOULIOTIS D,et al.The effects of propofol or sevoflurane on free radical production after tourniquet induced ischaemia-reperfusion injury during knee arthroplasty[J].Acta Anaesthesiol Belg,2007,58(1):3-6.

