磁流体热疗对肺癌A549裸鼠移植瘤抑制作用的实验研究
胡润磊 李 浒 柯贤福 王国卿 魏东山 王 炜
局部热疗是近年来发展较快的一种肿瘤治疗方法,传统的热疗方法主要有射频热疗、微波热疗和超声热疗等。但是,射频热疗过程中由于电场较发散,不能对肿瘤准确的聚焦,从而导致肿瘤周围脂肪过热。微波的穿透深度非常有限,常只能作浅表肿瘤的热疗;超声不能穿透含气空腔,因此应用比较局限。磁流体热疗(magnetic fluid hyperthernia,MFH)是将纳米技术和热疗技术相结合的一种新兴热疗方法。Jordan首先开展了此方面的研究,将磁流体通过直接注射的方式到达肿瘤内部,磁流体在交变磁场下通过Neel松弛机制升温[1,2]。由于磁性颗粒是通过直接注射的方式到达肿瘤内部,周围正常组织由于没有磁性颗粒的分布,升温不明显或不升温,因此大大提高了热疗的靶向性。本研究将Fe3O4磁流体在交变磁场作用下对肺癌A549裸鼠移植瘤进行了初步研究,研究了其作用机制,探讨了磁流体热疗治疗肺癌的可行性。
材料与方法
1.主要材料:(1)试剂:主要试剂:MTT(四唑氮盐),DMSO(二甲亚砜),胰蛋白酶,细胞培养基粉(RPMI1640)由Sigma公司提供。(2)细胞株:人肺癌细胞株A549,由杭州昊天生物有限公司提供。用含10%胎牛血清RPMI1640培养液常规传代培养。(3)磁流体:纳米级Fe3O4颗粒,采用化学共沉淀法制成胶体混悬液,呈黑色。样品粒径范围为10~40nm,磁饱和度:磁饱和强度是360GS。样品使用前均以超声波处理5min,使Fe3O4颗粒分布更均匀。(4)实验动物:4~5周龄BALB/C雌性裸小鼠32只,质量20~24g,浙江省医学科学院动物实验中心提供并饲养,实验动物生产许可证号:SCXK(浙)2008-0035。饲养于浙江省实验动物中心实验动物屏障系统,空气洁净度万级,换气次数15次/小时,温度21~24℃,湿度75% ~80%。实验动物使用许可证号:SYXK(浙)2008-0113。(5)主要仪器设备:高频感应加热机:型号:SP-04AC 4kW,深圳市双平电源技术有限公司提供。频率为率100~250kHz,感应线圈由4匝直径为4mm的铜管平行绕成内径为3cm,长为4cm的线圈,铜管内通循环水。①流式细胞仪(FCM):型号EPICS XL型,美国Coulter公司;②透射电镜:JEM-1230型透射电镜,日本JEOL公司;③测温设备:光纤温度传感器,YF-200。
2.实验方法:(1)人肺癌A549裸鼠移植瘤模型的建立:将处于对数生长期的人肺癌 A549细胞,以0.25%胰酶+0.02%EDTA液进行消化,以血细胞计数板进行计数后用不含血清的DMEM培养液稀释,调整细胞浓度为1×107/ml。用1ml注射器分别在裸鼠背部皮下注射上述细胞悬液0.2ml。观察小鼠精神、饮食及排便等情况,每周用游标卡尺测量肿瘤的长径(a)、短径(b),按公式V=ab2/2,估算肿瘤近似体积。(2)磁流体热疗:接种后第21天,各组移植瘤平均直径约6mm,在预实验的基础上将裸鼠随机分为:对照组、低剂量组,中剂量组、高剂量组,每组8只。2%戊巴比妥钠(50mg/kg)腹腔注射麻醉。①对照组:予以1次进针、多点注射0.2ml的生理盐水;②低剂量组:予以1次进针、多点注射0.2ml浓度为67.5mg/ml的磁流体,含磁流体约13.5mg;③中剂量组:予以1次进针、多点注射0.2ml浓度为90.0mg/ml的磁流体,含磁流体约18mg;④高剂量组:予以1次进针、多点注射0.2ml浓度为112.5mg/ml的磁流体,含磁流体约22.5mg。3个实验组在注射磁流体后24h,分别在交变磁场作用下作用30min,光纤传感器测量肿瘤内部和肛门的温度。(3)病理学观察:加温后48 h,各组随机挑选2只裸鼠,离断法处死,迅速取出瘤体,剖开经10%甲醛缓冲液固定,石蜡包埋切片,苏木素-伊红(HE)染色,光学显微镜下观察肿瘤组织学变化。另一部分瘤体4%预冷戊二醛4℃固定过夜,1%的锇酸溶液固定样品1~2h,将经过渗透处理的样品包埋起来,70℃加热过夜,在Reichert超薄切片机中切成70~90nm的薄片,用柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液各染色15min,透射电镜中观察。(4)热疗对荷瘤小鼠瘤体的抑制作用:热疗后第21天,离断法处死所有的荷瘤小鼠,剥取瘤体,天平称重。根据瘤体的体积计算各组的肿瘤体积抑制率,肿瘤体积抑制率=(1-实验组瘤体体积/对照组瘤体体积)×100%。根据各组荷瘤小鼠瘤重计算肿瘤的质量抑制率,肿瘤质量抑制率=(1-实验组瘤体质量/对照组瘤体质量)×100%。
结 果
1.移植瘤生长情况:裸鼠一般情况及皮下成瘤:32只裸鼠成瘤,成瘤率100% ,瘤结节形成时间为细胞种植后第4~13天,集中在第8~10天。肿瘤细胞种植后第21天,肿瘤直径平均达6mm。成瘤后早期裸鼠的体质量和活动情况没有明显改变,随着肿瘤形成并逐渐增大,裸鼠逐渐出现消瘦,活动减少。
2.磁流体热疗对移植瘤的抑制作用:磁流体在低剂量组、中剂量组、高剂量组瘤体的平均温度分别为41.3℃、44.5℃、46.8℃,小鼠肛门温度在 30 ~ 34℃之间。热疗后第21天,4组的体积分别为:对照组831.0 ±126.2mm3、低剂量组 713.2 ±157.1mm3、中剂量组399.2 ±199.2mm3、高剂量组 247.3 ±102.0mm3。低、中、高剂量组体积抑制率分别为14.1%、51.9%、70.2%。方差分析组间差异显示,与对照组比较,中剂量组、高剂量组肿瘤生长明显缓慢,差异有统计学意义(P均<0.05)。低剂量组的肿瘤体积与对照组比较无明显差异(P>0.05),各组肿瘤体积增长趋势见图1。
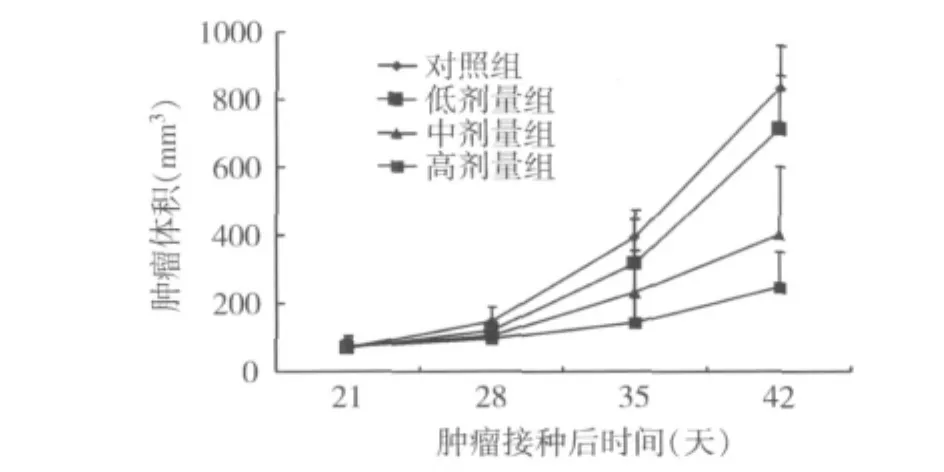
图1 各组A549肺癌裸鼠移植瘤生长曲线
4组的瘤体重量分别为:对照组1.71±1.11g,低剂量组1.51 ±0.25g,中剂量组 0.93 ±0.40g,高剂量组0.65 ±0.21g,低、中、高剂量组质量抑瘤率分别为11.7%、45.6%、62.0%,方差分析组间差异显示,与对照组比较,中剂量组、高剂量组肿瘤生长明显缓慢,差异有统计学意义(P<0.05)。低剂量组的肿瘤重量与对照组比较无明显差异(P>0.05)(表1)。
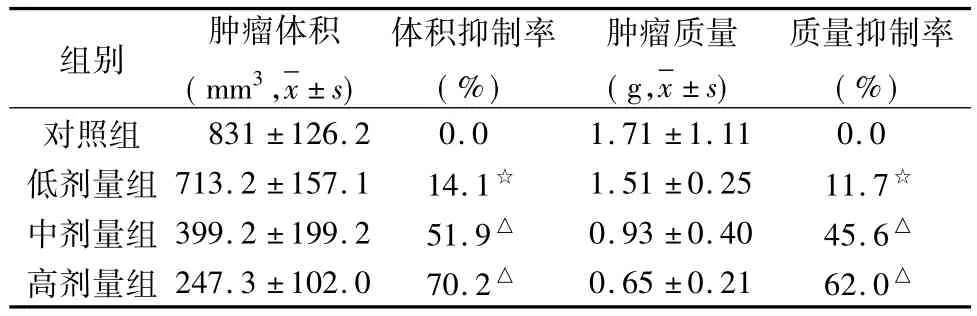
表1 不同剂量的磁流体热疗后对小鼠瘤体体积和质量抑制作用
3.热疗后移植瘤的病理学观察:(1)大体观察:磁流体热疗后,对照组的移植瘤体积进行性增长,瘤体表面光整。实验组瘤体表面颜色出现暗淡(磁流体的颜色为褐色),出现表面结痂,进而出现局部坏死,坏死脱落后表面凹凸不平,肿瘤生长明显减慢,以高剂量组瘤体最明显。(2)光镜观察:低剂量组肺癌细胞在热疗后正常形态无明显改变,细胞区域看到磁流体的分布,中剂量组的肺癌细胞在热疗后出现局部凝固样坏死改变,表现为嗜酸性增强,在坏死区域有磁流体的分布。高剂量组肺癌细胞同样出现凝固样坏死改变,但坏死区域较中剂量组明显增加,在坏死区域有磁流体的分布(图2)。

图2 各组肿瘤在磁流体热疗后的光镜下表现(HE×400)
4.电镜观察:低剂量组肺癌细胞在热疗后与对照组肺癌细胞比较无明显变化;中剂量组肺癌细胞出现典型的凋亡样改变,表现为染色体边聚、胞质空泡化、细胞核裂解;高剂量组肺癌细胞核呈现溶解,正常细胞结构消失,呈坏死表现(图3)。
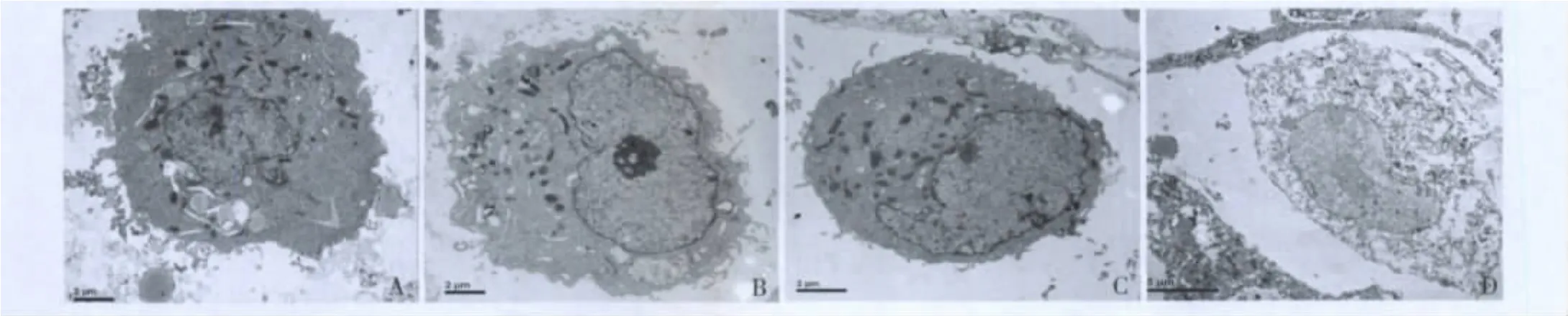
图3 各组肺癌细胞磁流体热疗后的透射电镜观察
讨 论
肺癌是严重危害人民生命健康的常见疾病。其发病率和病死率已居所有癌症之首[1]。但由于大部分患者发现已属晚期,手术效果差,传统的放化疗由于不良反应大且价格昂贵,多数患者不能耐受。因此,探索一种新的有效的治疗肺癌的方法成为我们工作首要任务。近年来,以射频为主的传统的热疗方法对肺癌的局部控制起到了良好的作用,但是射频加温由于电场较发散,不能对肿瘤准确定位,导致脂肪过热,因此靶向性差,应用比较局限[2]。
磁流体热疗的一个优点就是高度靶向性和特异性,我们将磁流体热疗对裸鼠肺癌移植瘤进行治疗实验,结果证实磁流体在肿瘤内部可以升温至有效的治疗温度,而小鼠肛门温度却稳定在30~34℃之间,说明周围正常组织没有明显的升温,初步实现了磁流体热疗的靶向性。
研究证实,热疗的有效温度是 >42.0℃[3]。Ivkov等[4]报道当磁流体的温度升高至有效温度以后,磁流体热疗对肿瘤的抑制效果与温度呈剂量-效果依赖关系。我们将不同剂量的磁流体注射到瘤体内部,结果发现,低剂量组的肿瘤内部温度升温至41.3℃左右,没有明显的抑瘤效果,而中、高剂量组的温度均升高至42.0℃以上,抑瘤效果明显,高剂量组的抑瘤效果较中剂量组明显(P<0.05)。与上述报道基本一致,证实了磁流体热疗的可操作性。
研究表明,热疗可以诱导肿瘤细胞凋亡,导致坏死,在42.0~46.0℃条件下,肿瘤细胞已凋亡为主,在46.0℃以上的条件下,高温可以直接导致肿瘤细胞坏死[5]。我们通过光镜观察,中、高剂量组肿瘤细胞加热后大量出现凝固性坏死的征象,表现为嗜酸性增强,正常细胞结构消失,核碎裂、溶解;在坏死的一些区域偶可见出血灶,表现为坏死肿瘤细胞周围大量的红细胞分布,血管破裂;磁流体分布于凋亡和坏死的区域中。电镜观察中剂量组肿瘤细胞呈典型的凋亡样改变,表现为染色质边集、胞质空泡化、细胞核裂解,在高剂量组,细胞核呈现溶解,正常细胞结构消失,呈坏死表现。证实磁流体热疗可以诱导肺癌细胞凋亡,在高温时直接导致肺癌细胞坏死。
但磁流体热疗对肿瘤的具体作用机制目前还有争议,翟羽等[6]研究发现,磁流体热疗后实验组肿瘤的细胞的凋亡无明显增加,诱导凋亡不是抑制移植瘤生长的主要原因,可能与研究的条件、肿瘤的属性等因素有关。
总之,我们的结果证实磁流体热疗对肺癌裸鼠移植瘤具有明显抑制作用,热疗后肺癌细胞呈现凋亡和坏死样改变,在有效温度范围的抑瘤效果与温度呈剂量-效果依赖关系。将为磁流体热疗在肺癌领域的进一步深入研究打下良好的基础。
1 Parkin DM,Bray F,Ferlay J,et al.Global cancer statistics[J].Ca Cancer J Clin,2005,55:74 -108
2 Samanta B,Yan H,Fischer NO,et al.Protein-passivated Fe3O4 nanoparticles:low toxicity and rapid heating for thermal therapy[J].J Mater Chem,2008,18(11):1204 -1208
3 Tseng HY,Lee GB,Lee CY,et al.Localised heating of tumours utilising injectable magnetic nanoparticles for hyperthermia cancer therapy[J].IET Nanobiotechnol,2009,3(2):46-54
4 Ivkov R,DeNardo SJ,Daum W,et al.Application of high amplitude alternating magnetic fields for heat induction of nanoparticles localized in cancer[J].Clin Cancer Res,2005,11(19 Pt 2):7093-7103
5 Shellman YG,Howe WR,Miller LA,et al.Hyperthermia induces endoplasmic reticulum-mediated apoptosis in melanoma and non-melanoma skin cancer cells[J].J Invest Dermatol,2008,128(4):949 -956
6 翟羽,谢弘,古宏晨.葡聚糖磁流体热处理对小鼠H22移植瘤生长的影响及机制初探[J].肿瘤防治研究,2006,33(3):141 -144