污染肝素钠中多硫酸化硫酸软骨素测定方法新进展
,,
(1.青岛科技大学化学院,山东 青岛 266042;2.青岛九龙生物医药有限公司,山东 胶州 266319)
2008年初,美国及欧洲等12个国家发生了严重的肝素钠(Heparin sodium)注射液不良反应事件[1],引发数百例病人产生过敏反应[2~5],最终导致约百例病人死亡[6~8],此批肝素钠原料中的类肝素杂质多硫酸化硫酸软骨素(Oversulfated chondroitin sulfate,OSCS)[3],可能为引起病人不良过敏反应的异常杂质[4]。随后在数批肝素钠及低分子肝素钠中均发现此杂质[9,10]。各国专家从分子结构、药理、临床等方面对OSCS的毒性进行了论证。2008年6月,Kishimoto等[11]证实OSCS是引发过敏反应的污染物。2009年初,Zhang等[6]证实OSCS有毒,可能是致百例病人死亡的原因。关于OSCS的来源也有多种说法,Marco等[3]根据OSCS的结构认为OSCS不是天然存在,而是人工合成的。Keire等[12]认为OSCS是人工半合成的,在巨大经济利益驱动下,人为添加到肝素钠中。Pan等[13]指出OSCS更可能来源于多硫酸化的糖胺聚糖废料。虽然对OSCS的来源和致病原因有待统一,但各国专家普遍认为肝素钠中的OSCS必须除去。因此,肝素钠中OSCS的检测至关重要。
OSCS的结构、电荷密度、分子量、抗凝活性均与肝素(Heparin,HP)相似[6],到目前为止,约有近十种检测方法应用到HP与OSCS的鉴别中。其中,核磁共振波谱法、高效液相色谱法、电泳法、红外光谱法、电化学法、荧光检测法等显示出良好的应用前景。
1 肝素钠与OSCS的结构与性质
糖类药物肝素钠是由葡萄糖胺、L-艾杜糖醛酸、N-乙酰葡萄糖胺和D-葡萄糖醛酸交替组成的粘多糖硫酸酯钠盐,糖环的连接方式主要是1,4位连接,主要重复单元为氨基葡萄糖(GlcNs6s)和艾杜糖醛酸(IdoA2s),平均分子量为12 000~15 000[6,14],作为抗凝剂广泛应用于血液透析、外科手术、肾脏透析等治疗[15~17],临床应用已有75年的历史[18]。目前,肝素钠主要从猪小肠粘膜中分离纯化获得[19,20],如此复杂的大环境决定了肝素钠的复杂性,肝素钠有多种类似物,如硫酸乙酰肝素(HS)、硫酸软骨素(CS)、硫酸皮肤素(DS)、OSCS、透明质酸(HA)、多硫酸化硫酸皮肤素(OSDS)、多硫酸化透明质酸(OSHA)等[6]。其中CS是肝素钠常含有的杂质,DS具有和肝素钠非常相似的结构。CS与肝素钠结构的主要不同点在于糖环的连接方式,CS的糖环为1,3位连接,CS的主要重复单元为D-葡萄糖醛酸和N-乙酰氨基半乳糖[21]。HP、CS、DS、OSCS结构中的主要二糖单元见图1。
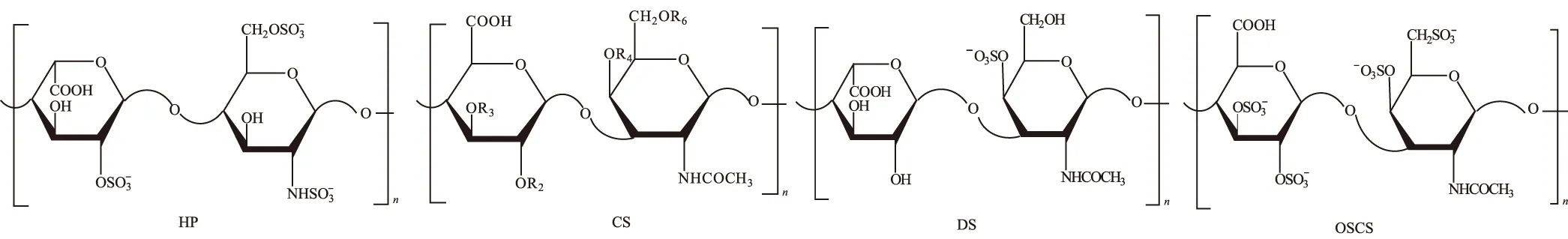
图1 HP、CS、DS、OSCS的主要二糖单元
2 肝素钠中OSCS的测定方法
2.1 核磁共振波谱法
Marco等[3]应用高分辨率核磁共振波谱法对肝素钠中的潜在污染物进行了分析。首先通过核磁共振氢谱分析发现污染肝素钠比正常肝素钠多了许多新信号,如化学位移2.16 ppm处的信号不同于肝素钠的正常信号2.04 ppm和已知杂质DS的正常信号2.08 ppm;碳谱分析表明,污染肝素钠比正常肝素钠多了几个信号,如化学位移25.6 ppm和53.5 ppm处的信号与DS的信号24.8 ppm和54.1 ppm也不同,表明污染肝素钠中有氧取代的N-乙酰半乳糖胺;通过二维核磁共振测试(如HSQC和TOCSY、COSY、ROSEY谱),进一步证实氢谱化学位移2.08 ppm处的信号为DS,通过详细的结构解析,发现污染物的重复二糖单元为葡萄糖醛酸1,3位连接N-乙酰半乳糖胺,该二糖结构有着不同寻常的硫酸化模式,葡萄糖醛酸的2位与3位被硫酸化、半乳糖胺的4位与6位被硫酸化,从而确定污染物为OSCS。
Zhang等[6]对1941~2008年期间的31批不同来源的肝素钠样品进行了1HNMR检测,指出污染物OSCS、OSDS、OSHA的乙酰基中甲基信号的化学位移(ppm)分别为2.15、2.14、2.17。分别提供了纯肝素钠加入20种类肝素污染物的1HNMR谱图,得出这20种污染物的检出限为0.5%~10%,其中OSCS的检出限为0.5%。
Keire等[18]应用核磁共振氢谱法检测肝素钠粗品中的污染物OSCS,检出限和定量检出限分别为0.1%和0.3%。
Sitkowski等[22]应用DOSY-NMR方法对肝素钠及低分子肝素钠(LMWH)中的污染物OSCS进行了分析。肝素钠、OSCS、LMWH的分子量不同,在DOSY-NMR实验中表现为平动扩散系数(Dt)的不同,分子量大的物质(如OSCS),扩散较慢,则Dt较小;反之,分子量小的物质(如LMWH),扩散较快,则Dt较小。根据Dt值就可对样品的纯度进行判断。研究结果表明:OSCS、LMWH、肝素钠相应的N-乙酰氨基信号的Dt分别为:0.30×10-10m2·s-1、1.05×10-10m2·s-1、0.38×10-10m2·s-1;根据Dt值不仅能对污染物OSCS进行鉴别,而且还能区分开LMWH与肝素钠。但对国际市场上OSCS污染的低分子肝素钠样品进行DOSY-NMR实验分析发现:OSCS的N-乙酰氨基特征峰的化学位移为2.15 ppm、Dt为0.70×10-10m2·s-1,而不是0.30×10-10m2·s-1。针对这一矛盾,作者提出假设:随着肝素钠在碱性条件下降解为低分子肝素钠,此时OSCS也降解为低分子多硫酸化硫酸软骨素(LOSCS),LOSCS和OSCS的N-乙酰氨基特征峰在相同的化学位移2.15 ppm处,故Dt增大。为了验证这一假设,向该样品中加入纯的OSCS,结果化学位移2.15 ppm处的信号强度增加、Dt由0.70×10-10m2·s-1变为0.50×10-10m2·s-1,验证了作者的假设。
Peter等[9]应用标准2D1H-1HNMR NOESY谱鉴别肝素钠中潜在的污染物,如OSCS、CSA、DS等。当前常规1D1HNMR主要是通过污染物与肝素钠中N-乙酰氨基信号不同来鉴别和区分的,化学位移主要集中在2.00~2.20 ppm,对于某些没有N-乙酰氨基的多糖污染物或其N-乙酰氨基与肝素钠N-乙酰氨基信号部分或完全重叠的污染物,常规1D1HNMR方法很难进行鉴别,而2D1H-1HNMR NOESY谱不只局限于N-乙酰氨基的信号,同时将相应的鉴别信号延伸至糖环信号部分,弥补了常规1D1HNMR方法的不足。此外,作为常规1D1HNMR的补充,对肝素钠中污染物提供更为精细的指纹分析与鉴别,可为鉴别结果提供更为可靠的依据。Peter等首先对2D1H-1HNMR NOESY实验条件、采样、处理参数进行了优化;然后对肝素钠和污染物OSCS、CSA、DS分别进行2D1H-1HNMR NOESY测试,得到肝素钠、OSCS、CSA、DS的标准参照谱图;最后对OSCS污染的肝素钠和DS污染的肝素钠进行2D NOESY实验,从2D谱中分别抽取出1D OSCS谱、1D DS谱,与标准参照谱图进行比对,确定污染物为OSCS和DS。作者还对含有少量CSA杂质的肝素钠样品进行了2D NOESY实验,CSA的N-乙酰氨基的信号与肝素钠的信号重叠,且CSA在3~6 ppm间糖环信号均被肝素钠糖环强信号所掩盖,因此常规1D1HNMR很容易忽视此杂质,但在2D1H-1HNMR NOESY实验中,通过精密的指纹分析确定了杂质CSA的存在。
Keire等[12]应用500 MHz1HNMR分析了肝素钠类似物CSA、CSB、OS-CSA、OS-CSB,发现各化合物的特征峰化学位移(ppm)分别为:2.02、2.08、2.15、2.09/2.12。作者指出了核磁共振氢谱的缺陷:HS、OS-HS、OS-HEP和局部硫酸化CSA的特征峰的化学位移和肝素钠特征峰的化学位移在同一位置2.04 ppm处,单用核磁共振氢谱很难鉴别这些污染物。
高照明等[23]对肝素钠、OSCS标准品进行了1HNMR测试并对谱图进行了全归属,指出肝素钠和OSCS的乙酰甲基特征峰的化学位移在2.15 ppm处;考察了测试条件,结果表明:当样品浓度为25 mg·(0.6 mL)-1、定标物TSP含量为0.020%(质量体积比)、样品的旋转为12 Hz、处理参数(LB)为1.0、仪器频率为500 MHz时,能快速、准确地检测出肝素钠中的污染物;应用核磁共振内标法定量分析了肝素钠中OSCS[24],结果表明杂质OSCS在0.1%~5%范围内具有良好的线性关系,拟合线性回归方程为:y=2.7929x-0.0317,相关系数R=0.9994,检出限为0.1%,平均回收率为98.1%(n=6),重复性实验的RSD为0.35%(n=6);表明该方法作为多糖药物肝素钠中杂质的定量分析方法具有快速、简便、准确、重复性好的优点。
2.2 高效液相色谱法
Trehy等[20]应用强阴离子交换高效液相色谱法对污染肝素钠中的OSCS及DS进行了检测,用pH值为3的0.125~2.5 mol·L-1的氯化钠磷酸缓冲溶液作为流动相进行梯度洗脱,紫外检测波长为215 nm,DS、HP、OSCS的保留时间分别约为16.0 min、 19.2 min、 22.0 min,OSCS的检出限和定量检出限分别为0.03%和0.1%,DS的检出限和定量检出限分别为0.1%和0.8%。
Keire等[12]对肝素钠中的天然杂质(CSA,DS,HS)及人工合成污染物(OS-CSA,OS-CSB,OS-HS,OS-HEP)进行了强阴离子交换高效液相色谱法分析,结果表明:此类污染物的检出限范围为0.05%~0.12%,其中DS的检出限为0.1%、CSA的检出限为0.03%。
Keire等[18]应用强阴离子交换高效液相色谱法分析了肝素钠粗品中的OSCS,检出限及定量检出限分别为0.03%及0.09%;进一步改进方法,即将肝素钠粗品溶于100 mg·mL-1的2.5 mol·L-1氯化钠溶液中,检出限及定量检出限分别提高至0.02%和0.07%。
赵峡等[25]应用柱前衍生高效液相色谱法分析了问题肝素钠中OSCS的含量,基于肝素钠和OSCS在单糖组成上的差别,采用3 mol·L-1三氟乙酸,将问题肝素钠在110 ℃下充氮封管水解4 h,再在碱性条件下与 1-苯基-3-甲基-5-吡唑啉酮进行衍生化反应,然后采用C18反相色谱柱,以0.1 mol·L-1磷酸盐(pH=6.7)缓冲溶液-乙腈(体积82∶18)为流动相,在流速 1.0 mL·min-1、柱温25 ℃及紫外检测波长245 nm的条件下进行液相色谱分析,结果表明,在0.2~4.0 mg·mL-1浓度范围内,色谱峰面积与OSCS的浓度具有良好的线性关系,以色谱峰面积(A,×10-5mAu)为横坐标、OSCS的浓度(p,mg·mL-1)为纵坐标绘制标准曲线,拟合线性回归方程为A=34.7071p-0.9811(R=0.9987)。此方法具有操作简单、灵敏度高及重现性好等特点。
2.3 电泳法
Valeria等[4]应用高灵敏度的混合物聚合体电动色谱系统检测肝素钠样品中的杂质OSCS和DS。电动色谱系统由0.5%(质量体积比)β-环糊精、0.4%(质量体积比)Tetronic 1107和pH值3.5的0.4 mol·L-1磷酸盐缓冲溶液组成。最佳电泳条件为:长50 cm、直径70 μm的未经二氧化硅涂布的毛细管,外加电压为-7 kV,检测温度为300 ℃、紫外检测波长为200 nm。此方法具有较低的检出限,OSCS和DS的检出限分别为0.07%(0.07 μg·mL-1)、0.1%(0.1 μg·mL-1),定量检出限分别为0.2%(0.2 μg·mL-1)、0.3%(0.3 μg·mL-1)。
肝素钠不良过敏反应事件中,在低分子肝素钠中也发现了污染物OSCS[19]。Zhang等[26]应用5种方法(亚硝酸法、肝素裂解酶I法、高碘酸盐氧化法、碱处理法、双氧水氧化法)对肝素钠样品、OSCS样品及两者1∶1的混合样品进行解聚,用聚丙烯酰胺凝胶电泳(PAGE)法对解聚产物进行分析。结果表明,亚硝酸法、肝素裂解酶I法、高碘酸盐氧化法均可以解聚肝素钠制备低分子肝素钠,但均不能解聚OSCS,用这三种方法制备的混合样品中,低分子肝素钠中的OSCS和解聚前样品的一样,均为高分子OSCS;碱处理法和双氧水氧化法均可以解聚肝素钠和OSCS,且碱处理方法中肝素钠的解聚程度高于OSCS,双氧水氧化法中肝素钠的解聚程度低于OSCS,这两种方法制备的混合样品中,低分子肝素钠中含有的OSCS为低分子OSCS,最后用1HNMR对OSCS的解聚产物进行了验证。
王皓等[27]采用离子交换色谱法从污染肝素钠原料中分离出OSCS,建立了分步醋酸纤维素薄膜电泳法分析污染肝素钠中OSCS含量的方法。结果表明:先以0.05 mol·L-1醋酸钡缓冲溶液(pH值5.0)电泳、再以0.15 mol·L-1醋酸锌缓冲溶液(pH值6.3)电泳,可以将肝素钠和OSCS完全分开,检出限为0.1 g·L-1,通过灰度积分建立定量校准曲线,相关系数为0.9934、平均回收率为102.1%~106.1%、RSD为4.1%~6.0%。该方法简便、快速、成本低。
2.4 红外光谱法
Spencer等[28]应用近红外反射及拉曼光谱学技术对国内外69批次肝素钠中的OSCS进行了检测。根据28批次样品中的3种主要成分肝素钠、OSCS、糖胺聚糖建立了最小偏二乘法回归模型,使得样品的近红外与拉曼谱图和样品的毛细管电泳分离图谱相关,并成功预测了41批样品的组成成分。该方法筛选肝素钠样品具有迅速、无损等优点。
2.5 电化学法
Gemene等[29]和Wang等[30,31]应用电位聚阴离子传感器对肝素钠中的OSCS进行了定量分析,此传感器是基于电势测定分析方法的动力学模式,通过调整试样的浓度范围来完成的。聚合物传感器的离子选择性电极是涂有亲脂性阴离子交换剂三十二烷基甲基氯化铵(TDMAC)的聚氯乙烯薄膜。由于OSCS的电荷密度比肝素钠大,与TDMAC形成的离子对具有较大的平衡常数,而聚阴离子传感器平衡电势的大小直接与聚阴离子的电荷密度成正比,即可对OSCS进行定量分析。即使试样中OSCS的浓度足够低,也会引起相界面平衡电势的变化,因此该方法具有检出限较低的优点,定量检出限为0.2%(质量分数)。
2.6 荧光检测法
Lühn等[32]和Alban等[33]应用微孔板荧光检测法对肝素钠中的OSCS进行了定量检测。建立了由肝素钠-甲基丙烯酰胺组成的荧光传感器,此聚合物荧光性只依赖于肝素钠及OSCS的浓度。首先用肝素酶I对肝素钠样品进行降解,待肝素钠完全降解后分离出OSCS,再单独检测OSCS的荧光性。该方法检测OSCS的检出限及定量检出限分别为0.5%、0.6%。
3 结语
迄今为止,肝素钠中OSCS的检测方法已有多种,其中核磁共振氢谱法和毛细管电泳法是最早应用的方法,核磁共振氢谱法具有快速、操作简单、样品无损、检出限低、谱图直观等优点而被美国及欧洲药典收录;毛细管电泳法操作复杂,分析时间长,逐渐被近期发展的强阴离子交换高效液相色谱法所替代;红外光谱谱峰重叠,结果较难判断且检出限较高;电化学法和荧光检测法具有较低的检出限和较高的灵敏度,但人为操作误差大、重复性有待提高。综合而言,OSCS的定量分析方法中,强阴离子交换高效液相色谱法的检出限最低,核磁共振氢谱法结合强阴离子交换高效液相色谱法可保证肝素钠不受OSCS的污染,可作为肝素钠质量控制的分析方法。
[1] Blossom D B,Kallen A J,Patel P R,et al.Outbreak of adverse reactions associated with contaminated heparin[J].The New England Journal of Medicine,2008,359(25):2674-2684.
[2] Beyer T,Diehl B,Randel G,et al.Quality assessment of unfractionated heparin using1H nuclear magnetic resonance spectroscopy[J].Journal of Pharmaceutical and Biomedical Analysis,2008,48(1):13-19.
[3] Marco Guerrini,Beccati Daniela,Zachary Shriver,et al.Oversulfated chondroitin sulfate is a contaminant in heparin associated with adverse clinical events[J].Nature Biotechnology,2008,26(6):669-675.
[4] Valeria Tripodi,Sabrina Flor,Cecilia Dobrecky,et al.Novel and highly sensitive mixed-polymeric electrokinetic chromatography system for determination of contaminants and impurities of heparin samples[J].Electrophoresis,2010,31(21):3606-3612.
[5] Marco Guerrini,Zhang Zhenqing,Zachary Shriver,et al.Orthogonal analytical approaches to detect potential contaminants in heparin[J].Proceedings of the National Academy of Sciences,2009,106(40):16956-16961.
[6] Zhang Zhenqing,Li Boyangzi,Suwan Jiraporn,et al.Analysis of pharmaceutical heparins and potential contaminants using1HNMR and PAGE[J].Journal of Pharmaceutical Sciences,2009,98(11):4017-4026.
[7] WHO.Contaminant Detected in Heparin Material of Specified Origin in the USA and in Germany;Serious Adverse Events Reported; Recall Measures Initiated.http://www.int/medicines/publications/drugalerts/Alert 118 Heparin.pdf.
[8] Pan Jing,Qian Yi,Zhou Xiaodong,et al.Identification of chemically sulfated/desulfated glycosaminoglycans in contaminated heparins and development of a simple assay for the detection of most contaminants in heparin[J].Glycobiology Insights,2010,2(1):1-12.
[9] Peter Bigler,Rudolf Brenneisen.Improved impurity fingerprinting of heparin by high resolution1HNMR spectroscopy[J].Journal of Pharmaceutical and Biomedical Analysis,2009,49(4):1060-1064.
[10] Bairstow Shawn,McKee Jeff,Nordhaus Mark,et al.Identification of a simple and sensitive microplate method for the detection of oversulfated chondroitin sulfate in heparin products[J].Analytical Biochemistry,2009,388(2):317-321.
[11] Kishimoto T K,Viswanathan K,Ganguly S T,et al.Contaminated heparin associated with adverse clinical events and activation of the contact system[J].The New England Journal of Medicine,2008,358(23):2457-2467.
[12] Keire David A,Mans Daniel J,Ye Hongping,et al.Assay of possible economically motivated additives or native impurities levels in heparin by1HNMR,SAX-HPLC,and anticoagulation time approaches[J].Journal of Pharmaceutical and Biomedical Analysis,2009,52(5):656-664.
[13] Pan J,Qian Y,Zhou X,et al.Oversulfated chondroitin sulfate is not the sole contaminant in heparin[J].Nature Biotechnology,2010,28(3):203-207.
[14] Rabenstein Dallas L.Heparin and heparan sulfate:Structure and function[J].Nature Products Reports,2002,19(3):312-331.
[15] Volpi N,Maccari F,Linhardt R J.Quantitative capillary electrophoresis determination of oversulfated chondroitin sulfate as a contaminant in heparin preparations[J].Analytical Biochemistry,2009,388(1):140-145.
[16] Li B,Suwan J,Martin J,et al.Oversulfated chondroitin sulfate interaction with heparin-binding proteins:New insights into adverse reactions from contaminated heparins[J].Biochemical Pharmacology,2009,78(3):292-300.
[17] Volpi N, Maccari F, Linhardt R J. Capillary electrophoresis of complex natural polysaccharides[J].Electrophoresis,2008,29(15):3095-3106.
[18] Keire David A,Trehy Michael L,Reepmeyer John C,et al.Analysis of crude heparin by1HNMR,capillary electrophoresis,and strong-anion-exchange-HPLC for contamination by oversulfated chondroitin sulfate[J].Journal of Pharmaceutical and Biomedical Analysis,2010,51(4):921-926.
[19] Liu Haiying,Zhang Zhenqing,Linhardt Robert J.Lessons learned from the contamination of heparin[J].Nature Products Reports,2009,26(3):313-321.
[20] Trehy Michael L,Reepmeyer John C,Kolinski Richard E,et al.Analysis of heparin sodium by SAX/HPLC for contaminants and impurities[J].Journal of Pharmaceutical and Biomedical Analysis,2009,49(3):670-673.
[21] Beni Szabolcs,Limtiaco John F,Larive C K.Analysis and characterization of heparin impurities[J].Analytical Bioanalytical Chemistry,2011,399(2):527-539.
[22] Sitkowski Jerzy,Bednarek Elzbieta,Bocian Wojciech,et al.Assessment of oversulfated chondroitin sulfate in low molecular weight and unfractioned heparins diffusion ordered nuclear magnetic resonance spectroscopy method[J].Journal of Medicinal Chemistry,2008,51(24):7663-7665.
[23] 高照明,张玉冰.1HNMR分析肝素钠中杂质多硫酸软骨素[J].波谱学杂志,2011,28(2):278-289.
[24] 高照明,张玉冰,于永良.核磁共振内标法定量分析肝素钠中多硫酸软骨素[J].分析化学,2011,39(4):601-602.
[25] 赵峡,李广生,于广利,等.问题肝素中多硫酸软骨素杂质的柱前衍生高效液相色谱分析[J].高等学校化学学报,2010,31(3):479-483.
[26] Zhang Zhenqing,Weïwer Michel,Li Boyangzi,et al.Oversulfated chondroitin sulfate:Impact of a heparin impurity,associated with adverse clinical events,on low-molecular-weight heparin preparation[J].Journal of Medicinal Chemistry,2008,51(18):5498-5501.
[27] 王皓,于广利,赵峡.污染肝素中多硫酸化硫酸软骨素的分步醋酸纤维素薄膜电泳分析[J].分析化学,2009,37(8):1147-1151.
[28] Spencer J A,Kauffman J F,Reepmeyer J C,et al.Screening of heparin API by near infrared reflectance and Raman spectroscopy[J].Journal of Pharmaceutical Sciences,2009,98(10):3540-3547.
[29] Gemene Kebede L, Meyerhoff Mark E. Reversible detection of heparin and other polyanions by pulsed chronopotentiometric polymer membrane electrode[J].Analytical Chemistry,2010,82(5):1612-1615.
[30] Wang Lin,Meyerhoff Mark E.Quantitative determination of high charge density polyanion contaminants in biomedical heparin preparations using potentiometric polyanion sensors[J].Electroanalysis,2010,22(1):26-30.
[31] Wang Lin,Buchanan Stacey,Meyerhoff Mark E.Detection of high-charge density polyanion contaminants in biomedical heparin preparations using potentiometric polyanion sensors[J].Analytical Chemistry,2008,80(24):9845-9847.
[32] Lühn Susanne,Schiemann Simone,Alban Susanne.Simple fluorescence assay for quantification of OSCS in heparin[J].Analytical Bioanalytical Chemistry,2011,399(2):670-680.
[33] Alban Susanne,Lühn Susanne,Schiemann Simone.Combination of a two-step fluorescence assay and a two-step anti-Factor Xa assay for detection of heparin falsifications and protein in heparins[J].Analytical Bioanalytical Chemistry,2011,399(2):681-690.

