首发抑郁症患者治疗前后的静息态fMRI研究
孙 军 刘含秋 孙华平 张俊海 冯晓源 郭 琴 施慎逊
通常脑功能成像主要是由2种状态即任务状态与基准状态相减而得到结果,研究大多以闭目或被动观察无任务的状态作为对照进行成像。近年研究发现,在进行任务刺激时,某些脑区活动性减弱,或者说大脑在没有任务的清醒静息状态时也存在功能活动[1-2]。Raichle等[3]首次采用PET测量脑血流量及耗氧量得到所谓静息状态下“默认模式”的脑功能网络。研究发现虽然活动性增强的脑区随不同的任务刺激而改变,但是活动性减弱的脑区却比较接近,把这些不同任务引发的信号减低脑区作为基础状态或默认状态。默认模式神经网络主要包括楔前叶/后部扣带回皮质及前额叶内侧皮质/腹侧前部扣带回皮质等脑区。
fMRI研究静息态下的脑功能状态虽然起步较晚,却已经发展成为功能MRI的一个分支,主要的分析方法有三种:区域性同源(regionalhomogeneity)方法[4]、功能连接性分析[5]和低频波振幅分析(amplitude of low frequency fluctuation,ALFF)[6]。前两种分别着重分析区域之内及区域之间时相相近的区域,研究角度主要针对时间同步方面,虽然在显示较远脑区间功能连接存在异常的结果比较直观,但不能直接判断哪一个脑区是异常的,ALFF则着重测量区域活动性的幅度,可以直接判断活动异常的脑区。
抑郁症(major depressive disorder,MDD)患者经常处于悲伤、内疚、自责、无助状态,这种持久的抑郁状态对脑的功能状态产生影响。本研究前提是抑郁症持久的抑郁状态造成默认模式神经网络的异常,经过有效药物治疗后可能好转。研究通过比较首发MDD患者药物治疗前后的静息态低频波幅 (ALFF)的BOLD信号变化,探讨其作为生物学指标观察药物疗效的价值。
方 法
1.研究对象
2006年11月~2007年3月在华山医院心理咨询门诊就诊的13例抑郁症患者纳入研究组,入组标准:①符合美国精神疾病诊断与统计手册第四版(DSM-Ⅳ)抑郁症的诊断标准;②年龄20~59岁;③17项汉密尔顿抑郁量表(Hamilton rating scale fordepression,HAMD17)评分≥17分;④首次抑郁发作。均为右利手,排除既往有精神疾病或现患除抑郁症外的其他精神疾病,排除其他脑部器质性病变或全身系统性疾病所致抑郁。给予选择性5-羟色胺再摄取抑制剂类药物(百忧解、来士普、左洛复)治疗后 8周,进行同样检查及评分。
选取从未患过抑郁症的14例健康者作为对照组,年龄、性别及教育程度与研究组匹配。均为右利手,排除有精神疾病史或一级亲属中有严重精神疾病史;排除神经系统和其他全身器质性疾病。
所有受试者体内均无金属植入物或没有M R检查禁忌证,自愿参加并签署知情同意书。本研究已获得华山医院伦理委员会批准。
2.MRI检查
所有扫描均使用GE Signa 3.0T磁共振成像系统,鸟笼状头部8通道线圈。被试头部用套垫固定,保持整个扫描期间不动。扫描之前,告知受试者保持清醒、闭目、全身放松状态,尽量不作任何思考。扫描时可以用话筒与受试者交流并尽量减少机器噪音的影响。在每次扫描开始之前测量受试者呼吸及脉搏是否平稳,结束之后询问受试者做的如何,是否能够跟上扫描的指令,保证采集数据的有效性。
常规三平面定位后,行矢状位T1WI-FLAIR扫描,以前后联合的连线作为扫描基线,行斜轴位的T1WI(TR/T E=400ms/12ms)扫描。扫描范围从颅顶至枕骨大孔,层厚5mm,无间隔的连续扫描,获取24层高分辨率解剖图像,作为功能扫描的参照图。功能成像程序,采用单次激发平面回波成像的梯度回波序列GRE-EPI序列,复制T1WI图像设置,层厚5mm,间隔 0,TR=2000ms,TE=35ms,分辨率64×64,FOV=240mm,进行BOLD fMRI扫描,扫描时间312s,前12s不做数据采集。
3.图像的分析和处理
将个体原始图像导入个人电脑工作站,采用MRI-cro软件(Chris Rorden,http://www.psychology.nottingham.ac.uk/staff/cr1/mricro.html),将原始DICOM图像转化成可分析的文件格式,然后使用SPM2(SPM,Wellcome DepartmentofCognitive Neurology, London,UK)软件及ALFF专用分析软件(State Key Laboratory of Cognitive Neuroscience and Learning,Beijing Normal University,Beijing,P.R.China)进行分析,在MatLab(Mathworks,Inc.,Sherborn,Mass)上执行操作。
首先原始数据经过SPM 2软件预处理:步骤包括功能图像的头动矫正、空间标准化、体素大小重新采样与空间平滑步骤(FWHM=10mm)。预处理后,采用ALFF分析软件使每个体素经过带宽0.01~0.08低频滤波去除更低频率的漂移及高频噪声,如呼吸及心跳。滤过后的数据经过傅立叶转换后得到个人的ALFF图像。然后采用SPM 进行组内、组间图像分析,分三组:正常对照组、抑郁症疗前组、抑郁症疗后组。为显示扫描图像中ALFF超过全脑平均水平脑区部位,组内分析采用单样本单向t检验,域值为1[7](全脑的ALFF平均水平)。正常组与患者组间比较采用两样本t检验,治疗前后组间比较采用配对 t检验,P<0.05,uncorrected,k≥20voxels认为有统计学意义。
结 果
首发MDD患者治疗前与正常对照组相比抑郁状态评分存在明显差异,经8周治疗后症状较治疗前明显好转,表明抗抑郁疗效显著(表1)。
个人及组内图像分析结果显示在静息状态下,个人的自发低频波信号分布在大脑灰质区,主要包括楔前叶/后部扣带回皮质及前额叶内侧皮质/腹侧前部扣带回皮质,少量分布在额顶叶背外侧区。
正常对照组与MDD患者的比较结果显示正常人的静息态神经网络基于ALFF的BOLD信号较抑郁症患者明显增高,主要位于扣带回膝部、前额叶背内侧及右外侧额叶,楔前叶/扣带回后方、右侧岛叶及小脑;未见MDD比正常对照组信号增高脑区。抑郁症患者治疗前后组比较表明治疗前左侧前额叶腹内侧及腹外侧皮质BOLD信号较治疗后增高,而治疗后右侧前额叶腹内侧皮质、双侧前额叶背外侧皮质、右侧眶额叶,右侧颞极,双侧扣带回后部等广泛区域BOLD信号较治疗前增高(P<0.05,uncorrected,图 1,表2)。
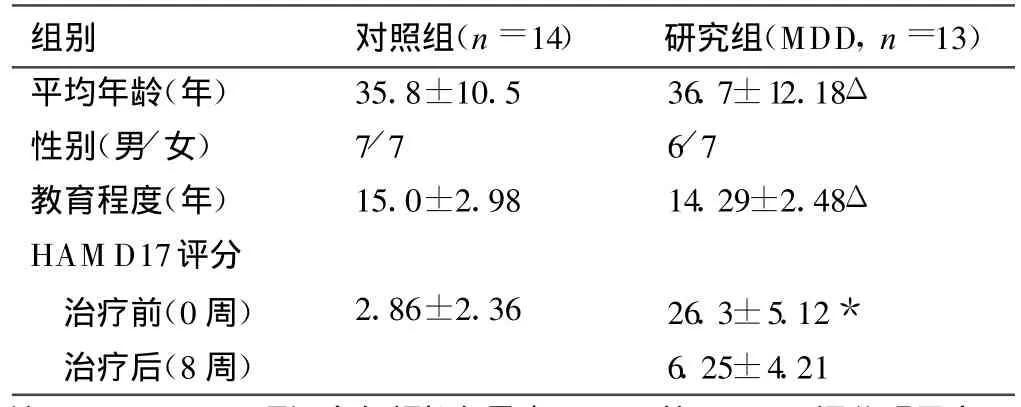
表1 研究组和对照组一般临床资料
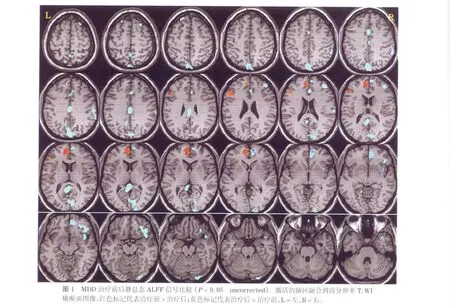
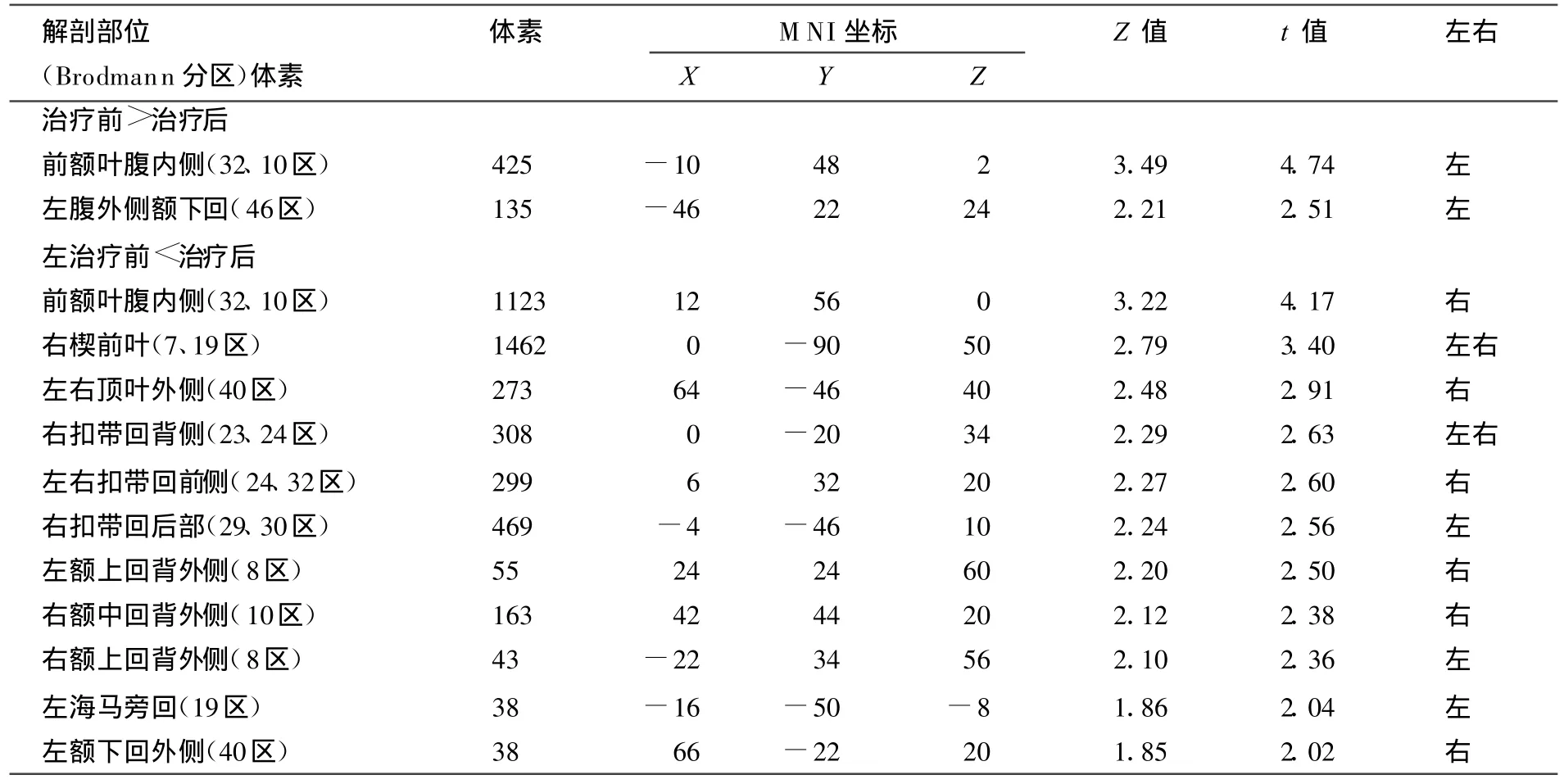
表2 MDD治疗前后ALFF信号比较的脑功能区分布(P<0.05,uncorrected)
讨 论
采用fMRI研究静息状态下抑郁症的改变报道较少,而且多采用功能连接分析方法[5],结果表明抑郁症患者的前扣带回与丘脑之间的连接较正常对照组增强。本研究采用基于ALFF分析方法研究MDD静息态脑功能未见报道。
本研究个人及组内图像分析结果显示在静息状态下,个人的自发低频波信号分布在大脑灰质区,主要包括楔前叶/后部扣带回皮质及前额叶内侧皮质/腹侧前部扣带回皮质,少量分布在额顶叶背外侧区,与许多研究结果一致,符合大脑默认模式[3]。大脑默认模式神经网络是由内而发的思考过程所调节,在刺激态fMRI时常常因为需要被试者注意那些外在刺激进行的认知需要而被抑制[8]。无论PET还是fMRI对静息态脑功能的研究,都得到比较接近的默认模式的神经网络。
基于ALFF的静息态BOLD信号机制尚未完全清楚,一些研究表明可能与自发性神经活动有关[9]。静息状态几乎没有外界刺激存在,因此这种波被认为是自由的、非受控制的。Biswal等[10]发现脑灰质的低频波幅度高于白质,Kiviniemi等[11]报道视觉皮质激活的低频波幅在0.034Hz左右,同步测量静息闭眼状态下的脑电图和BOLD信号表明,α波与视皮质自发BOLD信号呈负相关,因此,ALFF至少部分反映了神经自发性活动[12]。
许多研究显示抑郁症患者右侧额叶电活动相对增高,左侧额叶相对减低,而抑郁症的特点是右侧额叶调节功能紊乱、功能减低或不足。这种矛盾可以用半脑功能侧化的理论来解释:目前认为左侧大脑半球用来组织明确简单的内容,这个过程需要脑区的额外活动来限制目标及事件的自然联系。右侧大脑半球则用来组织模糊复杂的内容,需要有同时捕捉复杂信息的各个因素之间众多自然联系的能力。这种能力是保持心理健康、情绪平衡及身体健康的最重要特征。只要这种能力存在,便可以保护人们免受精神疾病包括抑郁症。健康有创造力的个体在这个过程中不需要额外的皮质生理学激活;而对于抑郁症患者,由于右侧脑半球功能不足,使得抑郁症患者发现自己处于非常复杂的、充满矛盾的现实世界,而右侧大脑随之必须在缺少有效机制的情况下处理这种现实。同时,功能不足的右侧大脑半球仍然更加敏感地接受复杂和充满矛盾的现实世界,结果导致右侧半球的超负荷运转、生理学活动增强,造成抑郁症患者缺少活力、闷闷不乐、郁闷等为主的症状。
生理活性的增加与血流的关系如何,并没有得到明确的结论。PET对静息态血流分析结果差异较大,Drevets[13]应用PET检测静息状态下抑郁症患者(发作期)和抑郁症家族成员以及正常对照组脑血流量和葡萄糖代谢的情况,结果发现抑郁症患者从左腹外侧前额叶皮质到内侧前额皮质表面的区域和杏仁核的脑血流量增加。而且在研究中发现只有抑郁发作期的患者有左侧前额叶皮质血流和葡萄糖代谢的增加,而处于抑郁缓解期的抑郁症家族成员则没有这种改变,从而认为左侧前额皮质血流增加是抑郁症的一种状态标志;而Mayberg等[14]研究则表明MDD静息态前额叶皮质活动性较正常对照组减低。对于治疗前后比较,研究大多显示,抑郁症的严重程度与该区的代谢呈正相关,而且随着治疗有效反应代谢的异常增高可以减少到正常范围。
静息态fMRI是让受试者处于清醒、放松、尽量不做任何思考的状态进行扫描,最大限度消除了外界影响,结果相对稳定、一致。本研究结果表明在静息状态下,基于ALFF的BOLD信号MDD患者较正常人明显减低。经过8周的有效抗抑郁治疗后,治疗前相对减低右侧前额叶腹内侧皮质、双侧前额叶背外侧皮质、右侧眶额叶,右侧颞极,双侧扣带回后部等脑区有所恢复。BOLD信号可以部分反映血流情况,因此本研究显示抑郁症患者右侧前额叶腹内侧皮质、双侧前额叶背外侧皮质、右侧眶额叶、右侧颞极、双侧扣带回后部等脑区静息态脑血流减低可能是MDD的一个特征性改变,笔者同时进行的DTI研究结果显示的FA值减低区主要位于右侧脑白质区,两者具有一致性。由于DTI与静息态fMRI均为相对客观的指标,因此可以推断,抑郁症患者右侧大脑半球的功能紊乱伴随广泛区域的脑白质纤维的一致性减低及脑血流的减低。
总之,本研究表明治疗有效的首发抑郁症患者静息态脑功能区的异常变化是可逆的;基于ALFF的静息态fMRI可以作为观察抗抑郁药物疗效的一个相对客观的生物学指标,为临床更客观地动态评价抗抑郁药物疗效开辟一条新的思路。
1.Mazoyer B,ZagoL,Mellet E,et al.Cortical networks for working memory and executive functions sustain the conscious resting state in man.Brain Res Bull,2001,54:287-298
2.Gusnard DA,Raichle ME.Searching for a baseline:functional imaging and the resting humanbrain.Nat Rev Neurosci,2001,2:685-694
3.Raichle ME,MacLeod AM,Snyder AZ,et al.A default mode of brain function.Proc Natl AcadSci USA,2001,98:676-682
4.ZangY,JiangT,Lu Y,et al.Regional homogeneityapproach to fMRI data analysis.Neuroimage,2004,22:394-400
5.AnandA,Li Y,Wang Y,et al.Activity and connectivity of brain mood regulating circuit in depression:a functional magnetic resonance study.Biol Psychiatry,2005,57:1079-1088
6.Lowe MJ,Dzemidzic M,Lurito JT,et al.Correlations in lowfrequencyBOLD fluctuations reflect cortico-cortical connections.Neuroimage,2000,12:582-587
7.Yang H,Long XY,Yang Y,et al.Amplitude of low frequency fluctuation within visual areas revealed byresting-state functional MRI.Neuroimage,2007,36:144-152
8.Gusnard DA,Raichle ME.Searching for a baseline:functional imaging and the resting human brain.Nat Rev Neurosci,20012:685-694
9.McCormick DA.Spontaneous activity:signal or noise.Science,1999,285:541-543
10.Biswal BB,Yetkin FZ,Haughton VM,et al.Functional connectivityin the motor cortex of restinghuman brain usingechoplanar MRI.Magn Reson Med,1995,34:537-541
11.Kiviniemi V,Jauhiainen J,Tervonen O,et al.Slow vasomotor fluctuation in fMRI of anesthetized child brain.Magn Reson Med,2000,44:373-378
12.Logothetis NK,Pauls J,Augath M,et al.Neurophysiological investigation of the basis of the fMRI signal.Nature,2001,412:150-157
13.Drevets WC.Prefrontal cortical-amygdalar metabolism inmajor depression.Ann N Y Acad Sci,1999,877:614-637
14.MaybergHS,Brannan SK,Tekell JL,et al.Regional metabolic effects of fluoxetine in major depression:Serial changes and relationship to clinical response.Biol Psychiatry,2000,48:830-843

