群体感应抑制剂溴化呋喃酮对牙龈卟啉单胞菌生物膜形成影响的研究
张利平 王爽 周向葛 徐屹,3
(1.口腔疾病研究国家重点实验室,四川大学,成都 610041;2.四川大学 化学学院,成都 610064;3.四川大学华西口腔医院 牙周科,成都 610041)
牙菌斑生物膜是牙周病的始动因子,其主要由细胞外基质和嵌入其中的细菌组成,是细菌赖以生存和进行信号交流的场所。群体感应(quorum sensing,QS)是细菌间进行信号传递的一种机制。细菌可产生自体诱导分子(autoinducer,AI),通过感知其浓度来调控周围环境中细菌数量的变化。随细菌密度的增加,AI的浓度不断增加,达到一定阈值时,可以启动细菌相关基因的表达,调控细菌生物发光、毒力因子、生物膜形成等行为[1-2]。AI-1能调控菌种内群体感应现象[3];AI-2即呋喃酰硼酸二酯,为菌种间信号分子,它可感知菌种间细菌数量,从而调控自身行为[4-5]。牙龈卟啉单胞菌在牙周炎中的检出率最高,是龈下菌斑中生物膜的主要组成部分,被认为是牙周炎的主要可疑致病菌。Frias等[6]研究发现牙周致病菌牙龈卟啉单胞菌、具核梭杆菌、中间普雷沃菌等均产生AI-2。
干扰细菌QS通路可以控制细菌相关生物学行为。群体感应抑制剂(quorum sensing inhibitor,QSI)的研究有助于控制细菌感染。溴化呋喃酮是一种QS通路抑制剂,它可以与细菌分泌的自诱导物竞争性结合自诱导物受体,通过作用于细菌的群体感应系统影响细菌生物膜的形成[7-8]。其对自诱导物AI-1、AI-2均有抑制作用[9-10]。Wu等[9]证实溴化呋喃酮能够通过抑制自诱导物AI-1来抑制绿脓杆菌的群体感应系统,加速清除小鼠肺部感染的绿脓杆菌,缓解病情。Defoirdt等[10]证实溴化呋喃酮还可干扰AI-2介导的群体感应系统。本研究旨在通过光密度值测定和扫描电镜观察,探讨溴化呋喃酮[5Z-4-溴-5溴亚甲基-2(5H)呋喃酮]在体外对牙周致病菌牙龈卟啉单胞菌生物膜形成和结构的影响。
1 材料和方法
1.1 实验菌株和培养基
牙龈卟啉单胞菌ATCC33277由四川大学口腔疾病研究国家重点实验室提供。液体培养基牛心脑浸液(brain heart infusion,BHI)培养基、固体培养基牛心脑浸汁琼脂培养基(Oxiod公司,英国)。
1.2 主要试剂和仪器
溴化呋喃酮由四川大学化学学院合成、鉴定并提供。该化合物溶解于无水乙醇,-20℃保存。
超净工作台(苏州净化设备有限公司),厌氧培养箱(浙江义乌冷冻机总厂),麦氏细菌比浊仪(PhoenixSpec Nephelometer,BD公司,美国),扫描电镜(scanning eletron microscope,SEM)(Inspect F,FEI公司,荷兰),全波长扫描式多功能读数仪(Thermo Varioskan Flash,Thermo公司,美国),微量移液器(Gilson公司,法国)等。
1.3 菌悬液的制备
将牙龈卟啉单胞菌ATCC33277从-80℃冰箱中取出,常规复苏,接种于BHI琼脂培养基,37℃厌氧培养(80%N2、10%H2、10%CO2)48 h,挑取单菌落转种于BHI液体培养基,37℃厌氧培养48 h。涂片检查为纯培养后,采用麦氏比浊仪将菌悬液浓度调至1.8×108CFU·mL-1,备用。
1.4 溴化呋喃酮对牙龈卟啉单胞菌最低抑菌浓度(minimal inhibitory concentration,MIC)的测定
采用二倍稀释法,将连续倍比稀释的溴化呋喃酮(每孔10μL)加入含牙龈卟啉单胞菌ATCC33277的BHI液体培养基(每孔190μL)的聚乙烯96孔板。空白对照组为含牙龈卟啉单胞菌ATCC33277的BHI液体培养基(每孔200μL),阴性对照组为无水乙醇(每孔10μL)加入含牙龈卟啉单胞菌ATCC33277的BHI液体培养基(每孔190μL)的聚乙烯96孔板。37℃厌氧培养48 h,肉眼观察。同一浓度水平重复6次。
1.5 不同浓度的溴化呋喃酮对牙龈卟啉单胞菌生物膜形成量的影响
1.5.1 实验分组和光密度值的测定 空白对照组为牙龈卟啉单胞菌ATCC33277菌悬液(每孔200μL)。阴性对照组为无水乙醇(每孔10μL)加入含牙龈卟啉单胞菌ATCC33277菌悬液(每孔190μL)的聚乙烯96孔板。实验组为将1/4MIC、1/2MIC、MIC、2MIC溴化呋喃酮(每孔10μL)加入含牙龈卟啉单胞菌ATCC33277菌悬液(每孔190μL)的聚乙烯96孔板。一式3份,同一浓度水平重复4次。37℃厌氧培养48 h。微量移液器吸出孔内菌悬液,PBS液轻轻洗孔3次以去除浮游细菌,加入新鲜BHI液体培养基(每孔200μL),充分混匀,使用全波长扫描式多功能读数仪,测量波长为600 nm下的光密度值,以反映生物膜的形成量。
1.5.2 扫描电镜观察不同浓度的溴化呋喃酮对牙龈卟啉单胞菌生物膜结构的影响 采用聚乙烯12孔板,每孔内放置一个无菌圆形玻片。空白对照组为牙龈卟啉单胞菌ATCC33277菌悬液(每孔1 000μL)。阴性对照组为无水乙醇(每孔50μL)加入含牙龈卟啉单胞菌ATCC33277菌悬液(每孔950μL)的聚乙烯12孔板。实验组为将1/4MIC、1/2MIC、MIC、2MIC溴化呋喃酮(每孔50μL)加入含牙龈卟啉单胞菌ATCC33277菌悬液(每孔950μL)的聚乙烯12孔板。一式3份,37℃厌氧培养48 h。微量移液器吸出孔内菌悬液,PBS液轻轻洗孔3次以去除浮游细菌,用2.5%戊二醛24 h浸泡样本固定,依次用30%、50%、70%、80%、90%、100%乙醇浓度梯度浸泡脱水,每次15min,脱水后放入醋酸异戊酯液浸泡15min置换,二氧化碳(CO2)临界干燥,离子溅射表面固定镀膜至材料表面成金黄色,SEM观察分析。
1.6 统计学分析
采用SPSS17.0统计学软件对实验数据进行分析。本实验所得数据用±s表示。多组间采用单因素方差分析,检验水准为α=0.05;两两比较采用Bofferoni法进行分析,其检验水准为α’=0.003。
2 结果
2.1 溴化呋喃酮对牙龈卟啉单胞菌最低抑菌浓度的测量结果
溴化呋喃酮对牙龈卟啉单胞菌MIC为9.00mg·L-1。
2.2 溴化呋喃酮对牙龈卟啉单胞菌生物膜形成的影响
各组A600nm值的测量结果见表1。实验组与空白对照组相比,实验组A600nm值较空白对照组小;实验各组随着溴化呋喃酮浓度的增加,A600nm值呈现减小趋势,即牙龈卟啉单胞菌生物膜形成的量随之减少,说明溴化呋喃酮抑制牙龈卟啉单胞菌生物膜的形成。
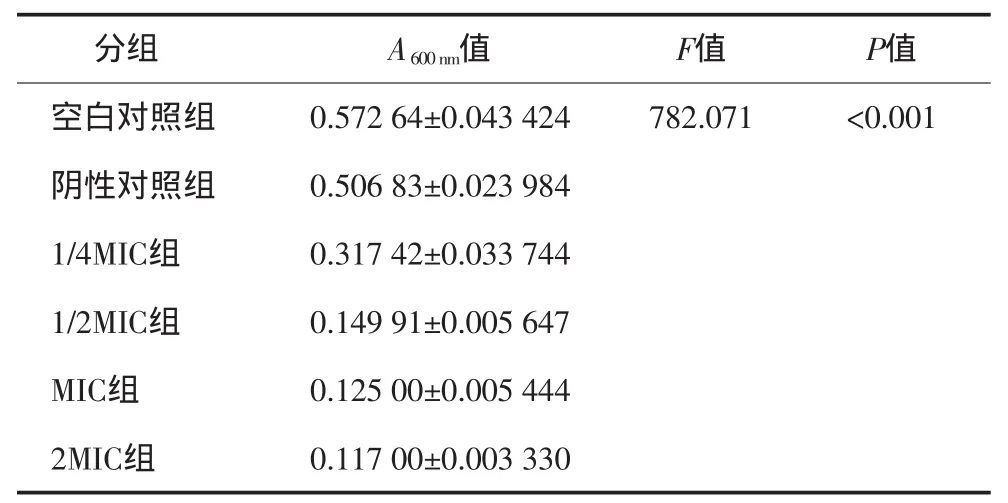
表1 不同浓度溴化呋喃酮对牙龈卟啉单胞菌生物膜形成的影响Tab 1 Influence of the amount of Porphyromonas gingivalis biofilm upon different concentrations of brom inated furanone
单因素方差分析结果显示:6组间A600nm值差异有统计学意义。利用Bofferoni法进行两两比较,结果显示:空白对照组、阴性对照组、1/4MIC组与其之外的5组进行两两比较,差异有统计学意义(P<0.001)。1/4MIC组A600nm值较空白对照组和阴性对照组小,即牙龈卟啉单胞菌生物膜量减少,说明1/4MIC(2.25mg·L-1)溴化呋喃酮可以抑制牙龈卟啉单胞菌生物膜形成。而1/2MIC、MIC、2MIC组分别与空白对照组、阴性对照组、1/4MIC组进行两两比较,差异有统计学意义(P<0.001)。说明1/2MIC(4.50mg·L-1)、MIC(9.00mg·L-1)、2MIC(18.00mg·L-1)均可抑制牙龈卟啉单胞菌生物膜的形成。1/2MIC、MIC、2MIC组间进行两两比较,差异无统计学意义,说明1/2MIC(4.50mg·L-1)、MIC(9.00mg·L-1)、2MIC(18.00mg·L-1)溴化呋喃酮对牙龈卟啉单胞菌生物膜的抑制作用差异无统计学意义。
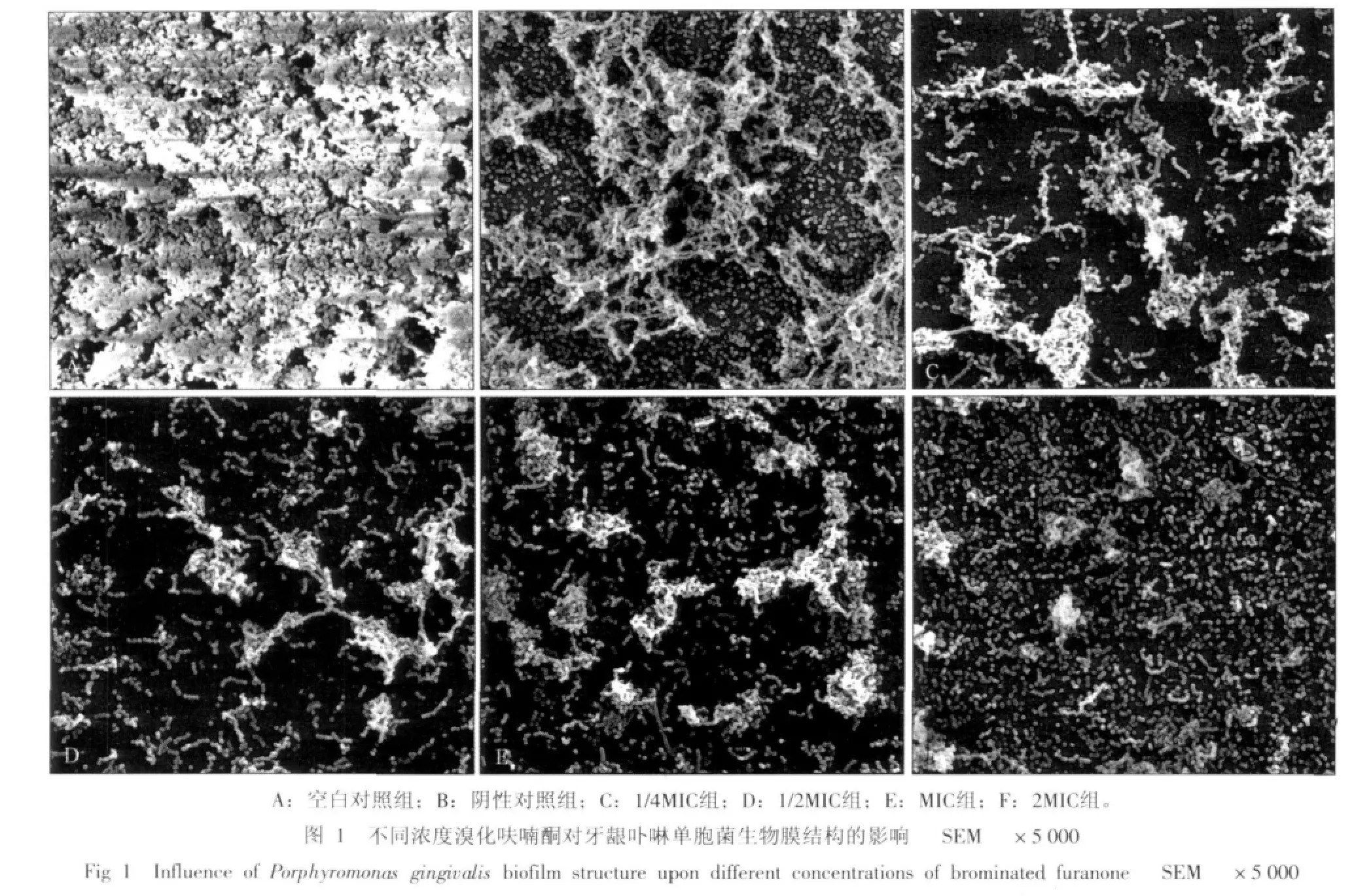
2.3 扫描电镜观察牙龈卟啉单胞菌生物膜的结构
扫描电镜下牙龈卟啉单胞菌生物膜的观察结果见图1。厌氧培养48 h,空白对照组牙龈卟啉单胞菌形成完整、致密的生物膜结构;阴性对照组较空白对照组的生物膜疏松;实验组随着溴化呋喃酮浓度的增加(1/4MIC组、1/2MIC组、MIC组),形成的生物膜结构愈加疏松;2MIC组仅见散在的牙龈卟啉单胞菌菌体,未见生物膜结构形成。
3 讨论
溴化呋喃酮是目前研究较多的一类群体感应抑制剂[7-10],本研究测定了溴化呋喃酮对牙龈卟啉单胞菌的MIC,以便采用低于MIC的适宜溴化呋喃酮药物浓度研究该化合物对牙龈卟啉单胞菌生物膜形成的影响,期望在不干扰牙龈卟啉单胞菌生长的前提下,通过对生物膜群体感应系统途径改变细菌生物膜的结构,为寻找新型抗菌药提供实验依据。
本研究溴化呋喃酮对牙龈卟啉单胞菌生物膜形成影响的研究结果显示:与空白对照组相比,1/4MIC、1/2MIC、MIC、2MIC溴化呋喃酮对牙龈卟啉单胞菌生物膜形成均有抑制作用。说明当溴化呋喃酮浓度达到1/4MIC(2.25mg·L-1)时即可对牙龈卟啉单胞菌生物膜形成显现出抑制作用。1/4MIC与1/2MIC比较,1/2MIC的抑制作用大于1/4MIC,差异有统计学意义,说明1/2MIC抑制生物膜形成的作用更明显。1/2MIC、MIC、2MIC组两两比较,差异无统计学意义,说明1/2MIC(4.50mg·L-1)溴化呋喃酮即可获得良好的抑制生物膜形成的效果。总之,牙龈卟啉单胞菌生物膜形成的影响因素包括溴化呋喃酮及其溶剂,其中溴化呋喃酮起主要作用。随着溴化呋喃酮药物浓度升高,抑制作用越明显。当溴化呋喃酮药物达到一定浓度(4.50mg·L-1)时,继续加大溴化呋喃酮药物浓度,抑制作用无明显变化。该结果与Janssens等[11]的研究结果一致。本研究中溴化呋喃酮对牙龈卟啉单胞菌的MIC为9.00mg·L-1,明显低于127mg·L-1,这可能与实验菌种不同有关。Hentzer等[12]研究显示:溴化呋喃酮(5mg·L-1)处理的绿脓杆菌组与溴化呋喃酮未处理的绿脓杆菌组比较,生物膜厚度明显变薄。Vestby等[13]研究表明:溴化呋喃酮可明显降低多种肠道沙门氏菌生物膜的形成。以上研究均与本研究中溴化呋喃酮抑制牙龈卟啉单胞菌生物膜形成的研究结果基本一致。
本研究中扫描电镜观察显示:溴化呋喃酮不仅抑制牙龈卟啉单胞菌生物膜量的生成,而且使牙龈卟啉单胞菌形成的生物膜结构疏松。随着溴化呋喃酮浓度增加,牙龈卟啉单胞菌生物膜的疏松程度增加。这与叶联华等[14]的研究结果基本一致。
总之,溴化呋喃酮作为群体感应系统抑制剂,抑制了牙龈卟啉单胞菌生物膜的形成,并使生物膜结构稀疏。但溴化呋喃酮通过改变群体感应系统来抑制生物膜形成的具体机制有待进一步研究。溴化呋喃酮通过信号调节抑制细菌生物膜形成,但是不影响细菌的存活,不会导致抗生素使用时耐药菌株产生,所以可能成为一种较理想的抗菌药物,目前已经有学者将其作为药物开发的新靶点[8,15]。
[1]Fuqua WC,Winans SC,Greenberg EP.Quorum sensing in bacteria:The LuxR-LuxI family of cell density-responsive transcriptional regulators[J].J Bacteriol,1994,176(2):269-275.
[2]Waters CM,Bassler BL.Quorum sensing:Cell-to-cell communication in bacteria[J].Annu Rev Cell Dev Biol,2005,21:319-346.
[3]Kleerebezem M,Quadri LE,Kuipers OP,et al.Quorum sensing by peptide pheromones and two-component signal-transduction systems in Gram-positive bacteria[J].Mol Microbiol,1997,24(5):895-904.
[4]McNab R,Lamont RJ.Microbial dinner-party conversations:The role of LuxS in interspecies communication[J].J Med Microbiol,2003,52(Pt 7):541-545.
[5]Lyon GJ,Muir TW.Chemical signaling among bacteria and its inhibition[J].Chem Biol,2003,10(11):1007-1021.
[6]Frias J,Olle E,Alsina M.Periodontal pathogens produce quorum sensing signalmolecules[J].Infect Immun,2001,69(5):3431-3434.
[7]Martinelli D,Grossmann G,Séquin U,et al.Effects of natural and chemically synthesized furanones on quorum sensing in Chromobacterium violaceum[J].BMC Microbiol,2004,4(25):25-35.
[8]Hentzer M,Wu H,Andersen JB,et al.Attenuation of Pseudomonas aeruginosa virulence by quorum sensing inhibitors[J].EMBO J,2003,22(15):3803-3815.
[9]Wu H,Song Z,Hentzer M,et al.Synthetic furanones inhibit quorum-sensing and enhance bacterial clearance in Pseudomonas aeruginosa lung infection in mice[J].J Antimicrob Chemother,2004,53(6):1054-1061.
[10]Defoirdt T,Crab R,Wood TK,et al.Quorum sensing-disrupting brominated furanones protect the gnotobiotic brine shrimp Artemia franciscana from pathogenic Vibrio harveyi,Vibrio campbellii,and Vibrio parahaemolyticus isolates[J].Appl Environ Microbiol,2006,72(9):6419-6423.
[11]Janssens JC,Steenackers H,Robijns S,et al.Brominated furanones inhibit biofilm formation by Salmonella enterica serovar typhimurium[J].Appl Environ Microbiol,2008,74(21):6639-6648.
[12]Hentzer M,Riedel K,Rasmussen TB,et al.Inhibition of quorum sensing in Pseudomonas aeruginosa biofilm bacteria by a halogenated furanone compound[J].Microbiology,2002,148(Pt 1):87-102.
[13]Vestby LK,Lönn-Stensrud J,MøretrøT,et al.A synthetic furanone potentiates the effect of disinfectants on Salmonella in biofilm[J].J Appl Microbiol,2010,108(3):771-778.
[14]叶联华,许赓,黄云超,等.溴代呋喃酮对聚氯乙烯材料表面大肠杆菌生物膜形成的影响[J].中国修复重建外科杂志,2010,24(7):871-874.Ye Lianhua,Xu Geng,Huang Yunchao,et al.Effect of brominated furanones on biofilm formation of Escherichia coli on polyvinyl chloride material[J].Chin J Reparative Reconstructive Surgery,2010,24(7):871-874.
[15]Möker N,Dean CR,Tao J.Pseudomonas aeruginosa increases formation ofmultidrug-tolerant persister cells in response to quorumsensing signaling molecules[J].J Bacteriol,2010,192(7):1946-1955.

