拟南芥茎表皮蜡缺失突变体cera蜡成分分析
连金番,常 青,孙建丽,石 磊,王 倩
(西北农林科技大学生命学院,陕西 杨凌 712100)
角质层是覆盖陆生植物表层组织的一层由角质和表皮蜡组成的脂质保护层。角质层的重要组成成分角质是由氧化的C16和C18脂肪酸构成网状的油脂聚酯[1]。嵌入和覆盖网状角质层的表皮蜡是一类超长链脂肪族疏水化合物[2],嵌入角质层的非晶体状的表皮蜡称作内表皮蜡,而覆盖在角质层表面并形成晶体的表皮蜡称为外表皮蜡[3]。
表皮蜡在植物生长发育过程中发挥重要作用,如防止由非气孔蒸发造成的水分散失,抗寒[4],抵抗紫外线辐射[5],去除植物表皮表面外部水分,以降低溶于外部水分中的灰尘、花粉粒和其他有害物质对植物表皮造成的伤害[6-7]。在抵御细菌、真菌病原体和昆虫的入侵及植物-昆虫相互作用方面表皮蜡也发挥重要作用[8-9]。另外表皮蜡还能提供一种花粉粒-柱头相互作用信号使植物在适宜时期进行授粉[10]。
气相色谱-质谱分析结果显示,植物表皮蜡有100多种成分,主要包括长链和超长链脂肪族化合物、环状化合物以及甾醇类化合物,这些化合物均由20~34个碳原子超长链脂肪酸衍生而来[3]。某些植物表皮蜡质组成成分还包括酚、固醇、环萜以及胡萝卜素类化合物[3,11]。表皮蜡的化学组成成分和数量在同一株植物上的不同部位及不同的生长发育阶段也存在差异[12]。模式植物拟南芥的表皮蜡的化学组成成分主要是超长链脂肪酸及其衍生物,如醇、酯、烷烃、醛、酮等[3,11]。
植物超长链脂肪酸的合成是将质体中合成的C16/C18的长链脂肪酸在内质网中进一步延伸。该延长过程由位于内质网的脂肪酸延长酶复合体催化,此复合体由四个酶组成,依次催化四步反应:①脂酰-CoA和丙二酰-CoA由3-酮脂酰-CoA缩合酶催化聚合反应生成3-酮脂酰-CoA;②3-酮脂酰-CoA被3-酮脂酰-CoA还原酶还原生成3-羟脂酰-CoA;③3-羟脂酰-CoA由3-羟脂酰-CoA脱水酶催化脱水生成烯脂酰-CoA;④烯脂酰-CoA经烯脂酰-CoA还原酶还原成比第一步脂酰-CoA多两个碳原子的脂酰-CoA[13]。
生成的超长链脂肪酸经过一系列特异生物途径衍生为蜡的不同组分。已有文献报道,拟南芥中表皮蜡中脂肪族成分合成有两条途径:脱羧途径和酰基还原途径[14]。脱羧途径从脂酰-CoA还原酶催化超长链脂肪酸前体生成醛开始,经由醛脱羧酶催化生成奇数碳原子的烷烃[15],烷烃再经过一系列的氧化生成次级醇和酮;酰基还原途径始由对超长链脂肪酸的还原生成初级醇[16],部分初级醇进一步和游离脂肪酸酯化生成蜡脂[17]。
角质蜡能影响植株茎表皮色泽,所以一旦蜡合成有关的基因发生突变导致蜡含量减少,肉眼即可识别到植株茎表皮色泽变化。在大麦和拟南芥中蜡缺失突变体称为eceriferum(cer),而在玉米和甘蓝型油菜被称为gl。目前与拟南芥蜡合成有关的多个基因已被报 道 , 如 CER1、 CER2、 CER3、 CER4、 CER5、CER6和CER10等,已从拟南芥基因组中克隆到cer1、cer2和cer3突变体蜡缺失表型显著,但克隆的基因在蜡合成及运输中的具体作用尚不清楚[18-21]。CER4编码的酶催化酰基还原途经的初级醇生成[22]。CER5编码ABC转运蛋白负责表皮蜡的运输[23]。CER6和CER10分别编码植物超长链脂肪酸合成酶复合体的3-酮脂酰-CoA缩合酶和烯脂酰-CoA还原酶[24-25]。在大麦中分别克隆到与CER1、CER2基因相似性高的GL1和GL2基因。但是,目前对拟南芥蜡合成基因的研究还不十分完善。我们利用EMS化学诱变剂处理野生型拟南芥得到茎表皮蜡缺失突变体cera。该突变体茎色泽浅绿,果荚和植株较野生型短小。本研究对该突变体进行扫描电镜观察植株茎表皮蜡晶体形态,遗传分析,茎表皮角质蜡化学组成成分和含量分析,为以后该基因的克隆及研究其在角质蜡合成过程发挥的角色奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料
野生型拟南芥(Arabidopsis thaliana):生态型Columbia(Col-0);拟南芥突变体cera:由本实验室用EMS诱变得到的茎色突变株系。
1.1.2 数据库
本试验所需数据信息来源于:http://www.ncbi.nlm.nih.gov/,http://www.arabidop sis.org/(TAIR)和http://www.genevestigator.ethz.ch/。
1.2 方法
1.2.1 EMS处理野生型拟南芥
取2 g野生型种子(Col-0)于100 mL无菌水中,4℃过夜。加400 mL无菌水,磁力搅拌器搅拌,100 r·min-1离心1 h。加入EMS使其终浓度为0.3%(V/V),室温,100 r·min-1离心16 h。4 ℃静置3 d,种植材料。
1.2.2 材料种植
拟南芥在0.1%的琼脂糖中4℃春化2~4 d后培养在黑土∶蛭石∶沙子(1∶1∶1)的混合土中。培养时在其上层罩一层塑料膜以保持湿度,当拟南芥萌发出4~5片子叶后去掉塑料膜。16 h光照处理,8 h黑暗[26],湿度保持在60%~70%,温度控制在22~25℃,光照强度2 800 lx。
1.2.3 突变体的背景纯化与遗传分析
以拟南芥野生型Col-0为父本,突变体为母本进行回交得到F1代,F1代自交得到F2代。种植并观察F2代表型,统计F2代中茎浅绿色突变体和正常植株茎色的比例。
1.2.4 电子扫描显微镜观察
取植株顶端2.5 cm茎包于锡箔纸中,-180℃真空放置5 min。样品置于电子扫描显微镜(Hitachi S4700),2.5 kV加速电压,观察植株茎表皮蜡晶体。
1.2.5 茎表皮蜡提取及组分分析
将茎浸泡在含5 μL 1 μg·μL-1C24∶0烷烃的三氯甲烷中30 s,于液氮中干燥浓缩。浓缩后的样品转入到气相色谱分析管中,加10 μL N,O-三氟乙酰胺和10 μL吡啶后,70℃加热1 h,液氮干燥,加100 μL三氯甲烷,进行气相色谱氢焰离子化检测(GC-FID)和气相色谱-质谱(GC-MS)分析。
2 结果与分析
2.1 突变体cera的表型与遗传分析
cera突变体是经化学诱变剂EMS诱导野生型拟南芥(Col-0)筛选得到的茎色变化植株。该突变体茎表现为浅绿色,这种表型与蜡缺失cer系列突变体表型相似,因此命名为cera(见图1)。另外,突变体果荚长度也较野生型短并且低育,我们将突变体和cer6置于潮湿环境中培养,cer6果荚长度恢复到野生型水平,而cera却未恢复,这说明cera低育并不像cer1和cer6一样,它们的低育是由于花粉粒水化导致的[14,18,27]。由花粉粒水化导致的低育植株,在潮湿环境中培养,生育能力可恢复到野生型水平。
为了探讨该突变是否由于单基因隐性突变造成,将筛选到的cera突变体与野生型拟南芥(Col-0)杂交得到F1代,F1所有植株均表现野生型表型。F1自交后得到F2代,种植96株F2,其中73株表现野生型表型,23株表现cera表型,比例为3.17∶1(x2=0.0577,P>0.7),证实该突变为单基因隐性突变。

图1 野生型(Col-0)和突变体ceraFig.1 Wild type and cera
2.2 扫描电子显微镜观察cera突变体茎表皮蜡
为揭示cera突变体茎色泽变化是否与其茎表皮蜡含量变化有关,用扫描电镜观察cera突变体和野生型拟南芥的茎,结果显示野生型茎表面布满晶体状表皮蜡,这些晶体有柱状、锥状、棒状、伞状等,然而cera突变体茎表面却没有观察到晶体状蜡(见图2)。cera突变体茎表皮蜡缺失的表型与cer系列茎表皮蜡缺失表型相似,说明CERA基因可能与拟南芥茎表皮蜡的合成和运输有关。

图2 野生型和突变体cera茎表皮蜡晶体分布Fig.2 Stem surface morphology of wild type(left)and cera(right)by cryo-SEM
2.3 气相色谱氢焰离子化检测和气相色谱-质谱分析cera突变体茎表皮蜡成分及含量
为进一步揭示cera突变体茎表皮蜡的变化,采用气相色谱氢焰离子化检测(GC-FID)和气相色谱-质谱(GC-MS)测量野生型和5株cera突变体(cera1~cera5)茎表皮总蜡的组分和含量(见图3),结果显示野生型拟南芥表皮几乎检测不到C24和C26脂肪酸,C30脂肪酸含量为0.39 μg·cm-2(1 cm2茎表面含有0.39 μg C30脂肪酸);cera突变体C24脂肪酸和C26脂肪酸平均含量分别为0.09和0.06 μg·cm-2,所有cera突变体均检测不到C30脂肪酸。然而在野生型和cera突变体中,都没有检测到C28脂肪酸。表皮蜡中脂肪族成分合成的两种途径中各组分含量的结果显示,酰基还原途径中C24初级醇含量cera突变体比野生型增加约140%,但C26,C28和C30初级醇含量明显减少,分别减少70%,94%和93%;在脱羧途径中,cera突变体除C24和C26醛较野生型略增加外,大于C26的其他组分比野生型均有明显的减少(见图3)。但这些数据并不包含参与合成酯反应的超长链脂肪酸以及初级醇。

图3 野生型和突变体cera茎表皮蜡化学组分与含量分析Fig.3 Stem wax composition of wild type and cera mutant
另外,cera突变体茎表皮中检测到属于固醇类的β-香树脂醇,但野生型没有检测到,该物质是合成固醇类化合物前体,但其与蜡合成的相关关系还没有报道。值得一提的是,在5株cera突变体超长链脂肪酸中,部分脱羧途径代谢中间产物含量却不一致,因此把这5株cera突变体分成A组(cera1,cera2和cera4)和B组(cera3和cera5),测量结果显示B组含有比A组较多的C29的烷烃(<94%),次级醇(<81%)和酮(<95%)。很难解释造成这种差异的原因是因为遗传因素造成的这种差异还是由于其他因素,例如收集样品并不是从同一植株采集的样品,这些不同植株可能存在生长状况的差异。为此,我们重复将cera突变体与野生型回交得到F1,F1自交得到F2,测量F2茎表皮蜡脂肪族组成成分,结果与A组相似。
从拟南芥表皮蜡脂肪族组成成分碳链长度来分析,并将酯含有的超长链脂肪酸及醇计算在内(见图4)。由图4可以看出,cera突变体中C24含量是野生型的222%,而C26和C28却分别为33%和26%,由此得出CERA基因作用于延伸C24以上的超长链脂肪酸。

图4 野生型和突变体cera茎表皮超长链脂肪族C24、C26和C28组分含量分析Fig.4 Sum amount of C24,C26and C28in wild type and cera stem wax components
3 讨论
拟南芥中表皮蜡中脂肪族成分合成有两条途径:酰基还原途径和脱羧途径,作为蜡合成底物的超长链脂肪酸及其衍生物并不是均匀的分配到这两个途径中。Millar和Kunst等认为,在蜡合成过程中,大部分C28和少部分C26、C30超长链脂肪及其衍生物经由酰基还原途径合成蜡;而大部分C30和小部分C28,C32超长链脂肪及其衍生物经由脱羧途径合成蜡[13]。然而我们的测量结果却发现野生型拟南芥初级醇含量C28(1.76)>>C26(0.97)>C30(0.66),醛含量C30(0.57)>>C28(0.15)>C26=C24=0,由此我们认为大部分C28、C26、C24和小部分C30超长链脂肪酸及其衍生物通过酰基还原途径参与蜡合成,而大部分C30和少部分C24、C26、C28超长链脂肪酸及其衍生物通过脱羧途径参与蜡合成(见图5)。
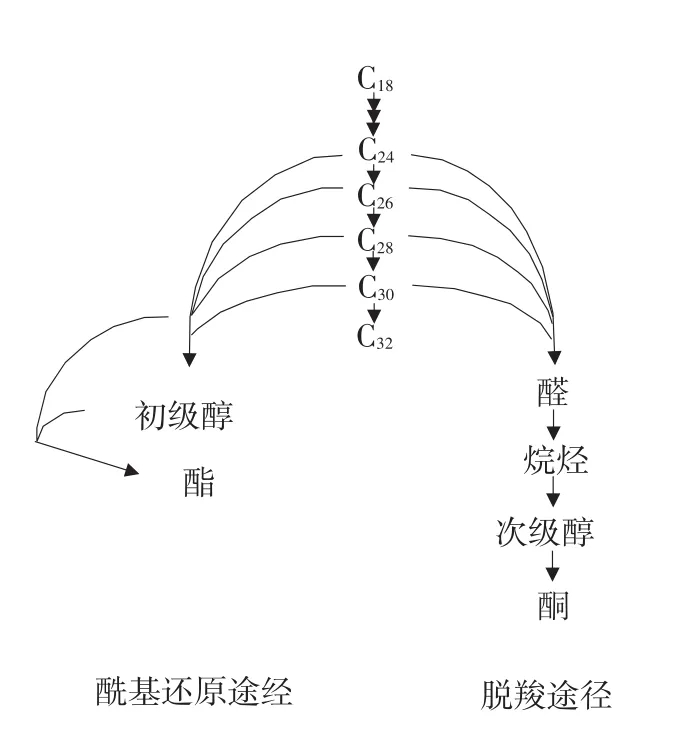
图5 拟南芥茎表皮蜡合成途径Fig.5 Proposed metabolic pathways for wax biosynthesis in Arabidopsis stems
cera突变体茎色泽浅绿,遗传分析表明为单基因隐性突变,电镜扫描显示突变体茎表皮蜡晶体缺失,气相色谱分析数据表明突变体茎表皮蜡减少是由C24以上超长链脂肪酸供应不足导致,这些性状与cut1和cer6相仿。cer6中C26以上蜡组分减少,然而cut1中C24以上蜡组分就已经减少,cut1突变体是将35S:antisense:CER6转入拟南芥野生型中得来。cut1突变体中CER6及其同源基因的表达都可能有不同程度的抑制[27]。cut1却和cera茎角质蜡化学组分相似,即都是C24以上蜡组分明显减少。虽然cera和cer6、cut1表型相似,但是cera所表现的由果荚短小导致的低育在潮湿环境中却不能像cer6和cut1一样得到恢复,这说明cera和cer6的功能可能存在差异。
野生型和cera茎表皮蜡化学组分和含量分析表明CERA基因在延长24个碳原子以上的超长链脂肪酸发挥作用。鉴于上述比较,我们对CERA基因的功能做以下分析。CERA可能是编码超长链脂肪酸合成酶复合体的3-酮脂酰-CoA缩合酶的CER6的等位基因;或者是不同于CER6的延伸C24超长链脂肪酸的合成酶;或者编码一种与CER6形成复合体的蛋白。CERA也可能在DNA、RNA或者蛋白水平调控延长C24以上超长链脂肪酸的合成酶方面发挥作用,在DNA水平上,CERA可能编码一种影响DNA甲基化或者组蛋白修饰的酶,以此阻碍编码延长C24以上超长链脂肪酸的合成酶的转录;在RNA水平,CERA可能是一种转录因子影响像CER6这样的延伸过程中的合成酶的转录,也可能是一种类似于CER7的外切体亚基,能够降解编码合成酶的mRNAs[28],或者通过micro RNA来降解与超长链脂肪酸合成有关的mRNAs;在蛋白水平,CERA可能涉及合成酶的翻译后修饰,例如泛素化,SUMO化,磷酸化和棕榈化等。除了上面我们讨论的CERA在C24以上超长链脂肪酸的延伸可能的影响外,它也可能具有酰基转移酶活性参与超长链脂肪酸的延伸。总之,本文章的数据表明CERA基因在拟南芥茎表皮延长24个碳原子以上的超长链脂肪酸过程中发挥重要作用,这值得我们克隆该基因并作深入研究。
4 结论
本试验发现茎色泽浅绿的cera突变体茎表皮蜡减少是由C24以上超长链脂肪酸供应不足导致,表明供应拟南芥茎表皮蜡合成的C24以上超长链脂肪酸是由特异的酶复合体催化生成。此外对野生型拟南芥茎表皮蜡各成分详细分析表明大部分C28、C26、C24和小部分C30超长链脂肪酸及其衍生物通过酰基还原途径参与蜡合成,而大部分C30和少部分C24、C26、C28超长链脂肪酸及其衍生物通过脱羧途径参与蜡合成。
[1]Kurdyukov S,Faust A,Nawrath C,et al.The epidermis-specific extracellular BODYGUARD controls cuticle development and morphogenesis in Arabidopsis[J].Plant Cell,2006,18:321-339.
[2]Walton T J.Waxes.cutin and suberin[M]//Harwood J L,Boyer J.Methods in plant biochemistry,Virginia:Academic Press,1990:106-158.
[3]Kunst L,Samuels A L.Biosynthesis and secretion of plant cuticular wax[J].Progr Lipid Res,2003,42:51-80.
[4]王多佳,苍晶,牟永潮,等.植物抗寒基因研究进展[J].东北农业大学学报,2009,40(10):134-138.
[5]Reicosky D A,Hanover J W.Physiological effects of surface waxes.I.Light reflectance for glaucous and nonglaucous Picea pungens[J].Plant Physiol,1978,62:101-104.
[6]Kerstiens G.Signalling across the divide:A wider perspective of cuticular structure-function relationships[J].Trends in Plant Science,1996(1):125-129.
[7]Barthlott W,Neinhuis C.Purity of the sacred lotus,or escape from contamination in biological surfaces[J].Planta,1997,202:1-8.
[8]Jenks M A,Joly R J,Peters P J,et al.Chemically induced cuticle mutation affecting epidermal conductance to water vapor and disease susceptibility in Sorghum bicolor(L.)Moench[J].Plant Physiol,1994,105:1239-1245.
[9]Eigenbrode S D,Espelie K E.Effects of plant epicuticular lipids on insect herbivores[J].Annu Rev Entomol,1995,40:171-172.
[10]Preuss D,Lemieux B,Yen G,et al.A conditional sterile mutation eliminates surface components from Arabidopsis pollen and disrupts cell signaling during fertilization[J].Genes Dev,1993(7):974-985.
[11]Greene P R,Ban C D.Total internal reflection Raman spectroscopy of barley leaf epicuticular waxes in vivo[J].Colloids Surfaces B,2005,45:174-180.
[12]Wettestein-Knowles P V.Biosynthesis and genetics of waxes[M]//Waxes:chemistry,molecular biology and functions.Hamilton R J.Dundee:The Oily Press.1995:131-174.
[13]Fehling E,Mukherjee K D.Acyl-CoA elongase from a higher plant(Lunaria annua):Metabolic intermediates of very-longchain acyl-CoA products and substrate specificity[J].Biochim Biophys Acta,1991 1082(3):239-246.
[14]Millar A A,Clemens S,Zachgo S,et al.CUT1,an Arabidopsis gene required for cuticular wax biosynthesis and pollen fertility,encodes a very-long-chain fatty acid condensing enzyme[J].Plant Cell,1999(11):825-838.
[15]Cheesbrough T M,Kolattukudy P E.Alkane biosynthesis by decarbonylation of aldehydes catalyzed by a particulate preparation from Pisum sativum[J].Proc Natl Acad Sci USA,1984,81:6613-6617.
[16]Kolattukudy P E.Enzymatic synthesis of fatty alcohols in Brassica oleracea[J].Arch Biochem Biophys,1971,142:701-709.
[17]von Wettstein-Knowles P M.Genetics and biosynthesis of plant epicuticular waxes[M]//Applequist L,Liljenberg C.Advances in biochemistry and physiology of plant lipids,The Netherlands:Elsevier/North Holland Biomedical Press,1979:1-26.
[18]Aarts M G M,Keijzer C J,Stiekema W J,et al.Molecular characterization of the CER1 gene of Arabidopsis involved in epicuticular wax biosynthesis and pollen fertility[J].Plant Cell,1995(7):2115-2127.
[19]Xia Y,Nikolau B J,Schnable P S.Cloning and characterization of CER2,an Arabidopsis gene that affects cuticular wax accumulation[J].Plant Cell,1996(8):1291-1304.
[20]Negruk V,Yang P,Subramanian M,et al.Molecular cloning and characterization of the CER2 gene of Arabidopsis thaliana[J].Plant Journal,1996(9):137-145.
[21]Hannoufa A,Negruk V,Eisner G,et al.The CER3 gene of Arabidopsis thaliana is expressed in leaves,stems,roots,flowers and apical meristems[J].Plant Journal,1996(10):459-467.
[22]Rowland O,Zheng H,Hepworth S R,et al.CER4 encodes an alcohol-forming fatty acyl-coA reductase involved in cuticular wax production in Arabidopsis[J].Plant Physiol,2006,142(3):866-877.
[23]Pighin J A,Zheng H,Balakshin L J,et al.Plant cuticular lipid export requires an ABC transporter[J].Science,2004,306:702-704.
[24]Hooker T S,Millar A A,Kunst L.Significance of the expression of the CER6 condensing enzyme for cuticular wax production in Arabidopsis[J].Plant Physiol,2002,129(4):1568-1580.
[25]Zheng H,Rowland O,Kunst L.Disruptions of the Arabidopsis enoyl-coA reductase gene reveal an essential role for very-longchain fatty acid synthesis in cell expansion during plant morphogenesis[J].Plant Cell,2005,17:1467-1481.
[26]刘守伟,刘士勇.拟南芥室内培养技术研究[J].东北农业大学学报,2007,38(2):279-281.
[27]Fiebig A,Mayfield J A,Miley N L,et al.Alterations in CER6,a gene identical to CUT1,differentially affect long-chain lipid content on the surface of pollen and stems[J].Plant Cell,2000(12):2001-2008.
[28]Hooker T S,Lam P,Zheng H,et al.A core subunit of the RNA processing/degrading exosome specifically influences cuticular wax biosynthesis in Arabidopsis[J].Plant Cell,2007,19:904-913.
