液体复合酶对草鱼生长、养分消化率及体组成的影响
武 汉 工 业 学 院 王辅臣 黄 峰 汪 华 丁斌鹰
武汉新华扬生物股份有限公司 周金敏 张 伟
饲料中添加酶制剂可有效提高饲料的利用率,降低饲料成本,提高养殖效益(陈喜斌,2003)。目前,在水产酶制剂的相关研究中,大多采用直接添加固态酶制剂,但调质和制粒时的高温可能会使添加的酶失活,从而影响酶制剂的添加效果。本研究以草鱼为研究对象,采用后喷涂方式在饲料中喷涂不同水平的液体复合酶,研究其对草鱼生长、养分消化率及体组成的影响,旨在为液体复合酶制剂在水产饲料中的应用提供试验依据。
1 材料与方法
1.1 试验鱼和试验复合酶 试验用草鱼购自武汉东西湖渔场,初始体重4.6 g左右。试验前将草鱼集中暂养于2 m×1.5 m×1.5 m的暂养池中,投喂基础日粮驯化1周。挑选体质健康,大小一致的试验鱼,经药物浸洗后随机分为9组,每组设3个重复,每个重复35尾鱼,随机放入已经消毒的室内圆形水族箱(直径80.0 cm,高60.0 cm)中进行饲养,试验期为84 d。
试验用酶制剂为液体水产专用复合酶,由武汉新华扬生物股份有限公司提供。液体复合酶组成:木聚糖酶6000 IU/mL、葡聚糖酶1000 U/mL、甘露聚糖酶20000 U/mL和纤维素酶20000 U/mL。
1.2 试验设计 试验采用梯度法,以粗蛋白质含量35%左右的配合饲料作为基础日粮 (CA组);在基础日粮中直接添加0.20 mL/kg液体复合酶(CE组);调整基础日粮的大宗原料配方,使饲料蛋白质含量降至33%左右(Ⅰ组);在Ⅰ组基础上分别添加0.20 mL/kg和0.30 mL/kg液体复合酶(Ⅱ和Ⅲ组);再调整配方使饲料蛋白质含量降至32%左右 (Ⅳ组);在Ⅳ组基础上分别添加0.20 mL/kg和0.30 mL/kg液体复合酶(Ⅴ和Ⅵ组)。
各组日粮组成及营养水平见表1。饲料原料粉碎后以倍增法充分混合,制成2 mm粒径的配合饲料。采用后喷涂方法将液体酶制剂添加到饲料中,晾干后于低温干燥处保存,备用。
1.3 饲养管理 采用循环水养鱼,24 h充气增氧,每天投喂 2 次,时间分别为 9∶00 和 16∶00,投喂率为鱼体重的2%~3%,随着鱼体生长调整投喂量。每3 d换水一次,换水量为1/4~1/3,保持水中溶解氧大于6 mg/L,试验期间水温25℃左右,pH 7.0~7.5。
1.4 生长性能指标测定 试验开始前以及试验结束时,将试验鱼饥饿24 h,每缸称重。根据采食量计算增重率、特定生长率和饵料系数。
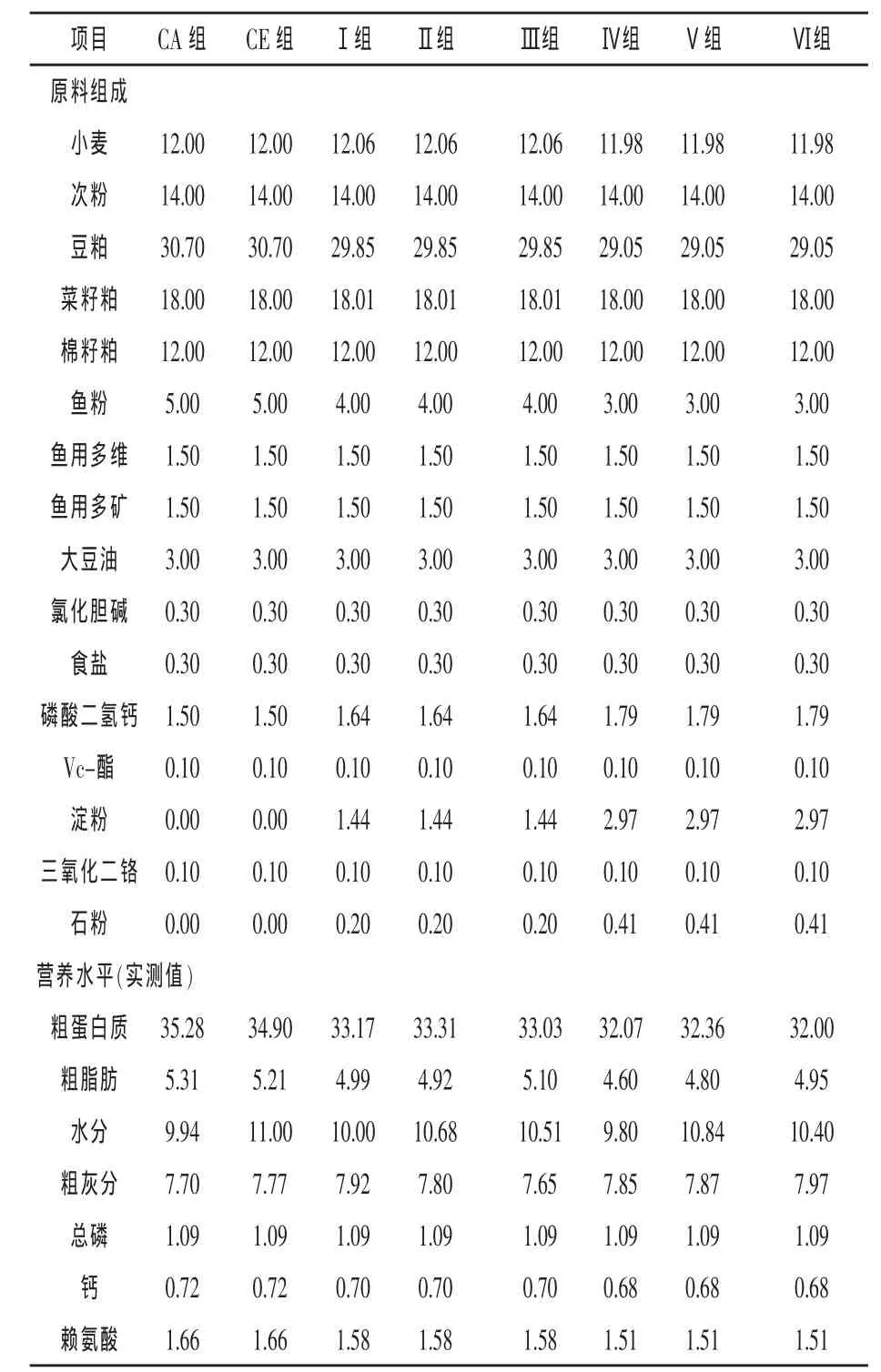
表1 饲料配方及营养水平 %
存活率/%=成活草鱼尾数/投放草鱼尾数;
增重率/%=(试验末鱼均重-试验初鱼均重)/试验初鱼均重×100;
特定生长率/%=(ln试验末鱼均重-ln试验初鱼均重)/试验天数×100;
饲料系数=摄取的饲料总重量 /(试验末鱼总体重+试验中死亡鱼体重-试验初鱼总体重)。
1.5 表观消化率测定 以Cr2O3为指示剂,用虹吸法收集粪便,采用二苯碳酰二肼丙酮法测定Cr2O3含量(高民和冯宗慈,1993),凯氏定氮法测定粗蛋白质含量(杨胜,1991),计算饲料干物质、粗蛋白质、粗脂肪的表观消化率。
干物质表观消化率/%=(1-饲料Cr2O3含量/粪便 Cr2O3含量)×100;
1.6 消化酶活性的测定 每个重复随机抽取3尾鱼,于冰盘中处死,取出全部的肠道,剥除肠道外的脂肪和结缔组织,用冷冻去离子水洗净肠道中的内容物,滤纸吸干水分,称重。加入10倍冷冻去离子水,于4℃冰浴中匀浆,离心15 min(4℃、12000 r/min),所得上清液即为消化酶粗酶液。酶液于4℃保存,24 h内检测酶活。
蛋白酶活力测定采用福林-酚试剂法(朱俭,1981)。蛋白酶活力单位定义:在 30℃,pH 7.5,底物酪蛋白浓度为2%的条件下,1 min内1 g组织中蛋白酶分解酪蛋白产生1 μg酪氨酸为一个活力单位(μg/min·g)。
淀粉酶活力测定采用3,5-二硝基水杨酸显色法(陈毓荃,2002),淀粉酶活力单位定义:在30℃,pH 7.5,1%的可溶性淀粉作为底物条件下,1 min内1 g组织中的淀粉酶能完全水解淀粉产生1 mg麦芽糖为一个活力单位(mg/min·g)。
1.7 数据处理 用SPSS 16.0软件对试验数据进行处理和统计学分析。若差异达到显著,则进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 液体复合酶对草鱼生长性能的影响 从表2可以看出,CE组草鱼的增重率和特定生长率大于CA组,Ⅱ和Ⅲ组草鱼的增重率、特定生长率均大于Ⅰ组,Ⅴ和Ⅵ组草鱼的增重率、特定生长率也大于Ⅳ组。表明在同一蛋白质水平的饲料中直接添加0.20~0.30 mL/kg的液体酶均可在一定程度上提高草鱼的生长速度。但是Ⅰ组草鱼的增重率、特定生长率低于CA组,Ⅳ组草鱼的增重率、特定生长率又低于Ⅰ组,表明降低饲料蛋白质含量2%~3%会减缓草鱼的生长速度。但是,Ⅱ、Ⅲ、Ⅴ和Ⅵ组草鱼的增重率、特定生长率大于CA组,表明适当降低饲料蛋白含量的同时添加0.20~0.30 mL/kg的液体酶制剂会改善草鱼的生长性能。此外,第Ⅵ组的饲料系数显著小于其他各组,说明添加液体复合酶在降低草鱼饲料系数方面也具有一定的效果。
2.2 液体复合酶对草鱼饲料表观消化率的影响从表3可以看出,试验鱼对各组饲料干物质、粗蛋白质和粗脂肪的表观消化率差异不显著(P>0.05)。说明一定限度内降低饲料蛋白质含量、添加液体复合酶制剂对草鱼饲料消化吸收无显著影响。
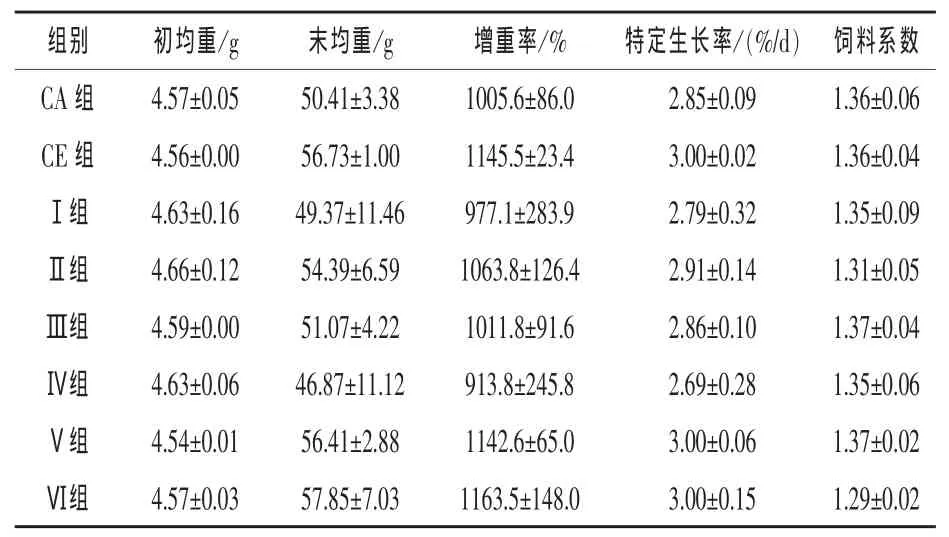
表2 液体复合酶对草鱼生长性能的影响
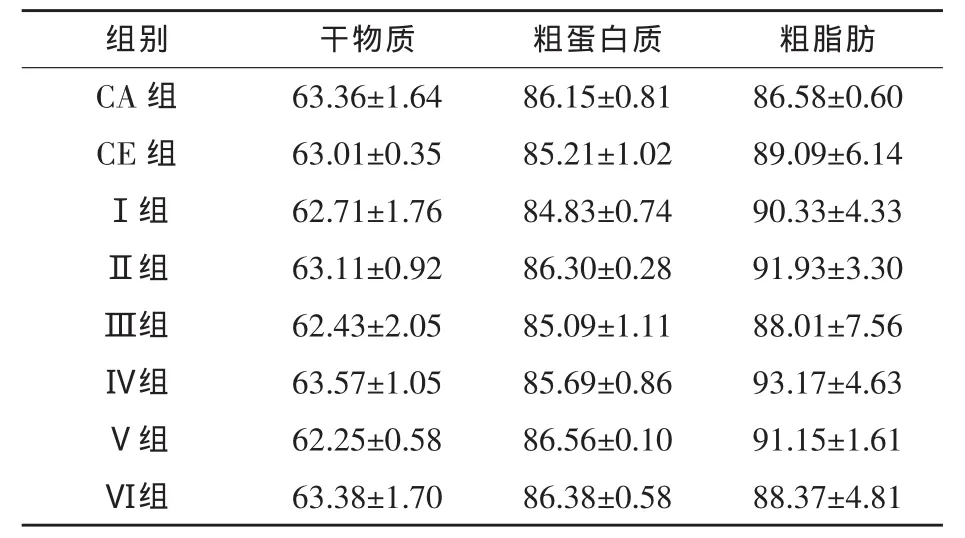
表3 液体复合酶对草鱼饲料表观消化率的影响 %
2.3 液体复合酶对草鱼体组成的影响 表4显示,CE组草鱼鱼体粗脂肪含量略低于CA组(P>0.05)。此外,当饲料蛋白质含量为33%左右(Ⅰ、Ⅱ、Ⅲ组)时,随着液体酶制剂添加量的升高,草鱼鱼体粗蛋白质含量呈上升趋势,粗脂肪含量呈降低趋势。结果表明,在饲料中使用液体酶制剂不会影响草鱼的体组成。
2.4 液体复合酶对草鱼内源性消化酶活性的影响 从表5可以看出,CE组蛋白酶和淀粉酶活性高于CA组,Ⅱ和Ⅲ组蛋白酶和淀粉酶活性均大于Ⅰ组,Ⅴ和Ⅵ组蛋白酶和淀粉酶活性也大于Ⅳ组,并且在前肠达显著水平(P<0.05)。表明在同一蛋白质水平的饲料中直接添加0.20~0.30 mL/kg的液体复合复合酶有提高草鱼肠道和肝胰脏内源性消化酶活性的趋势。同时,Ⅱ、Ⅲ、Ⅴ和Ⅵ组草鱼的淀粉酶活性、前肠蛋白酶活性还大于CA组,Ⅴ和Ⅵ组草鱼的后肠和肝胰脏蛋白酶活性大于CA组,表明适当降低饲料蛋白质含量的同时添加0.20~0.30 mL/kg的液体复合酶不会影响草鱼肠道和肝胰脏内源酶活性。
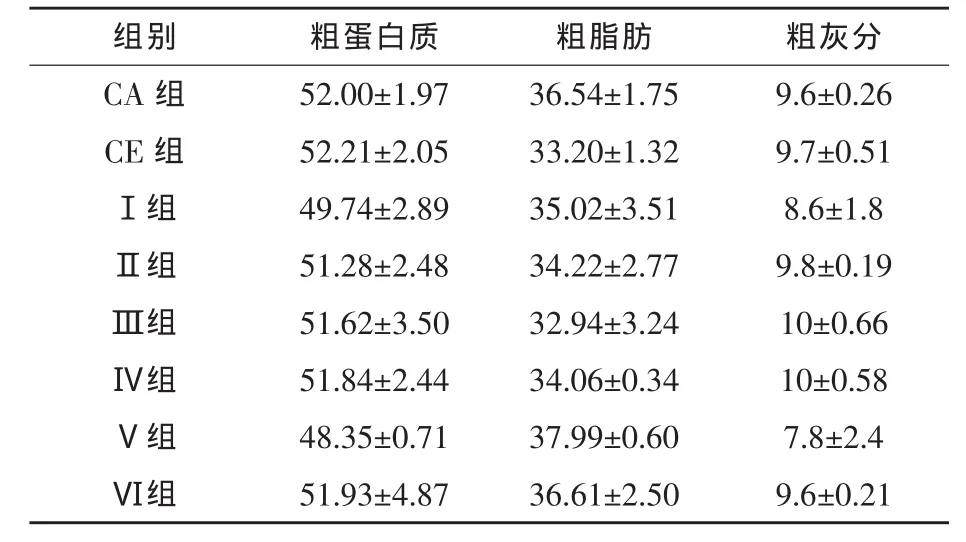
表4 液体复合酶对草鱼体组成的影响 %
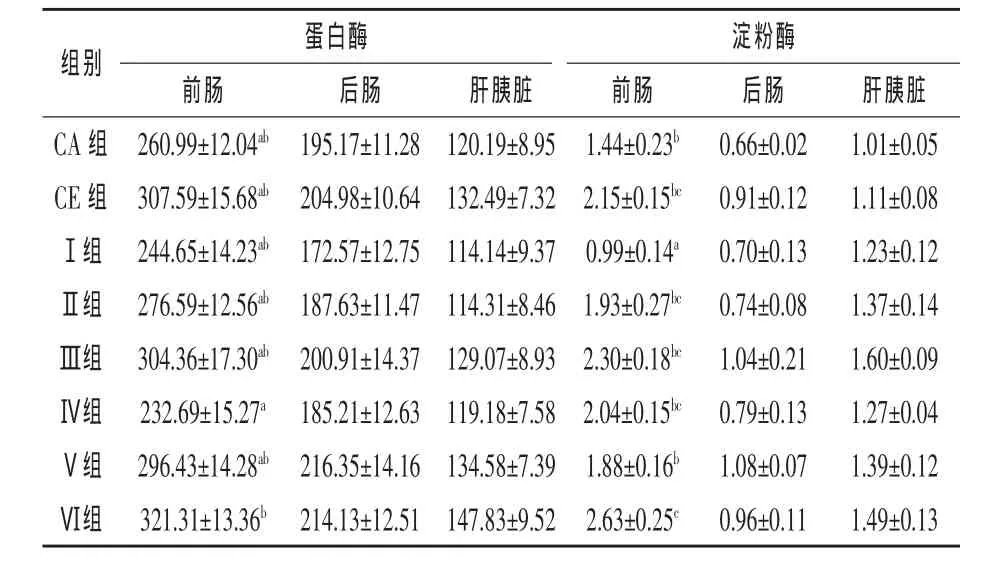
表5 液体复合酶制剂对草鱼消化酶活性的影响 U/g组织
3 讨论
3.1 液体复合酶制剂对草鱼生长性能的影响Carter等(1994)研究表明,在基础日粮中添加复合酶制剂,能促进大西洋鲑的生长,提高饲料转化率;邓岳松(2005)和周小秋等(2001)通过试验也分别证实了复合酶制剂对草鱼和鲤鱼的促生长作用。本试验在以豆粕、菜粕等植物性原料为蛋白源的基础饲料中添加不同水平的液体复合酶制剂,草鱼增重率和特定生长率有所提高。适当降低饲料蛋白质含量,同时添加0.20~0.30 mL/kg液体酶,各组草鱼增重率、特定生长率依然呈现良好的增加态势。这说明液体复合酶制剂能改善草鱼的生长性能,其原因可能是上述复合酶制剂中各种酶协同作用,促进了生长(王爱民和刘文斌,2006;钟国防和周洪琪,2005;冯定远,2005)。
3.2 液体复合酶制剂对草鱼体组成的影响 本试验表明,液体复合酶制剂对草鱼体组成影响不显著(P > 0.05)。 Vielma等(2000)研究了植酸酶对虹蹲成鱼体组成的影响,结果表明,添加外源酶没有显著改变鱼体的粗灰分含量,对鱼体组成无显著影响,与本试验结论一致。
4 小结
试验结果表明,在饲料中直接添加或适当降低饲料蛋白质含量的同时添加0.20~0.30 mL/kg液体酶,均可在一定程度上改善草鱼的生长性能,促进草鱼的内源性蛋白酶和淀粉酶等消化酶的分泌,而且不会影响草鱼的体组成。
[1]陈毓荃.生物化学试验方法和技术.北京:科学出版社,2002.83~86.
[2]陈喜斌.饲料学[M].北京:科学出版社,2003.
[3]邓岳松.耐高温酶制剂对草鱼生长的影响[J].内陆水产,2005,30(6):45 ~ 46.
[4]冯定远.非淀粉多糖酶在饲料中应用的作用机理及其影响因素[J].科技致富向导,2005,8:1~6.
[5]高春生,刘忠虎,肖传斌.木聚糖酶对草鱼生长性能和消化率的影响[J].饲料研究,2006,8:48 ~ 49.
[6]高民,冯宗慈.一种改进的铬的测定方法[J].内蒙古畜牧科学,1993,3:42~43.
[7]韩庆,夏维福,罗玉双,等.酶制剂对黄颡鱼生长性能的影响[J].水产学杂志,2002,15(1):84 ~ 87.
[8]黄峰,施培松,文华,等.外源酶对草鱼鱼种生长及饲料表观消化率的影响[J].安徽农业科学,2008,36(3):1057 ~ 1059.
[9]李尚坤,计成,刘永刚,等.复合酶制剂对肉种鸡生产性能和繁殖性能的影响[J].中国畜牧杂志,2007,43(3):19 ~ 22.
[10]刘文斌.饲料中添加酶制剂对异育银鲫消化和增重影响[J].南京农业大学学报,1999,22(3):57 ~ 60.
[11]罗有文,蒋正宇,周岩民,等.酶制剂对饲喂不同蛋白和能量水平日粮生长猪生产性能和养分消化率的影响[J].家畜生态学报,2006,27(6):78~82.
[12]王爱民,刘文斌.外源酶对异育银鲫鱼种生长及表观消化率的影响研究[J].饲料工业,2006,27(2):26~29.
[13]王纪亭,万文菊,康明江,等.复合酶制剂对草鱼生长性能、饲料养分消化率及免疫力的影响[J].大连水产学院学报,2009,24(5):417 ~ 422.
[14]余丰年,王道尊,徐洪杰.纤维素酶对团头鲂生长及饲料利用的影响[J].上海水产大学学报,2001,10(1):90 ~ 92.
[15]杨胜.饲料分析及饲料质量检测技术[M].北京:中国农业出版社,1991.
[16]钟国防,周洪琪.木聚糖酶和复合酶制剂PS对尼罗罗非鱼生长性能、非特异性免疫能力的影响[J].海洋渔业,2005,27(4):286 ~ 291.
[17]钟国防,周洪琪.木聚糖酶和复合酶制剂PS对尼罗罗非鱼生长性能、消化率以及肌肉营养成分的影响 [J].浙江海洋学院学报 (自然科学版),2005,24(4):324 ~ 329.
[18]周小秋.酶制剂在鲤鱼饲料中适宜添加量研究[J].水利渔业,2001,21(6):7 ~ 8.
[19]朱俭.生物化学试验[M].上海:上海科学技术出版社,1981.186~190.
[20]Carter C G,Houlihan D F,Buchanan B,et al.Growth and feed utilization efficiencies of seawater Atlantic salmon,Salmo salar L,fed a diet containing supplementary enzymes[J].Aquaculture Research,1994,25(1):37 ~ 46.
[21]Veilma J,Makinen T,Ekholm P,et al.Influence of dietary soy and phytase levels on performance and body composition of large rainbow trout(Oncorhynchus mykiss)and algalavailability ofphosphorusload[J].Aquaculture,2000,183(3~4):349 ~ 362.

