光皮树的组织培养研究初探
刘 清,彭晓英*,刘永涛,周双德,赵黎明,张良波
(1.湖南农业大学生物科学技术学院,湖南长沙 410128; 2.湖南省林业科学院,湖南长沙 410004)
光皮树 (Swida wilsoniana Wanaer)为山茱萸科(Cornaceae)梾木属 (Swide opiz)落叶灌木或乔木,其干果含油率达26%~36%,且果实油中含油酸和亚油酸高达77.68%,可通过酯化工艺制取生物柴油[1-2]。其燃料特性和动力性与0#柴油相似,是一种优良的代用燃料[3-5]。对石油能源枯竭的担忧,以及利用光皮树油制取生物柴油研究的快速开展,使得光皮树作为重要的生物柴油原料得到广泛关注。
目前,光皮树的繁殖主要是通过播种育苗、扦插育苗和嫁接繁殖[6-8],播种育苗子代个体分化明显,难以保持母本的优良性状;而扦插和嫁接育苗周期较长,易受病虫害影响。如能运用组织培养技术建立光皮树无性系,则可以不受气候影响,在较短时间内繁育大量光皮树良种苗木[7]。因此,本研究拟采用组织培养手段,通过愈伤组织的诱导和分化及腋芽增殖等途径,旨在建立光皮树离体繁殖体系。
1 材料与方法
1.1 材料
采自湖南省林业科学院经济林苗圃的光皮树成熟种子 (2007年11月成熟)和嫩枝条 (2008年3月采集)。
1.2 方法
1.2.1 光皮树种子和嫩枝条处理
(1)光皮树种子处理:将光皮树种子摩擦破皮,消毒后接种于基本培养基中。15 d左右种子开始萌动,长出子叶和胚轴。分别以子叶和胚轴为外植体进行培养。
(2)光皮树嫩枝条处理:将采集的嫩枝条放在装有少许自来水的烧杯中,培育一周左右。待光皮树腋芽伸长后,分别以茎段、顶芽、叶片和带腋芽的茎段为外植体进行培养。
1.2.2 培养条件 培养室温度25±2℃,日光灯光照14 h/d,光照强度为2 000 lx。
1.2.3 取材与接种 将光皮树种子接种到基本培养基上,获得无菌种子苗。①切割其胚轴和子叶分别以平放和竖插两种方式转入愈伤组织诱导培养基中培养。②切割茎段、顶芽、叶片和带腋芽茎段为外植体,茎段和顶芽切段、叶片切块,用70%酒精快速浸泡,无菌水冲洗后转入0.1%的升汞中消毒,无菌水冲洗3次。70%酒精的浸泡时间取0、30、60 s,0.1%升汞溶液的消毒时间取4、6、9 min。然后接种于基本培养基上进行培养。10 d后统计污染率,20 d后统计褐化率。
1.2.4 愈伤组织诱导 将切割的茎段、顶芽、叶片、胚轴、子叶和带腋芽的茎段分别接种于附加不同浓度配比的2,4—D和KT的MS培养基中,在愈伤组织诱导试验过程中,2,4—D设3个浓度梯度,KT设3个浓度梯度。出愈率为培养30 d后诱导出愈伤的外植体数与接种外植体数之比。
1.2.5 不定芽的诱导 将诱导出的愈伤组织切块,接种于附加不同浓度配比的6—BA和NAA的MS培养基上进行培养,观察愈伤组织的生长情况。愈伤组织的诱导分化试验设计中6—BA设5个浓度梯度,NAA设2个浓度梯度。分化率为培养30 d后分化的愈伤组织数与接种愈伤组织数之比。
1.2.6 腋芽增殖 将经过处理的腋芽接种于添加不同浓度配比的6—BA和KT的MS培养基上进行培养,观察腋芽增殖过程中所发生的变化。其中带腋芽的茎段分为平放和竖插两种方式。在试验过程中,6—BA设5个浓度梯度,KT设2个浓度梯度。增殖率为培养30d后总的腋芽数目与最初接种时的腋芽数目的比值。
1.2.7 根的诱导 待丛芽长至2~3 cm时,切割分离,转入不同浓度配比的IAA和NAA的MS培养基上,诱导生根。NAA和IAA均设3个浓度梯度。
2 结果与分析
2.1 不同消毒时间对不同外植体的影响
用70%酒精和0.1%升汞溶液对光皮树的茎段、顶芽、叶片分别进行消毒处理,不同处理时间的效果见表1。
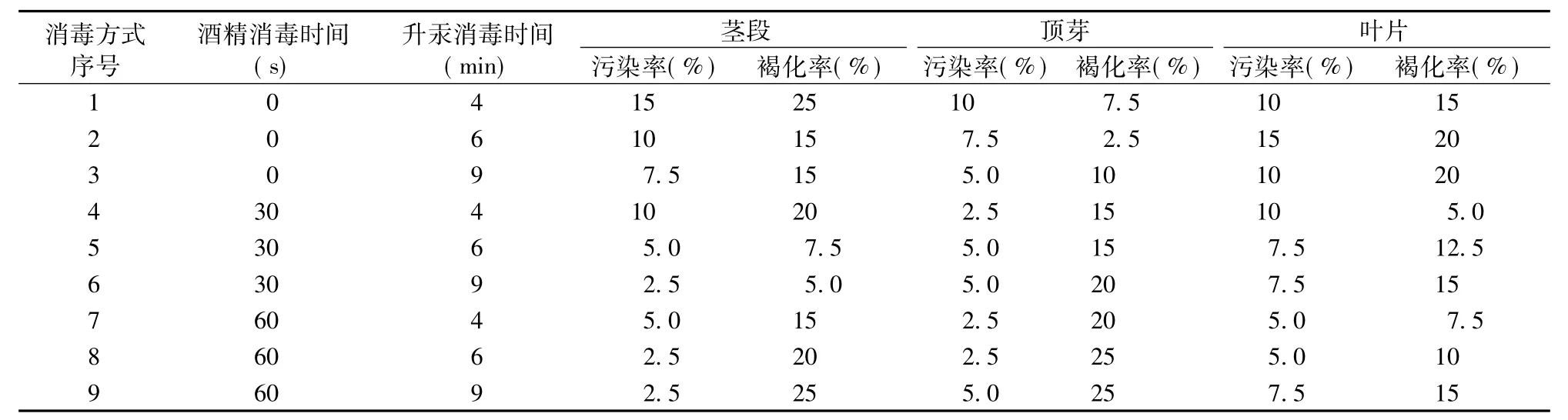
表1 不同消毒试剂和消毒时间对外植体的影响Tab.1 Effects of different sterilization reagent and sterilization time on explants
表1结果显示:单独使用升汞消毒时,各外植体的污染率最高,如茎段污染率达到15%,而与酒精配合使用后,污染率有明显下降,当酒精中浸泡时间为30 s时,茎段污染率下降至10%。这是因为光皮树茎段、顶芽和叶片表面都有细柔毛,而70%的酒精穿透力较强,能短时间渗透消毒,故与升汞搭配使用较为适宜。随酒精和升汞溶液中消毒时间的延长,外植体的污染率呈下降趋势,而褐化渐趋明显,褐化率上升。从表1中结果看出,茎段作为外植体时,在酒精中浸泡30 s后清洗,再于升汞溶液中消毒4~6 min时,材料的污染率较小,且褐化率相对较低,最佳的消毒时间为70%酒精30 s,0.1%升汞9 min;顶芽最佳的消毒时间为70%酒精30 s,0.1%升汞4 min;而叶片表面柔毛较多,故70%酒精60 s后0.1%升汞中处理4 min,能达到较理想的效果。
2.2 不同生长调节剂配比对不同外植体愈伤组织诱导的影响
光皮树愈伤组织诱导频率与外植体来源有直接关系。六种外植体在接种到不同生长调节剂配比的培养基中,均能诱导出愈伤组织,但诱导条件和愈伤组织的生长情况不尽相同。(见表2)叶片在第8天开始卷曲,切口边缘开始长出亮白色的愈伤组织 (图1a);茎段在第4天开始启动 (图1b),10 d后长出淡黄色致密愈伤组织,生长迅速 (图1c);顶芽启动稍晚些,但生长较快,后期长势良好 (图1g)。
结果表明:2,4—D浓度在1~4 mg/L范围内随着浓度的增加,愈伤组织的诱导率呈上升趋势,但2,4—D浓度过高 (4 mg/L)抑制愈伤组织的产生,导致愈伤组织出现玻璃化现象。当2,4—D和KT浓度分别为2 mg/L和0.5 mg/L时,愈伤组织的诱导率较高。其中茎段在最适培养基上出愈率最高,达到90%,愈伤组织质地致密颜色淡黄绿色,生长速度较快 (图1c);叶片的出愈率次之,后期达到89%,愈伤组织质地疏松颜色发白 (图1a);子叶的出愈率达到88%,形成了质地疏松,淡黄色愈伤组织,后期呈现玫瑰红色(图1d);带腋芽的茎段出愈率达到84%,形成了疏松,玻璃化的愈伤组织 (图1e);胚轴的出愈率达到81%,形成了疏松玻璃化的愈伤组织 (图1f);顶芽的出愈率也达到85%,形成了致密,淡黄色的愈伤组织(图1g)。
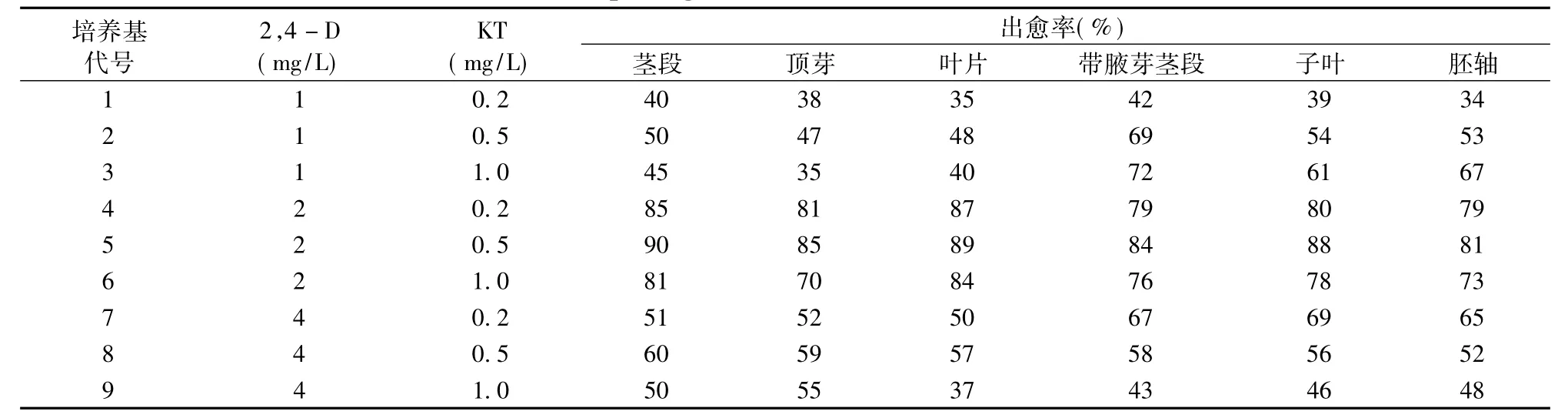
表2 不同浓度组合植物生长调节剂对愈伤组织诱导的影响Tab.2 Effects of different plant growth substances combination on callus induction

图1 光皮树不同外植体的愈伤组织 (一)Fig.1 The callus of different explant of S.wilsoniana(a)
2.3 不同生长调节剂浓度组合对愈伤组织分化的影响
将切块的愈伤组织转接到分化培养基 (MS+6BA 2.0 mg/L+NAA 0.2 mg/L和MS+6BA 4.0 mg/L+NAA 0.4 mg/L)中进行培养,20 d后发现由叶片、胚轴、子叶和带腋芽的茎段长出的愈伤组织均呈现玻璃化和黏液化现象。而由茎段长出的愈伤组织质地依然致密,颜色淡黄绿色。因此,将由茎段诱导出的愈伤组织转入不同生长调节剂浓度配比的培养基上,35 d后统计愈伤组织上的不定芽分化率并记录愈伤组织的变化情况。结果见表3。
实验结果表明:由茎段诱导出的愈伤组织接种于上述供试培养基中均未分化。随着6—BA浓度的升高,愈伤组织的质地由疏松变化成稍致密,颜色由透明变为浅黄色再到浅黄绿色,为分化提供了可能性。6—BA(4.0 mg/L)和NAA(0.5 mg/L)稍有利于致密浅黄绿色愈伤组织的继代培养。
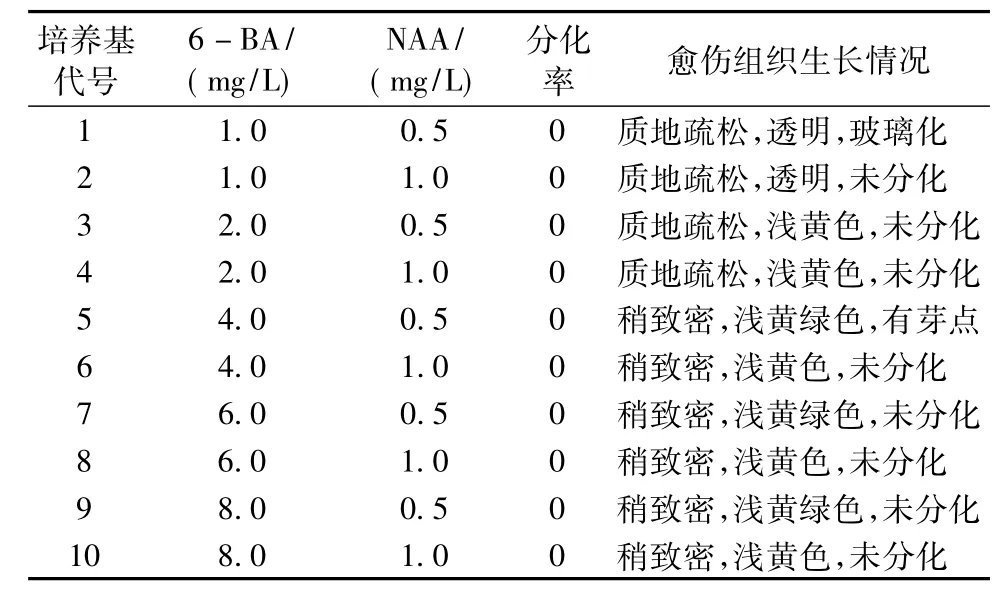
表3 不同生长调节剂浓度组合对不定芽分化的影响Tab.3 The concentration of different growth regulator combinations on the differentiation of adventitious buds
2.4 不同生长调节剂浓度组合对光皮树腋芽增殖的影响
将光皮树带腋芽的茎段接种于不同生长调节剂浓度配比的培养基中,接种方式分为平放和竖插。观察腋芽增殖的情况,并记录。结果见表4。
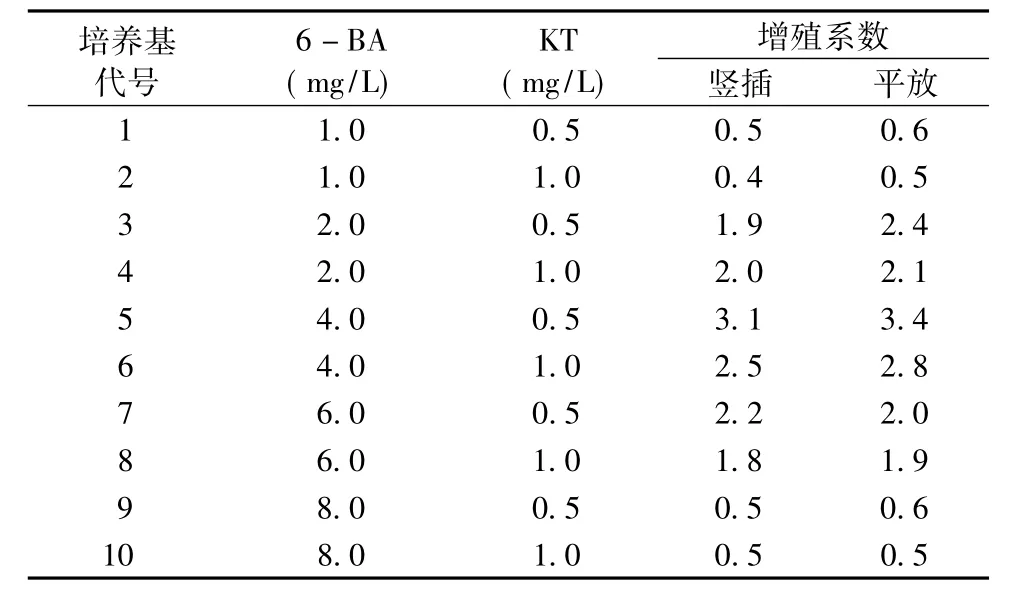
表4 不同生长调节剂浓度配比对腋芽增殖的影响Tab.4 Different growth regulators and their concentration ratio on the impact of axillary bud proliferation
表4结果表明:带腋芽的茎段在进行平放和竖插时,二者的增殖系数相差无几。6—BA的浓度处于1.0 mg/L和8.0 mg/L时,腋芽的增殖系数较低。从总体上来看,随着6—BA浓度的增大,增殖系数先增后降。6—BA浓度为4.0 mg/L、KT为0.5 mg/L时,两种接种方式的增殖系数均最高,平放时可达3.4。带腋芽的茎段平放时,接种4 d后腋芽开始萌动,呈浅嫩绿色且茎段基部膨大,10 d后在腋芽基部周围产生数量不等的丛芽数 (2~6个)(图2a);竖插时,接种6 d后腋芽开始萌动,15 d后产生数量不等的丛芽数 (1~5个)。其中平放时茎段腋芽增殖效果较好,生长明显,长势旺盛,茎段健壮 (图2c)。

图2 光皮树不同外植体的愈伤组织 (二)Fig.2 The callus of different explant of S.wilsoniana(b)
2.5 不同生长调节剂浓度组合对生根的影响
将丛芽转接入供试生根培养基中,丛芽基部逐渐褐化或未见根的分化。其原因可能是因为光皮树为多年生木本植物,而多年生木本植物普遍存在生根较困难或生根时间较长等现象[9]。另外供试生长调节剂的浓度组合可能不适宜光皮树的生根培养。
3 讨论
3.1 子叶和胚轴接种方式对愈伤组织诱导的影响
在本试验中发现,子叶和胚轴诱导愈伤过程中,子叶和胚轴平放对诱导愈伤较好,这可能是因为子叶和胚轴平放,能充分接触培养基,从中吸收养分,接受生长调节剂的诱导,因此两端切口处的出愈率高,愈伤组织长势较好;当子叶和胚轴插入培养基,仅切面细胞接触,吸收及接受生长调节剂诱导的面积小,向上运输养分和生长调节剂困难,导致子叶和胚轴出愈率下降。在子叶和胚轴诱导不定芽再生过程中,仅仅产生愈伤,均未诱导出芽点,可能是细胞分裂素和生长素的比值影响了芽的分化,需要进一步探索诱导分化的培养基。
3.2 外植体类型与愈伤组织诱导的关系
来源于光皮树不同部位的愈伤组织在结构和颜色及生长特性等方面都有明显的差异。本试验以叶片、茎段、顶芽、子叶、胚轴和带腋芽的茎段为外植体进行愈伤组织的诱导,该愈伤组织质地疏松,在添加较高浓度的6—BA与适量NAA的诱导培养基中,以茎段为外植体时,能在切口处膨大产生质地稍硬的致密愈伤组织,颜色变成浅黄绿色。在同样的培养条件下,叶片、顶芽、子叶和胚轴等外植体却只能诱导出愈伤组织,颜色一般为透明,质地疏松。分析其原因,可能是不同部位外植体的组织结构和细胞类型不同,它们产生愈伤组织所需要的生长调节物质种类和所需量也有很大的差别。故以茎段为外植体,愈伤组织的启动能力明显比其他外植体强,诱导时间短于其他外植体的诱导时间,且愈伤组织生长速率快,细胞分裂时间短,这与有关报道所述光皮树植株幼嫩茎段细胞分裂旺盛,易于再分化[10]相符。
3.3 不同植物生长调节剂对外植体愈伤组织诱导和分化的影响
植物组织培养的愈伤组织分化过程是生长素含量逐步降低、细胞分裂素含量逐步升高的过程。本实验中愈伤组织未能分化,一种可能是由于还不了解光皮树自身激素的状况,没有找到适合诱导分化的细胞分裂素与生长素比值;另外一种可能是由于高质量浓度的2,4—D对外植体及愈伤组织的伤害。一些研究者认为,尽管较高质量浓度的2,4-D有利于胚性愈伤组织的诱导,但高质量浓度的2,4—D使整个培养系统的生长调节物质比例始终处于高比例的生长素类似物状态,从而不利于随后进行的愈伤组织分化再生芽的过程[11-12];第三种可能是由于所诱导的愈伤组织属于非胚性愈伤组织,这与有关资料所述的“非胚性愈伤组织分化率低,甚至不分化”的观点相符合[12-13]。
4 结语
本文分别从光皮树愈伤组织的诱导、增殖、分化和腋芽增殖等途径进行研究,各外植体均能诱导愈伤组织,但不定芽分化困难,在愈伤组织诱导不定芽的途径中,愈伤组织在分化培养基上相当长一段时间内形态上几乎没有变化。有研究者认为初代培育时培养基配方中的酸性物质使外植体处于酸性环境中并导致植物正常细胞首先发生细胞壁酸性降解,随后出现原生质体脱离细胞壁,进一步发生细胞器重组或细胞重建[14]。在愈伤组织形成后,如果转移过早,还未形成成熟的脱分化组织;过晚,愈伤组织可能褐化或丧失进一步分化的能力。所以探索出合适愈伤组织的转移及其分化时刻也是间接诱导不定芽途径中非常重要的工作环节。今后还应在继代培养、不同时期的愈伤组织细胞切片以及次生代谢物方面作深入的研究,从而在生理的基础上,了解其生长发育的机制。特别是如能从分子水平上检测光皮树不同发育阶段对各种理化因子的需求,以及通过探索光皮树不同生长期对各种生长调节剂的应答机制,了解不同生长调节剂之间和光皮树的相互作用,从而建立一套完整的离体培养体系。这将对实现光皮树工厂化育苗及进一步利用基因工程技术实现对高油含量光皮树遗传转化奠定技术基础,具有重要实践意义。
[1]万志洲,黄利斌,等.明孝陵光皮树的生物学特性及繁育技术研究[J].林业实用技术,2007(2):3-5.
[2]梁仰贞.值得发展的油料植物——光皮树 [J].植物杂志,1996(2):12.
[3]梁仰贞.光皮树栽培技术 [J].特种经济植物,2007,10(3):38-39.
[4]李昌珠,蒋丽娟,程树棋.生物柴油研究现状与商业化应用前景[C] //中国生物质能技术研讨会论文.南京,2002.
[5]李正茂,邓新华,李党训.光皮树经济性状及生物质液体燃料开发研究构想[J].湖南林业科技,1996,23(2):11-13.
[6]成训妍.光皮树是珍贵的木本食用油料资源 [J].生物与特产,1990(6):28.
[7]本玛丽,王晓明,李永欣,等.光皮树优良无性系组织培养的无菌体系建立[J].湖南林业科技,2010,37(2):5-8.
[8]曾红燕,李昌珠,蒋丽娟,等.不同方法提取光皮树籽油的GC-MS分析 [J].中国生物工程,2004,11(24):83-86.
[9]朱玉球,童再康,黄华宏,等.红叶石楠硬枝水培生根试验[J].浙江林学院学报,2004,21(1):28-32.
[10]许智宏,刘春明.植物发育的分子机理 [M].北京:北京科技出版社,1999.
[11]蒋泽平,梁珍海,吴纲,等.秤锤树的组织培养和快速繁殖[J].植物生理学通讯,2005,41(2):191.
[12]潘国才,娄汉平,吴丽敏,等.辽东楤木组织培养快繁技术[J].现代农业,2009(4):70-71.
[13]张小红,陈彦生,康冰,等.激素对香椿腋芽增殖生长的效应 [J].西北植物学报,2001,21(4):756-760.
[14]祖元刚,于景华,唐中华,等.植物叶片愈伤组织形成的可能机制 [J].植物研究,2005,25(1):1-2.

