1型糖尿病种HLA-DQA1-DQB1连锁基因的特征研究
朱亚
河南省商丘市第一人民医院内分泌科,河南商丘 476100
目前科学认为糖尿病是由几种基因受损所造成的。1型糖尿病是人类第六对染色体短臂上的HLA-D基因损伤,2型糖尿病是胰岛素基因、胰岛素受体基因、葡萄糖溶酶基因和线粒体基因损伤[1]。总之,不管哪种类型的糖尿病,也不论是因为遗传易感而发病,还是环境因素、病毒感染发病,归根结底都是基因受损所致。换言之糖尿病是一种基因病。胰岛素依赖型糖尿病(IDDM)与HLA关联,非胰岛素依赖型糖尿病(NIDDM)则否[2]。然而在成人缓慢进展型糖尿病中有一部分是胰岛素依赖的,因此,研究其发病机制,对该病的治疗和预后有重要意义。
1 资料与方法
1.1 一般资料
根据2002年2月~2009年10月收治按国际糖尿病诊断标准确诊的SPIDDM患者102例和FPIDDM患者130例。SPIDDM组患者中,男44例,女58例;发病年龄20~67岁,平均(39.6±11.2)岁;发病时平均空腹 C 肽值为(1.5±1.2) μg/L,餐后 1 h C 肽值为 (2.90±2.15) μg/L;FPIDDM 组患者中,男78 例,女 52 例;发病年龄 0.1~19.0 岁,平均(12.5±6.8)岁;发病时的平均空腹C肽值为(0.4±0.3)μg/L,餐后1 h C肽值为(0.6±0.6)μg/L。两组一般情况、糖代谢、胰岛功能和胰岛自身抗体比较,见表1~2。
1.2 方法
基因组DNA提取用盐析法。HLA-DRB1、DQA1、DQB1、DPB1基因分型用PCR/SSP扩增按文献报道进行,所用序列特异性引物(SSP)见参考文献[3-4],由北医大人民医院中心实验室合成(备索)。TAP基因分型用双探针DNA杂交法。两组比较用国际通用方法,计算相对风险及P值。
1.3 统计学方法
数据由SPSS 13.5软件包进行统计学处理,应用χ2检验或t检验,P值用试验系统所对比的等位基因数校正(P c),用相对危险度(RR)表示疾病与遗传标志之间的统计学上的关联强度,P<0.05为差异有统计学意义。
2 结果
HLA-DQA1*0301-DQB1*0201和DQA1*0501-DQB1*0201连锁基因单倍体与 SPIDDM(Pc<0.001)和 FPIDDM(Pc<0.001)均呈显著正相关。DQA1*0301-DQB1*0201基因连锁频率在FPIDDM中的增高比在SPIDDM中增高更明显,二者相比差异有统计学意义(Pc<0.05);提示其对FPIDDM的易感性更强。HLA-DQA1*0301-DQB1*0301和 DQA1*0301-DQB1*0602连锁基因单倍体与SPIDDM呈显著正相关(Pc<0.001),而与FPIDDM 无相关性。HLA-DQA1*0301-DQB1*0302、DQA1*0301-DQB1*0303连锁基因单倍体与FPIDDM呈显著正相关(均P c<0.05),而与SPIDDM无相关性。见表3。
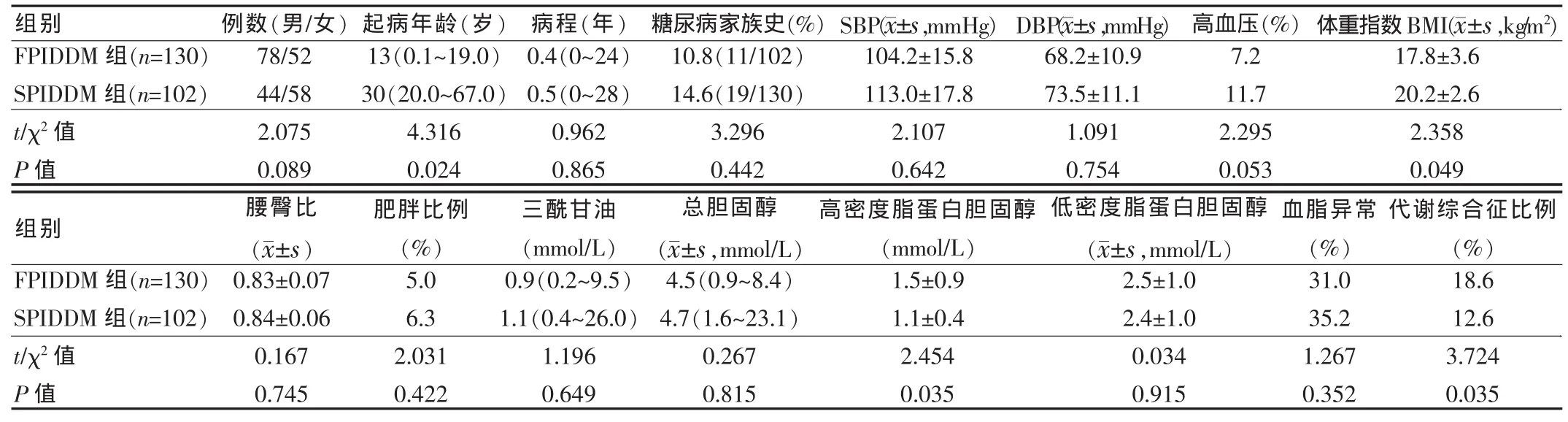
表1 两组一般情况比较Tab.1 Comparison of the general information in the two groups
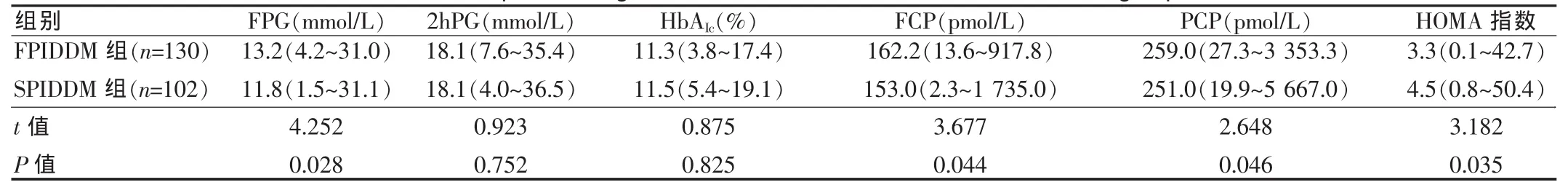
表2 两组患者糖代谢和胰岛功能比较Tab.2 Comparison of glucose metabolism and insulin function in two groups
3 讨论
糖尿病分子病因学研究涵盖遗传学、免疫学、胰岛素抵抗和胰岛β细胞功能等方面的研究,其中遗传学研究包括单基因突变及其功能学分析、家系连锁分析、群体关联分析、转录因子和蛋白激酶基因变异等[3]。免疫学研究包括自身免疫反应,如淋巴细胞功能、细胞因子和炎症因子在糖尿病进程中所起的作用等[4]。胰岛素抵抗研究包括缺乏活动、饮食不节引起肥胖、脂肪肝并导致胰岛素敏感性下降及在此基础上胰岛素信号转导通路发生改变等;胰岛B细胞功能研究则包括寻找新的干预手段来阻止或延缓B细胞功能的衰退等[5]。群体和家系分析表明,1型糖尿病是多基因遗传病,易感性十分复杂,它的发生是散布于整个基因组的多个位点上等位基因间相互作用的结果[6]。由于牵涉到多个基因,环境因子变异广,缺乏清晰的遗传模型,以及存在遗传异质性因而发现易感基因很难。1型糖尿病又是一种自身免疫性疾病,由于某些环境因素引发了机体慢性自身免疫反应,致敏的淋巴细胞对胰岛β细胞产生抗体,并分泌一系列的细胞因子攻击胰岛β细胞,使之发生破坏并迅速发生功能衰竭[7]。本研究结果显示SPIDDM和FPIDDM有其共同的易感性连锁基因,HLA-DQA1*0301-DQB1*0201HLADQA1*0501-DQB1*0201,也有不同的易感性连锁基因,如HLA-DQA1*0301-DQB1*0301和DQA1*0301-DQB1*0602连锁基因与SPIDDM的易感性有关,而HLA-DQA1*0301-DQB1*0302和DQA1*0301-DQB1*0303与FPIDDM的易感性有关。相关研究[8]对黑人、白人和日本人三个不同民族的1型糖尿病与HLA-DQ基因的相关性研究结果也提示,HLA-DQA1*0301-DQB1*0302和DQA1*0501-DQB1*0201与三个不同民族的1型糖尿病易感性是一致的。由此可见,HLA-DQA1-DQB1基因的连锁不平衡在不同民族间既有共同点,又有种族差异。此外,DRB1*0301-DQA1*0301-DQB1*0201连锁基因与FPIDDM高度易感,这种基因连锁不平衡与FPIDDM的的易感性可能与基因的累加效应有关。
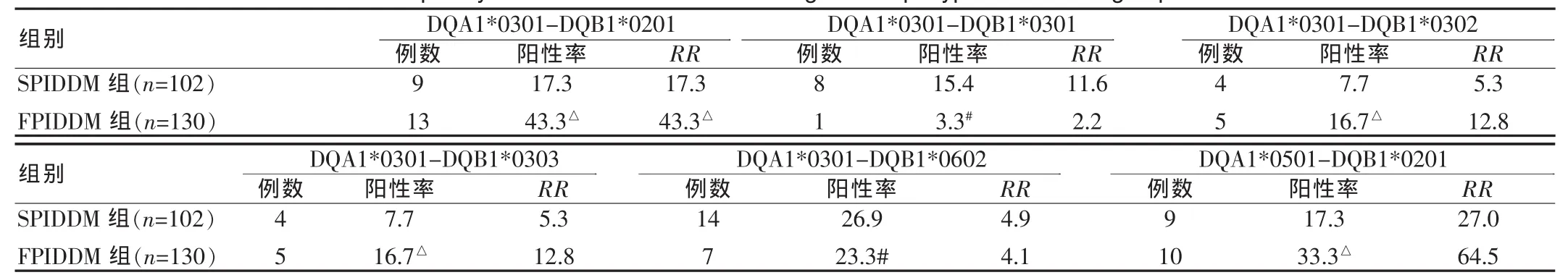
表3 HLA-DQA1-DQB1连锁基因单倍体在两组糖尿病患者中的频率Tab.3 The frequency of HLA-DQA1-DQB1 linked genes haplotypes in the two groups of diabetes
自Todd(1987)提出DQB链57位非门冬氨酸为易感因子后,认为DQA链上52位若为精氨酸也是高风险者。本组研究表明,成人迟发型IDDM主要关联基因位于DQA链,其52位为精氨酸时具有高风险性,若加上DQB链57位为非门冬氨酸,则风险增大,并导致发病提前[9]。HLA与IDDM的关联随年龄增长而减弱,说明在成人IDDM中有一部分患者可能是NIDDM而被误诊为IDDM,因而有必要对成人IDDM患者进行HLA第二类基因的检测[10]。最强的保护基因是DQB1*0602,其次为DQA1*0102和DRB1*1501。从DQ分子看也符合著名的DQB链57位门冬氨酸和DQA链52位非门冬氨酸为安全因素的规律[11]。
总之,成人SPIDDM和FPIDDM虽然具有共同的发病机制,即均由免疫因素引起的β细胞破坏所致,但其HLA表型并不完全相同,不同的HLA-DR-DQ基因连锁不平衡可能是1型糖尿病患者起病方式和病情进展有所不同的因素之一[12]。临床上对SPIDDM的早期识别具有重要意义,免疫干预治疗或早期使用胰岛素治疗可抑制免疫原表达、维持残存胰岛β细胞的修复与再生。因此,联合采用免疫学及遗传学方法早期识别SPIDDM患者并给予适当治疗,对于减轻、延缓或预防发病,尤其对于延缓并发症的出现都将十分有利。
[1]廖琳,周新丽,赵家军.肠道病毒感染与1型糖尿病[J].国外医学:内分泌学分册,2004,24(1):12-14.
[2]李慧敏,缪珩.维生素D与1型糖尿病[J].国外医学:内分泌学分册,2004,24(1):7-8.
[3]李平,朱大龙.CD38与糖尿病[J].国外医学:内分泌学分册,2004,24(1):15-16.[4]沙悦.胰岛自身抗体与1型糖尿病[J].国外医学:内分泌学分册,2001,21(3):116-119.
[5]邢万架,张胜兰.1型DMHLA-DPBIDQBI基因与其自身抗体相关性研究[J].中华内分泌代谢杂志,2001,17(6):338-340.
[6]徐宽枫,徐萍,张梅,等.三种胰岛自身抗体联合检测对1型糖尿病早期诊断的意义[J].南京医科大学学报,2006,26(8):623-626.
[7]王忠诚,曾祝伦,李泉.三种血清抗体联合检测1型糖尿病的预报价值[J].中华检验医学杂志,2002,25(3):223-225.
[8]Brownsey RW,Boone AN,Elliott JE,et al.Regulation of acetyl-CoA carboxylase[J].Biochem Soc Trans,2006,34(Pt 2):223-227.
[9]Targonsky ED,Dai F,Koshkin V,et al.Alpha-lipoic acid regulates AMP-activated protein kinase and inhibits insulin secretion from beta cells[J].Diabetologia,2006,49(7):1587-1598.
[10]Kusunoki J,Kanatani A,Moller DE,et al.Modulation of fatty acid metabolism as a potential approach to the treatment of obesity and the metabolic syndrome[J].Endocrine,2006,29(11):91-100.
[11]Roepstorff C,Halberg N,Hillig T,et al.Malonyl-CoA and carnitine in regulation of fat oxidation in human skeletal muscle during exercise[J].Am JPhysiol Endocrinol Metab,2005,288(3):E133-E142.
[12]Chen ZP,Stephens TJ,Murthy S,et al.Effect of exercise intensity on skeletal muscle AMPK signaling in humans [J].Diabetes,2003,52(5):2205-2212.

