地塞米松致胃肠机能紊乱的动物实验研究
杨 威,应 军,肖百全,黄远铿,欧慧瑜,梁惠婵
(广州医药工业研究院,广东广州 510240)
糖皮质激素是治疗内科许多疾病的常用药物之一,但长期、大剂量使用糖皮质激素可引起各种严重的不良反应和并发症。为了临床正确而合理的使用糖皮质激素,目前常以中药与糖皮质激素联合应用减轻其各种不良反应,因此进行相应实验病理模型的建立就显得尤为重要。有关糖皮质激素的实验病理模型主要有:垂体—下丘脑——肾上腺—胸腺(HPAT)轴功能受抑模型[1]、糖皮质激素致免疫力低下模型[2]、糖皮质激素致骨质疏松模型[3],而对糖皮质激素导致的胃肠道功能紊乱的疾病模型及其作用机制却鲜有报导。本文通过不同给药途径和剂量的地塞米松(dexamethasone,DM)对大鼠胃分泌功能及小鼠胃肠运动功能的实验研究,建立胃肠道功能紊乱的模型及药物治疗后的可逆性改变,为防治糖皮质激素导致的胃肠道不良反应提供参考。
1 仪器与材料
SD大鼠(SPF级,体质量180~220 g,♂♀各半,合格证号:0022747),NIH小鼠(SPF级,体质量:18~22 g,♂♀各半,合格证号:0022586),动物均购自广东省医学实验动物中心,实验动物生产许可证:SCXK(粤):2003-0002。
地塞米松片(广东华南药业有限公司,批号:051201,规格:0.75 mg/片);地塞米松注射液(天津药业集团新郑股份有限公司,批号:0602212,规格:5 mg/1 ml/支);阿利新蓝(Serva产品,广州市博理生物科技有限公司分装);胃蛋白酶试剂盒(南京建成生物工程研究所);葡聚糖蓝-2000(批号:17-0360-01;规格:10g/瓶;Amersham Biosciences 公司);知柏地黄丸:河南省宛西制药股份有限公司,批号:060207;三九胃泰颗粒,三九医药股份有限公司,批号0604132H。
电子天平(BS400S-WEI,北京赛多利斯仪器系统有限公司);可见-紫外分光光度计(TU-1901,北京普析通用公司);电子天平(BS224S,北京赛多利斯仪器系统有限公司);恒温水浴箱(HH.W21.CU600,上海医疗器械七厂);数字pH计(PHS-2F,上海精密学仪器有限公司)。
2 方法
2.1地塞米松致小鼠胃肠道功能紊乱模型胃排空、肠推进的影响昆明种小鼠50只,随机分为5组,对照组,ig 0.5 mg·kg-1地塞米松剂量组、ig 1.0 mg·kg-1地塞米松剂量组、sc 0.5 mg·kg-1地塞米松剂量组、sc 1.0 mg·kg-1地塞米松剂量组,造模5 d。末次给药前动物禁食24 h,给药1 h后,每鼠灌胃 20 g·L-1的葡聚糖蓝 -2000 0.4 ml,20 min后脱颈处死动物,剖腹取全胃肠,自幽门括约肌处取胃,沿胃大弯侧剪开,用4 ml去离子水中将胃内色素残留物充分洗涤,以3 500r·min-1离心15 min,取上清液,用紫外分光光度计在波长620 nm测吸光度以此反映胃内残留色素残留量。以正常对照组均值为100%,其余各组均值与空白对照组之百分比为相对胃内色素残留率。同时迅速剪取小肠,量取幽门括约肌至色素最前沿的距离作为色素在小肠内推进距离;从幽门括约肌至回盲部的总长度作为“小肠总长度”,以两者之比计算出小肠推进率(%)。

2.2地塞米松致大鼠胃肠道功能紊乱模型胃分泌功能的影响SD大鼠50只,随机均衡分为5组,对照组、ig 0.6 mg·kg-1地塞米松剂量组、ig 1.20 mg·kg-1地塞米松剂量组、sc 0.45 mg·kg-1地塞米松剂量组、sc 0.9 mg·kg-1地塞米松剂量组。连续给药8 d,于末次给药前隔离,禁食不禁水24 h,d 8行幽门结扎手术,sc组结扎幽门前皮下注射给药,ig组采用十二指肠给药。术后6 h,处死动物,结扎贲门,取胃,量取胃液体积。然后观察胃黏膜有无充血、溃疡等症状,再测胃壁结合黏液量。胃液以1 500 r·min-1离心10 min,取上清液,先用酸度计测胃内容物pH值,再取1 ml与0.5 ml胃液分别测胃总酸、胃蛋白酶。
2.3知柏地黄丸和三九胃泰对地塞米松抑制小鼠胃肠道运动的影响48只小鼠,♀、♂各半,20~22g,随机分为4组:空白对照组、地塞米松模型组、知柏地黄丸组(3.75 g·kg-1)、三九胃泰组(15.0 g·kg-1)。各组给药0.5 h 后灌胃给予地塞米松混悬液1.0mg·kg-1(空白组给予等量的1.0%CMC-Na),连续给药5 d后小鼠禁食24 h,末次给药及给予地塞米松1 h(空白组除外)后,灌胃给予2%葡聚糖蓝0.4 ml/只,20 min后处死动物,迅速剖腹取胃,沿胃大弯侧剪开,用4 ml去离子水将胃内容物充分洗出,离心取上清液,用紫外分光光度计在波长620 nm测吸光度,测算胃内色素(葡聚糖蓝-2000)残留量(以空白对照组均值为100%,其余各组均值与空白对照组均值之百分比为相对胃内色素残留率)。同时迅速剪取小肠,自然拉直,量取幽门括约肌至色素最前沿的距离作为色素在小肠内推进距离;从幽门括约肌至回盲部的总长度作为小肠总长度,计算小肠推进率(%)。
2.4知柏地黄丸和三九胃泰对地塞米松引起的大鼠胃液、胃蛋白酶和胃酸、胃壁结合黏液量改变的影响SD大鼠46只,♀、♂各半,150~180 g,按体重随机分为4组:空白对照组、地塞米松模型组、知柏地黄丸组(2.40 g·kg-1)、三九胃泰组(10.0 g·kg-1)。各给药组给药0.5 h后灌胃给予地塞米松混悬液(1.2 mg·kg-1)(空白组给予等量的 1.0%CMC-Na),连续7 d,动物禁食24h后麻醉动物,开腹结扎幽门后,立即由十二指肠再给药1次,然后缝合腹壁。术后6 h,处死动物,开腹结扎贲门,摘取全胃,量取胃液体积。用数字pH计测胃内容物pH值后,离心取上清胃液,检测胃蛋白酶活力[4],方法参照胃蛋白酶活力测试盒说明书。另取出鼠胃,滤纸吸干表面水分,沿胃大弯剪开鼠胃,将胃黏膜外翻,用生理盐水清洗2次,再将胃浸泡于30 ml阿利新蓝溶液中,于25℃温化孵育2 h后取出鼠胃,反应液离心后取上清液于分光光度计615 nm波长处比色测定吸光度,按公式:6×(1-实测光密度/标准管光密度),计算每只鼠胃壁黏液结合黏液量。
2.5数据统计分析数据处理用单因素方差分析法(ANOVA),数据表示为±s。所有数据间的差异显著性分析用SPSS 1110软件中Dunnett'st检验进行处理。
3 结果
3.1地塞米松对小鼠胃排空、肠推进的影响结果表明(见Tab 1),与正常组比较,灌胃及皮下注射地塞米松均能不同程度地降低小鼠的小肠推进率(P<0.01或0.05),增加胃内相对色素残留率(P<0.01或0.05),并有一定的量效关系。以上结果表明地塞米松有减缓胃肠道运动的作用,并以地塞米松灌胃1.0 mg·kg-1组的作用明显。
Tab 1 Effect of dexamethasone on intestinal motility and gastric emptying of mice(±s,n=10)

Tab 1 Effect of dexamethasone on intestinal motility and gastric emptying of mice(±s,n=10)
*P <0.05,**P <0.01 vs normal
Group Dose/mg·kg-1 Small intestinal propulsion rate/%Relative residue rate of intragastric dye/%Normal - 61.3 ±13.9 100.00 ±28.75 DM(ig)0.5 43.3 ±11.3* 167.34 ±97.40**DM(ig)1.0 38.5 ±11.0** 209.22 ±68.85**DM(sc)0.5 49.7 ±6.3* 164.67 ±54.43**DM(sc)1.0 52.3 ±7.1 168.73 ±44.21**
3.2地塞米松对大鼠胃分泌功能及胃黏膜的影响
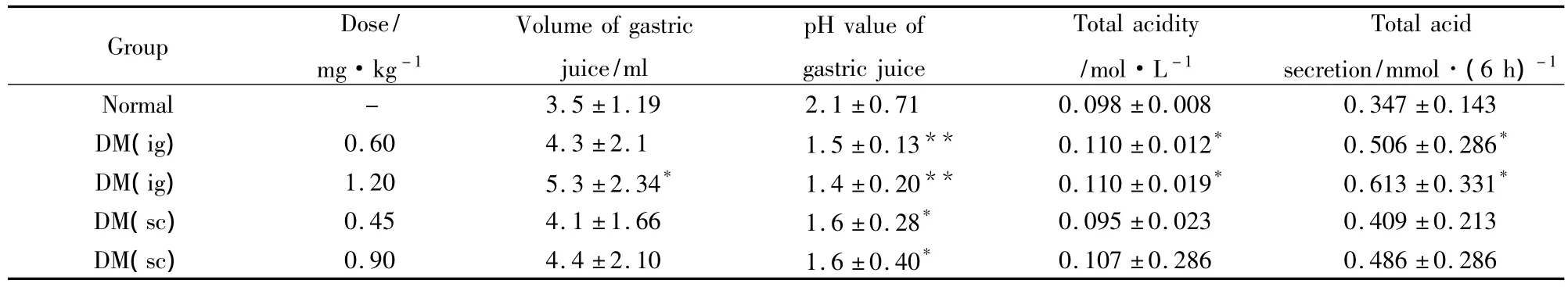
3.2.1地塞米松对大鼠胃液量、胃液pH值、胃总酸浓度、胃总酸分泌量的影响结果(Tab 2)表明:与正常组比较,地塞米松给药8 d后各剂量组的胃液量增加,胃液pH值减小,总酸度增加,总酸分泌量增加,其中地塞米松灌胃1.2 mg·kg-1组的胃酸的影响最为明显(P<0.05或0.01)。
3.2.2地塞米松对大鼠胃蛋白酶及胃壁结合黏液量的影响结果(Tab 3)表明:与正常组比较,灌胃地塞米松1.2 mg·kg-1组的胃蛋白酶明显增加(P<0.01),皮下注射地塞米松0.90 mg·kg-1组胃蛋白酶亦有增加的趋势(P>0.05);与正常组比较,地塞米松各剂量除灌胃0.45 mg·kg-1组外,其余各组均能降低胃壁结合黏液量(P<0.05),从而增加了对胃黏膜屏障的损伤;其中地塞米松灌胃1.2 mg·kg-1组对大鼠胃蛋白酶及胃壁结合黏液量的影响最为明显。
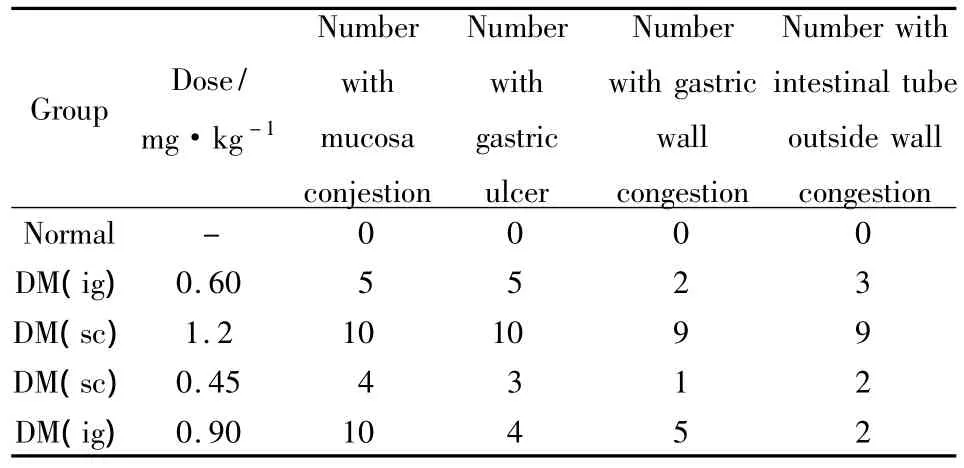
3.2.3动物解剖肉眼观察结果动物处死后取胃解剖后肉眼观察结果表明与正常组比较,模型组不同程度的出现肠管外壁充血、胃壁充血、胃黏膜充血、胃溃疡的现象(Tab 4),其中以ig组引起的胃肠道病变症状比sc组更为严重,ig组又以1.2 mg·kg-1组病变最明显,达100%。
Tab 2 Effect of dexamethasone on gastric acid of rats(±s,n=10)
Tab 2 Effect of dexamethasone on gastric acid of rats(±s,n=10)
*P <0.05,**P <0.01 vs normal
Group Dose/mg·kg-1 Volume of gastric juice/ml pH value of gastric juice Total acidity/mol·L-1 Total acid secretion/mmol·(6 h)-1 Normal - 3.5 ±1.19 2.1 ±0.71 0.098 ±0.008 0.347 0.107 ±0.286 0.486 ±0.286±0.143 DM(ig)0.60 4.3 ±2.1 1.5 ±0.13** 0.110 ±0.012* 0.506 ±0.286*DM(ig)1.20 5.3 ±2.34* 1.4 ±0.20** 0.110 ±0.019* 0.613 ±0.331*DM(sc)0.45 4.1 ±1.66 1.6 ±0.28* 0.095 ±0.023 0.409 ±0.213 DM(sc)0.90 4.4 ±2.10 1.6 ±0.40*
Tab 3 Effect of dexamethasone on gastric pepsin activity of rats(±s,n=10)

Tab 3 Effect of dexamethasone on gastric pepsin activity of rats(±s,n=10)
*P <0.05,**P <0.01 vs normal
Group Dose/mg·kg-1 Gastric pepsin activity/U Amount of gastric wall binding mucus/mg Normal - 56.67 ±6.26 3.829 ±0.669 DM(ig)0.60 55.35 ±13.56 2.905 ±1.146*DM(ig)1.2 67.24 ±6.21** 3.025 ±0.67*DM(sc)0.45 40.01 ±13.50 3.564 ±0.548 DM(sc)0.90 59.18 ±9.89 2.886 ±0.963*
Tab 4 Pathological findings of dexamethasone on observation with an unaided eye in rats(n=10)
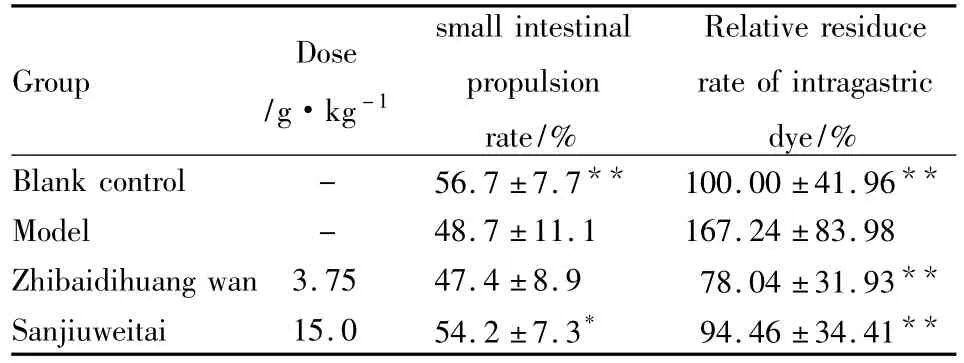
3.3知柏地黄丸和三九胃泰对地塞米松抑制小鼠胃肠道运动的影响结果(Tab 5)表明:与空白对照组相比,模型组小鼠肠推进率明显降低,胃相对残留率明显增加(P<0.01);与模型组比较,知柏地黄丸、三九胃泰组胃相对残留率明显降低(P<0.01),低于空白对照组,但知柏地黄丸组肠推进率无明显改变,三九胃泰组肠推进率却明显高于模型组(P<0.05)。提示三九胃泰能改善地塞米松诱发的小鼠胃肠道运动紊乱,抑制地塞米松导致的损伤。
Tab 5 Effect of Zhibodihuangwan and Sanjiuweitai on intestinal motility and gastric emptying of mice(±s,n=12)
Tab 5 Effect of Zhibodihuangwan and Sanjiuweitai on intestinal motility and gastric emptying of mice(±s,n=12)
*P <0.05,**P <0.01 vs model group
Group Dose/g·kg-1 Relative residuce rate of intragastric dye/%Blank control - 56.7 ±7.7** 100.00 ±41.96 small intestinal propulsion rate/%**Model - 48.7 ±11.1 167.24 ±83.98 Zhibaidihuang wan 3.75 47.4 ±8.9 78.04 ±31.93**Sanjiuweitai 15.0 54.2 ±7.3* 94.46 ±34.41**
3.4知柏地黄丸和三九胃泰对地塞米松引起的大鼠胃液、胃蛋白酶和胃酸、胃壁结合黏液量改变的影响结果(Tab 6)表明:与空白组相比,模型组胃液量增加(P<0.05),胃蛋白酶活力明显升高(P<0.01),胃液pH值、胃壁结合黏液量明显减少(P<0.01);与模型对照组相比,知柏地黄丸组胃液pH值明显升高(P< 0.01),胃液量明显降低(P< 0.05),胃蛋白酶活力具有降低趋势,胃壁结合黏液量具有升高趋势,但未见统计学意义;与模型对照组相比,三九胃泰组胃液量明显降低(P< 0.05),胃液pH值明显升高(P< 0.01),胃蛋白酶活力明显降低(P<0.01),胃壁结合黏液量明显增加(P<0.05),提示三九胃泰能改善地塞米松引起的大鼠胃液、胃蛋白酶和胃酸、胃壁结合黏液量的改变,抑制地塞米松导致的损伤。
4 讨论
文献报道[5]:长期超生理剂量或大剂量使用糖皮质激素常见食后恶心、嗳气、腹胀、上腹疼痛等消化系统机能紊乱症状,严重者可出现溃疡、肠道出血及穿孔,然而利用地塞米松制备胃肠道功能紊乱的动物模型却未见报道。随着抗糖皮质激素不良反应药物的研发,多方面探讨糖皮质激素诱发的疾病模型显得非常有意义,笔者针对胃肠道紊乱这一病变制备了地塞米松致大、小鼠胃肠道功能紊乱模型。考虑到中药在抗糖皮质激素不良反应方面具有显著地优势,因此选择了多次给药来制备该模型,以利于评价中药的药效。
文献报道[4-5]糖皮质激素诱发溃疡的机制是:①刺激胃酸和胃蛋白酶的分泌,胃酸分泌增多;②抑制黏液的分泌,并使胃壁各层变薄甚至萎缩;③阻碍组织修复。本研究以SPF级大、小鼠为研究对象,由本研究的实验结果可知:与正常组相比,给予地塞米松后小鼠胃肠运动被抑制、大鼠胃蛋白酶活力增加、胃液pH值降低、胃壁结合黏液量降低,提示本研究成功制作了地塞米松致大、小鼠胃肠机能紊乱的实验模型。
在本研究前进行的预试研究中,给SD大鼠灌胃和皮下注射给予地塞米松组2.0 mg·kg-1,在d 4开始就会出现SD大鼠死亡;给昆明种小鼠灌胃和皮下注射给予地塞米松组2.0 mg·kg-1,在停药d 2即发现部分小鼠死亡,因此未对此剂量进行相关指标的检测研究。综合本研究结果,可以认为在地塞米松导致大、小鼠胃肠道功能紊乱的试验研究中,均以灌胃高剂量的造模效果显著。因此,在本实验条件下,建立较为理想的糖皮质激素导致胃肠道功能紊乱的模型用地塞米松的剂量和时间为:大鼠以地塞米松1.2 mg·kg-1连续灌胃 8 d,小鼠以 1.0 mg·kg-1连续灌胃 5 d。
Tab 6 Effect of Zhibodihuangwan and Sanjiuweitai on gastric acid and gastric pepsin activity of rats(±s)

Tab 6 Effect of Zhibodihuangwan and Sanjiuweitai on gastric acid and gastric pepsin activity of rats(±s)
*P <0.05,**P <0.01 vs model
Group Dose/g·kg-1 n volume of gastric juice/ml Amount of gastric wall binding mucus/mg Blank control - 13 3.4 ±1.4* 2.12 ±0.74** 54.68 ±18.60** 3.81 ±0.70 pH value of gastric juice Gastric pepsin activity/U**Model - 13 5.3 ±2.1 1.52 ±0.31 71.22 ±14.0 3.00 ±0.75 Zhibaidihuang 2.40 10 4.1 ±2.2* 2.20 ±0.65** 65.62 ±17.75 3.35 ±0.81 Sanjiuweitai 10.0 10 3.9 ±1.8* 2.14 ±0.94** 52.13 ±19.23** 3.64 ±0.61*
为了验证制备的模型,笔者从糖皮质激素副作用特点考虑,选择了知柏地黄丸和三九胃泰研究对制备模型(大鼠以地塞米松 1.2 mg·kg-1连续灌胃 8 d,小鼠以 1.0 mg·kg-1连续灌胃5 d)的治疗作用,研究结果表明三九胃泰能改善地塞米松诱发的小鼠胃肠道运动紊乱,能改善地塞米松引起的大鼠胃液、胃蛋白酶和胃酸、胃壁结合黏液量的改变,从而抑制地塞米松导致的胃肠功能紊乱,知柏地黄丸只能部分改善,效果弱于三九胃泰。这一研究结果提示地塞米松诱发的大小鼠胃肠机能紊乱用适当的药物是可以逆转的。
综上所述,笔者认为建立较为理想的糖皮质激素导致胃肠道功能紊乱的模型用地塞米松的剂量和时间为:大鼠以地塞米松 1.2 mg·kg-1连续灌胃 8 d,小鼠以 1.0 mg·kg-1连续灌胃5 d;这些损伤用适当的药物是可以逆转的,该模型可以在防治糖皮质激素不良反应和胃肠机能紊乱研究中推广应用。
[1]蔡定芳,沈时谋.仙灵脾减轻外源性糖皮质激素抑制神经内分泌免疫作用的临床与实验研究[J].中西医结合杂志,1998,18(1):4-7.
[1]Cai D F,Shen S M.Clinical and experimental research of epimedium brevicornum in relieving neuroendocrtno-immunologica effect inhibited by exogenous glucoeortieoid[J].J Integr Chin Tradit West Med,1998,18(1):4-7.
[2]王静凤,李晓林,滕来宾,等.海参虫草复剂对免疫功能低下小鼠的免疫调节作用[J].卫生研究,2011(2):82-5.
[2]Wang J F,Li X L,Teng L B,et al.Immunomodulatory effects of a mixture of apostichopus japonicus and cordyceps militaris on immunocompromized mice[J].J Hygiene Res,2011(2):82-5.
[3]李卫平,张 艳,明 亮,等.糖皮质激素诱导骨质疏松大鼠模型研究[J].中国药理学通报,1998,14(5):475-6.
[3]Li W P,Zhang Y,Ming L,et al.Glucocorticoid induced osteoporosis on rat[J].Chin Pharmacol Bull,1998,14(5):475-6.
[4]叶震世,任建林.胃黏膜屏障与胃黏膜保护的研究进展[J].世界华人消化杂志,2005,13(21):2478-81.
[4]Ye Z S,Ren J L.Protection of gastric mucosa and gastric mucosal barrier progress[J].World Chin J Digestol,2005,13(21):2478-81.
[5]黄 炎.长期应用糖皮质激素的毒副作用[J].中华实用儿科杂志,2000,15(1):15-7.
[5]Huang Y.Side effects of long-term using Glucocorticoid[J].Chin J Pract Pediatr,2000,15(1):15-7.
[6]张维溪,戴 欢,贺孝良,等.糖皮质激索调控哮喘大鼠气道重塑中TGF-β1/Smad信号通路的研究[J].中国药理学通报,2009,25(9):1142-6.
[6]Zhang W X,Dai H,He X L,et al.Effects of glucocorticoids on TGF-β1 Smad signal pathway in airway remodeling of asthma rats[J].Chin Pharmacol Bull,2009,25(9):1142-6.
[7]Schäcke H,Döcke W D,Asadullah K.Mechanisms involved in the side effects of glucocorticoids[J].Pharmacol Ther,2002,96(1):23-43.
[8]Di Fazano C S,Messica O,Quennesson S,et al.Two new cases of glucocorticoid-induced pancreatitis[J].Rev Rheum Engl Ed,1999,66(4):235.

