七氟烷预处理对成年及幼年大鼠心肌缺血/再灌注损伤保护作用的对比研究
张 珺,刘金东,2
(1.江苏省麻醉与镇痛应用技术重点实验室,江苏省麻醉学重点实验室;2.徐州医学院附属麻醉科,江苏徐州 221002)
心肌缺血/再灌注(ischemia-reperfusion,I/R)损伤是指局部组织或器官缺血后,再次恢复血供后,在随后的一定时间内组织或器官的损伤不仅不会减轻,反而加重。此现象在临床上较为常见。1986年Murry首次描述缺血预处理即多次短暂性的心肌I/R,能够明显增强心肌对较长时间持续损伤的耐受能力[1],但这种预处理需中断器官供血,有驳于医学伦理学。近年来发现一些麻醉药物预处理(APC)也能减轻心肌缺血/再灌注损伤。其机制与缺血预处理也有相似之处,都是通过多种信号通路发挥心肌保护作用[2]。其中,磷脂酰肌醇-3-激酶-丝氨酸/苏氨酸激酶(PI3K-Akt)通路在经过各种处理后予以激活,并发挥心肌保护作用。
随着先天性心脏病患儿的增加以及外科手术的发展,幼儿围手术期心肌保护措施显得尤为重要。据报道吸入麻醉药氟烷、异氟烷、地氟烷以及七氟烷能够起到心肌保护作用,减轻成熟心肌缺血/再灌注损伤[3-4]。但尚未见有关七氟烷预处理幼年心肌的报道。故本文采用成年及21~28 d幼龄Sprague Dawley(SD)大鼠离体心脏Langendorff模型,来探究七氟烷预处理对成年与幼年心肌缺血/再灌注损伤影响的比较以及PI3K/Akt信号通路在七氟烷预处理中的作用。
1 材料与方法
1.1药品及试剂七氟烷(上海恒瑞医药有限公司);TUNEL试剂盒(Roche);氯化三苯基四氮唑(Sigma);兔抗磷酸化 Akt(Ser473)多克隆抗体(Cell Signaling);山羊抗 Akt多克隆抗体(Santa Cruz);小鼠抗β-actin单克隆抗体(中杉金桥生物公司);碱性磷酸酯酶标记山羊抗兔 IgG、碱性磷酸酯酶标记兔抗山羊IgG、碱性磷酸脂酶标记马抗小鼠IgG(中杉金桥生物公司);SDS-PAGE蛋白上样缓冲液、SDS-PAGE凝胶配制试剂盒、BCIP/NBT碱性磷酸脂酶显色试剂盒(江苏碧云天生物技术研究所);乳酸脱氢酶(LDH)测试盒(南京建成生物工程研究所)。
1.2仪器Langendorff灌注模型(Radnoti);MP100生物信号采集系统(BIOPAC Systems);Bx50F4型光学显微镜(Olympus);COOLPIX S1照相机(Nikon)。
1.3实验动物与分组72只♂SD大鼠(由徐州医学院实验动物中心提供,SPF级),其中36只成年♂SD大鼠,体质量230 g~280 g,随机分为3组(n=12,6只用于测定梗死面积,6只用于 TUNEL及Western blot检测):对照组(sham 1组),缺血/再灌注组(I/R 1组),七氟烷预处理组(S 1组);36只幼年♂ SD大鼠,体质量70~90 g,年龄21~28 d,随机分为3组(n=12,6只用于测定梗死面积,6只用于TUNEL及 Western blot检测):对照组(sham 2组),缺血/再灌注组(I/R 2组),七氟烷预处理组(S 2组)。所有的实验均经徐州医学院实验动物福利和应用委员会批准,并遵守国际卫生协会《实验动物福利和应用指南》。
1.4方法
1.4.1Langendorff动物模型的制备SD大鼠腹腔注射20%乌拉坦1 g·kg-1麻醉,肝素钠500 U·kg-1抗凝,进入麻醉状态后开胸取心脏,置于预冷的改良 K-H 液 (mmol· L-1,NaCl 118,KCl 4.7,KH2PO41.2,MgSO41.2,CaCl22.5,NaHCO325,d-Glucose 11.1,pH 7.4,以95%O2和5%CO2混合气体饱和,灌流温度37℃)中,并迅速经主动脉逆行插管悬挂于Langendorff灌流装置上,以改良K-H液进行常规恒压灌流。左心耳处剪开一小口。放入带有小乳胶水囊的测压管经二尖瓣口插入左心室,经MP100生物信号采集系统实时观测并分析左心血流动力学参数:左室发展压(LVDP)、左室压力升高或降低最大速率(±dp/dtmax)、心率(HR)。
1.4.2含2.4%和2.95%七氟烷的灌注液制备含七氟烷K-H液的配制方法参照文献[5],95%O2和5%CO2混合气体通过七氟烷挥发罐(aeonmed vaporizer VP300),使用Datex气体检测仪检测,控制七氟烷浓度为1 MAC,为临床常用浓度,在成年大鼠1 MAC七氟烷的浓度为2.4%,而在3~4周大鼠为2.95%[6]。将含有不同浓度的七氟烷的混合气体通过K-H液,平衡20 min,使K-H液达到饱和。
1.4.3离体心脏实验处理①sham组,持续灌注120 min;②I/R组,37℃平衡30 min后,全心停灌30 min,再灌注 60 min;③S 组,37℃平衡 15 min,续灌不同浓度(成年组,2.4%;幼年组,2.95%)七氟烷的K-H液10 min,洗出5 min,缺血30 min,复灌60 min。
1.4.4心肌梗死面积测定采用 TTC(2,3,5-Triphenyhetrazolium,氯化三苯基四氮唑)染色法[7]测定心肌梗死面积。灌注结束,迅速取下心脏,置于-20℃冰箱内冻后,沿心尖向心底部横向切成1 mm厚度的薄片5~6片,放入1%TTC磷酸盐缓冲液中(pH=7.4),37℃水浴箱中闭光孵育15~20 min,存活心肌组织呈砖红色,而梗死心肌呈现灰白色。10%甲醛液固定。应用Imagemaster VDS图像分析仪分析心肌梗死面积占心肌总面积百分比。心肌梗死面积百分比(MIS%)=(心肌梗死面积之和/心肌总面积之和)×100%。
1.4.5TUNEL法检测心肌细胞凋亡以及凋亡指数(AI)的计算采用末端缺口标记技术(terminal deoxynucleotidyltransferase-mddiated Dutp nick end labeling,TUNEL)测定凋亡细胞。再灌注末迅速取下心脏,切取心尖部分心肌,4%甲醛固定过夜,常规石蜡切片,按 TUNEL试剂盒(Roche,德国)说明书行DNA原位末端缺口标记染色。阴性对照用试剂盒内TUNEL阴性对照试剂,凋亡细胞的细胞核被染成棕黄色或棕褐色,正常心肌的细胞核被复染成深蓝色。在高倍镜下(×400)观察,于凋亡阳性区域随机选择10个视野,计数凋亡阳性细胞,以凋亡指数反映各组心肌凋亡情况,凋亡指数(apoptotic index,AI)=(视野内凋亡细胞个数/视野内所有心肌细胞个数)×100%。
1.4.6Western blot法半定量测p-Akt以及总Akt再灌注15 min后取左心室心肌组织100 mg,迅速液氮冷冻,-80℃冰箱保存,标本取齐后,剪碎心肌,加组织裂解液,冰上匀浆,4℃ 12 000×g离心20 min,取上清,Folin 酚法测蛋白,配平,按照每4 μl蛋白样品加入1 μl SDS-PAGE蛋白上样缓冲液(5×)比例混合,煮沸5 min后,将样本载到分离胶为10%的SDS-PAGE凝胶上电泳,电转膜至硝酸纤维素膜上。5%脱脂牛奶封闭3 h,加入一抗(磷酸化Akt,1∶1 000稀释;Akt抗体,1 ∶600 稀释;β-actin,1 ∶500稀释),4℃孵育过夜,TBST冲洗,加入二抗(碱性磷酸酶标记山羊抗兔IgG,1∶500稀释;碱性磷酸酯酶标记兔抗山羊IgG,1∶500;碱性磷酸酯酶标记马抗小鼠IgG,1∶500),室温振荡孵育2 h,TBST冲洗,BCIP/NBT碱性磷酸酯酶显色试剂盒显色。
1.5统计学处理实验数据以±s表示,利用SPSS 16.0统计学软件进行统计学处理。组间比较采用单因素方差分析,两两比较采用q检验,定量资料组内比较采用配对t检验。
2 结果
2.1七氟烷预处理对血流动力学的影响Tab 1显示平衡末心功能指标间差异未见统计学意义(P>0.05)。Tab 2再灌注15 min各组各项心功能指标明显低于基础值(P<0.01),说明再灌注后心功能均减退。无论幼年组或成年组,同I/R组相比,再灌注15 min时S组HR、LVDP、±dp/dtmax明显增强,LVEDP减小,说明1 MAC的七氟烷预处理可分别增强不同年龄组大鼠再灌注心肌的舒缩功能。见Tab 1、2。
Tab 1 Hemodynamics of baseline(±s,n=12)

Tab 1 Hemodynamics of baseline(±s,n=12)
Group HR/beat·min -1 LVDP/kPa LVEDP/kPa +dp/dtmax/kPa·s-1 - dp/dtmax/kPa·s -1 sham1 311 ±22 13.1 ±1.3 0.70 ±0.12 235 ±36 311 ±30 I/R1 305 ±23 13.8 ±1.7 0.72 ±0.10 225 ±25 154 ±16 S1 304 ±28 13.5 ±1.7 0.78 ±0.09 237 ±42 187 ±26 Sham2 305 ±18 14.2 ±1.2 0.83 ±0.08 265 ±19 356 ±26 I/R2 300 ±37 13.6 ±1.6 0.87 ±0.10 268 ±29 182 ±35 S2 294 ±38 14.5 ±1.8 0.86 ±0.07 276 ±26 237 ±24
Tab 2 Hemodynamics 15 min of reperfusion(±s,n=12)

Tab 2 Hemodynamics 15 min of reperfusion(±s,n=12)
△P<0.05,△△P<0.01vs I/R;*P<0.05,**P<0.01 vs sham
Group HR/beat·min -1 LVDP/kPa LVEDP/kPa +dp/dtmax/kPa·s-1 - dp/dtmax/kPa·s -1 Sham1 297±1312.8 ±1.3 0.89 ±0.09 229 ±35 306 ±30 I/R1 185±23** 6.1±1.2** 4.39 ±0.41** 111±9** 160±20**S1 211±16△△ 7.4±0.9△ 3.46 ±0.45△△ 137±194△ 191±25△Sham2 287 ±14 13.8 ±0.7 0.94 ±0.09 256 ±26 339 ±31 I/R2 207±23** 6.4±0.9** 5.49±0.38** 120±12 187±26 S2 248±19△△ 7.9±1.6△ 4.00 ±0.46△△ 143±19△△ 233±33△
2.2七氟烷预处理对梗死面积的影响Fig 1显示再灌60 min后,sham 1组梗死面积为(6±3)%,I/R 1组梗死面积为(54±8)%,与I/R 1组相比,S 1组梗死面积缩小为(30±6)%,差异有统计学意义(P<0.05);同样,sham 2组梗死面积为(9±1)%,I/R 2组梗死面积为(53±10)%,与I/R 1组相比,S 2组梗死面积缩小为(21±6)%,差异有统计学意义(P<0.05)。见 Fig 1,Tab 3。
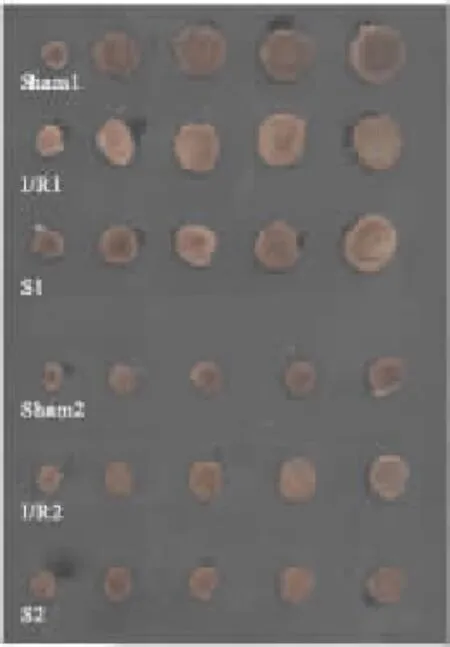
Fig 1 Infarction size were detected by TTC staining at the 60 min of reperfusion(±s,n=6)
2.3七氟烷预处理对心肌细胞凋亡率的影响Fig 2示,TUNEL法标记的心肌凋亡细胞,凋亡阳性细胞核被染成棕黄色或棕褐色,正常细胞被苏木精复染成蓝色。凋亡细胞占视野内计数总细胞的百分数(apoptotic index,AI)为凋亡指数,结果显示:sham 1组、I/R 1组、S 1组以及 sham 2组、I/R 2组、S 2组凋亡率分别为(9±7)%、(38±10)%、(26±9)%以及(11±8)%、(33±9)%、(20±6)%,无论幼年组或成年组,与 I/R相比,S组 AI明显下降(P<0.05)。见 Fig 2,Tab 4。
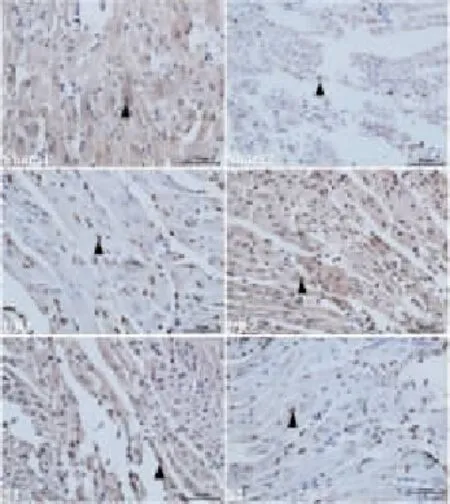
Fig 2 Apoptotic cells of isolate rat hearts in various treatment groups detected by TUNEL at 60 min of reperfusion(×400,bar=50 μm)
Tab 3 Percentage of infarct size(±s,n=6)

Tab 3 Percentage of infarct size(±s,n=6)
△P <0.05,△△P<0.01 vs I/R;*P <0.05,**P <0.01 vs sham
Group IS/%sham1 6±3 I/R1 54±8**S1 30±6△△sham2 9±1 I/R2 53±10**S2 21±6△
Tab 4 Percentage of TUNEL positive cells(±s,n=6)

Tab 4 Percentage of TUNEL positive cells(±s,n=6)
△P <0.05 vs I/R;*P <0.05,**P <0.01 vs sham
Group AI/%Sham1 9.5 ±7 I/R1 38.2 ±10**S1 26.3 ±9△Sham2 11.3 ±8 I/R2 33.2 ±9*S2 20.6 ±6△
Tab 5 Value of p-Akt/Akt over sham(±s,n=6)

Tab 5 Value of p-Akt/Akt over sham(±s,n=6)
△P<0.05,△△P<0.01 vs I/R;*P<0.05 vs sham
Group p-Akt/Akt/%/sham Sham1 1 I/R1 2.03 ±0.35*S1 2.99 ±0.27△△Sham2 1 I/R2 1.88 ±0.6*S2 2.71 ±0.66△
2.4七氟烷预处理对p-Akt表达的影响免疫印迹法半定量p-Akt蛋白表达显示,在幼年组及成年组,与sham组相比,I/R组,S组p-Akt蛋白表达水平明显升高(P<0.05)。且与I/R组相比,S组的p-Akt蛋白表达水平明显升高(P<0.05)。见Fig 3,Tab 5。

Fig 3 Western blot analysis of phospho-Akt(top lane)and total Akt(middle lane)at the 15 min of reperfusion is shown.β-actin(bottom lane)was used to demonstrate equal protein loading
3 讨论
七氟烷是一种新型吸入麻醉药。目前,有研究表明七氟烷处理能产生类似缺血预处理的心肌保护作用[8],具有增加心肌收缩力、减轻缺血/再灌注损伤引起的心肌梗死等多种心血管调节功能。近年来研究发现在心肌缺血/再灌注模型中,缺血前给予30 min的七氟烷预处理较之未处理组可以有效降低17%的梗死面积。七氟烷预处理可以促进NF-κB和Bcl-2蛋白表达,并下调细胞内黏附因子-1和肿瘤凋亡因子-α,最终降低Caspase-3的表达起到降低凋亡的作用[9]。此外七氟烷处理还可以磷酸化5'AMP 活化蛋白激酶(AMPK)[10],还通过干预 β1-肾上腺素受体通路来起到心肌保护作用[11]。近年来,研究发现药物及非药物手段都可以在再灌注之初通过活化磷脂酰肌醇-3-激酶-丝氨酸/苏氨酸激酶(PI3K-Akt)这一共同通路,发挥提高心肌功能和促进细胞存活的重要作用。PI3K-Akt信号通路是参与细胞增殖调控的重要通路,是许多生命活动中的关键信号分子,PI3K-Akt介导的信号通路调节细胞的分裂、分化、凋亡等活动。大量研究证实,部分心肌保护的作用机制最终依赖于Akt活化[12]。七氟烷可以减轻多种原因所导致的心肌损伤,其作用机制需要进一步研究。
然而,大量的研究都仅限于成熟心肌,鲜有对未成熟心肌的麻醉预处理研究。成熟与未成熟心肌在结构、代谢和功能上均存在一定差异[13-14]。所以本实验采用临床最常用的1 MAC七氟烷浓度,1 MAC在成年大鼠七氟烷浓度为2.4%,在3~4周的SD大鼠为 2.95%(1.75% ~3.15%)。通过研究 1 MAC七氟烷预处理成年及幼年大鼠离体心肌后心功能等各项指标的变化来了解七氟烷对成熟和未成熟心肌的保护作用以及此作用与PI3K-Akt信号通路的关系。
本实验发现七氟烷处理后,无论成年组还是幼年组,同缺血/再灌注组相比,HR、LVDP、±dp/dtmax明显增强,LVEDP减小,说明七氟烷预处理可减轻不同年龄组心肌的收缩和舒张功能障碍。心肌梗死面积和细胞凋亡率分别是反映心肌损伤和细胞凋亡的金标准,本实验还发现七氟烷预处理后可以明显减轻各年龄组心肌梗死面积和抑制心肌细胞凋亡。有研究显示[15],Akt磷酸化的变化与心肌保护效应的变化有关,用Western blot半定量分析p-Akt,显示七氟烷预处理后使得p-Akt表达量增加,说明七氟烷预处理与p-Akt的变化有一定的相关性。
综上所述,1 MAC的七氟烷预处理可能通过增强Akt的磷酸化来减轻成年及幼年大鼠的心肌缺血/再灌注损伤。
[1]Gross G J.Role of opioids in acute and delayed preconditioning[J].J Mol Cell Cardiol,2003,35(7):709 -18.
[2]Lewis M C,TerRiet M,DeLaCruz L,et al.Rapid sevoflurane induction compared with thiopental[J].J Clin Anesth,2004,16(4):271-5.
[3]Zaugg M,Lucchinetti E,Spahn D R,et al.Volatile anesthetics mimic cardiac preconditioning by priming the activation of mitochondrial K(ATP)channels via multiple signaling pathways[J].Anesthesiology,2002,97(1):4 -14.
[4]陈洪涛,雷春亮,李宝金,等.七氟烷后处理对大鼠缺血/再灌注损伤心功能和ERK1/2表达的影响[J].中国药理学通报,2011,27(2):258 -64.
[4]Chen H T,Lei C L,Li B J,et al.Effect of sevoflurance postconditioning on cardiac function and ERK1/2 of isolated rat heart with acute myocardial ischemia-reperfusion injury[J].Chin Pharmacol Bull,2011,27(2):258 -64.
[5]Jamnicki-Abeqq M,Weihrauch D,Chiari P C,et al.Diabetes abolishes sildenafil-induced cGMP-dependent protein kinase-I expression and cardioprotection[J].J Cardiovasc Pharmacol,2007,50(6):670-76.
[6]Orliaguet G,Vivien B,Langeron O,et al.Minimum alveolar concentration of volatile anesthetics in rats during postnatal maturation[J].Anesthesiology,2001,95(3):734 -9.
[7]Hoiwitz L D,Fennessey P V,Shikes R H,et al.Markerd reduction in myocardial infarct size due to prolonged infusion of an antioxidant during reperfusion[J].Circulation,1994,89(4):1792 -801.
[8]Kodaka M,Johansen J W,Sebel P S.The influence of gender on loss of consciousness with sevoflurane or propofol[J].AnesthAnalg,2005,101(2):377 -81.
[9]Hu G,Salem M R,Crystal G J.Role of adenosine receptors in volatile anesthetic preconditioning against neutrophil-induced contractile dysfunction in isolated rat hearts[J].Anesthesiology,2005,103(2):287-95.
[10]Orliaguet G,Vivien B,Langeron O,et al.Minimum alveolar concentration of volatile anesthetics in rats during postnatal maturation[J].Anesthesiology,2001,95(3):734 -9.
[11]Kaneda K,Miyamae M,Sugioka S,et al.Sevoflurane enhances ethanol-induced cardiac preconditioning through modulation of protein kinase C,mitochondrial KATPchannels,and nitric oxide synthase,in guinea pig hearts[J].Anesth Analg,2008,106(1):9 - 16.
[12]Raphael J,Abedat S,Rivo J,et al.Volatile anesthetic preconditioning attenuates myocardial apoptosis in rabbits after regional ischemia and reperfusion via Akt signaling and modulation of Bcl-2 family proteins[J].J Pharmacol Exp Ther,2006,318(1):186 -94.
[13]Wang C,Xie H,Liu X,et al.Role of nuclear factor-kappaB in volatile anaesthetic preconditioning with sevoflurane during myocardial ischaemia/reperfusion[J].Eur J Anaesthesiol,2010,27(8):747-56.
[14]于 水,杨海扣,米 琰,等.PI3K/Akt信号通路在外源性硫化氢后处理大鼠离体心肌中的作用[J].中国药理学通报,2010,26(6):759 -64.
[14]Yu S,Yang H K,Mi Y,et al.Function of PI3K/Akt signaling pathway in exogenous hydrogen sulfide postconditioning on isolated rat hydrogen[J].Chin Pharmacol Bull,2010,26(6):759 -64.
[15]Hausenloy D J,Yellon D M.Reperfusion injury salvage kinase signalling:taking a RISK for cardioprotection[J].Heart Fail Rev,2007,12(3 -4):217 -34.

