原发性肝癌患者血清中Glypcian-3检测及与AFP联合试验的诊断价值
王丽丽,王立群,高 歌
(吉林大学中日联谊医院,吉林长春130033)
本文通过检测原发性肝癌(PHC)、肝硬化(LC)和正常对照组血清中磷脂酰肌醇蛋白聚糖-3(Glypican-3)蛋白,探讨血清Glypican-3检测能否作为满意的PHC肿瘤标记物以及与AFP联合检测的诊断价值,为今后PHC早期临床诊断提供一些帮助。
1 资料与方法
1.1 研究对象
选取吉林大学中日联谊医院 2006年 3月-2008年3月,门诊和住院收治的PHC患者共64例为肝癌组,其中男54例,女10例。年龄24-81岁,平均58.06±12.13岁。所有的PHC患者的诊断符合2001年9月中国抗癌协会肝癌专业委员会修订的《原发性肝癌的临床诊断与分期标准》,且经病理证实。其中Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期分别为6例(9.38%)、28例(43.75%)、26例(40.63%)、4例(6.25%);伴门脉癌栓26例(40.63%);肿瘤直径≥5 者 28例(43.75%);癌结节 2个以上者24例(37.5%);肝功能状况采用Child-pugh分级法:A级22例(34.38%)、B级 14例(21.88%)、C级 28例(12.50%)。肝硬化组选取同期收治的LC患者共63例,其中男45例,女18例。年龄24-80岁,平均53.92±11.67岁。诊断符合2000年中华医学会西安会议修订的《病毒性肝炎防治方案》标准。健康对照组为健康体检者共54例,其中男41例,女13例。年龄35-79岁,平均54.17±12.67岁。三组患者在性别、年龄等一般资料比较无显著性差异。
1.2 标本采集
所有患者留取清晨空腹12小时肘静脉血3 ml共两管,即刻于 4℃、3 000 r/ml离心15 min,分离血清0.5-1 ml置Ependorff管分装,-20℃冰箱中冰冻待用,全部标本于实验时一批测定。
1.3 主要试剂及仪器
Glypican-3应用美国宝特公司生产的ELX-800全自动酶标仪检测,试剂盒购自美国ADL公司。AFP应用美国雅培公司生产的AXSYM全自动免疫分析仪,试剂盒购自美国雅培公司。
1.4 实验方法
Glypican-3采用酶联免疫吸附试验法检测。AFP采用微粒子酶免化学发光分析法检测。严格按照试剂盒说明书进行检测。
1.5 结果判断
肿瘤标志物阳性标准分别以试剂盒推荐的临界参考值数值为准。Glypican-3>80 ng/ml为阳性;AFP >20 μ g/ml为阳性。
1.6 统计学处理
应用SPSS 10.0软件包进行统计分析,GPC3、AFP检测数据以均数±标准差(x—±s)表示,阳性率的比较用 χ2检验,PHC与对照组组间均数比较用t检验。
2 结果
2.1 原发性肝癌、肝硬化组及正常对照组血清GPC3、AFP 检测结果
见表1。
表1 三组GPC3、AFP检测结果(±s)
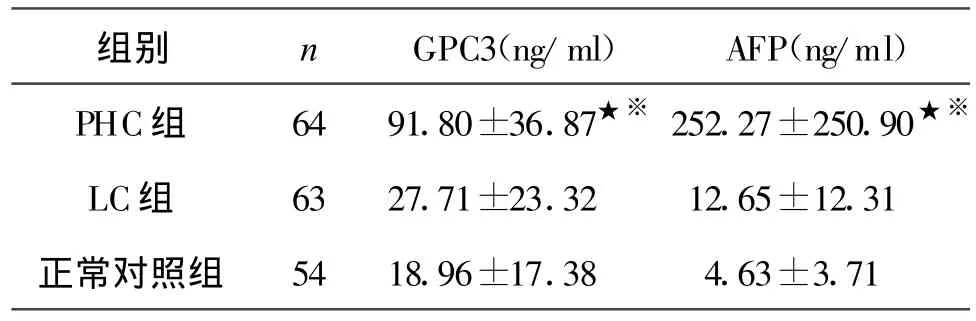
表1 三组GPC3、AFP检测结果(±s)
★与对照组比较 P<0.01;※与LC组比较 P<0.01
?
2.2 GPC3、AFP在PHC中的检出率比较
见表2。
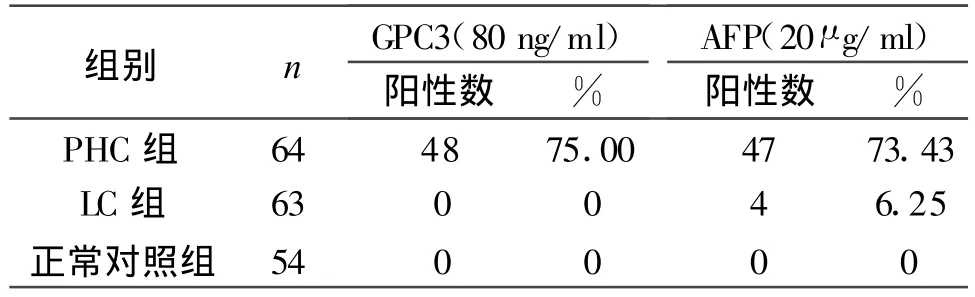
表2 GPC3、AFP在三组中检测阳性率的比较
2.3 不同临床参数的外周血GPC3的表达
将64例PHC患者按性别、年龄、临床TNM分期、肿瘤直径、癌结节数目、有无门脉癌栓及肝功能分级分组,其血清GPC3阳性检测率见表3。
64例PHC 患者中AFP阴性的(AFP<20 μ g/ml)患者数为17例,其中有13例GPC3为阳性,占AFP阴性数的76.47%。在AFP阳性与阴性不同表达时GPC3阳性率的比较,差异无显著性(P>0.05)。血清AFP >200μ g/ml组(21/28,75.00%)与血清 AFP20-200 μ g/ml组(14/19,73.68%)的 PHC患者外周血GPC3检出率与血清AFP<20 μ g/ml组比较,差异均无显著性(P>0.05)。
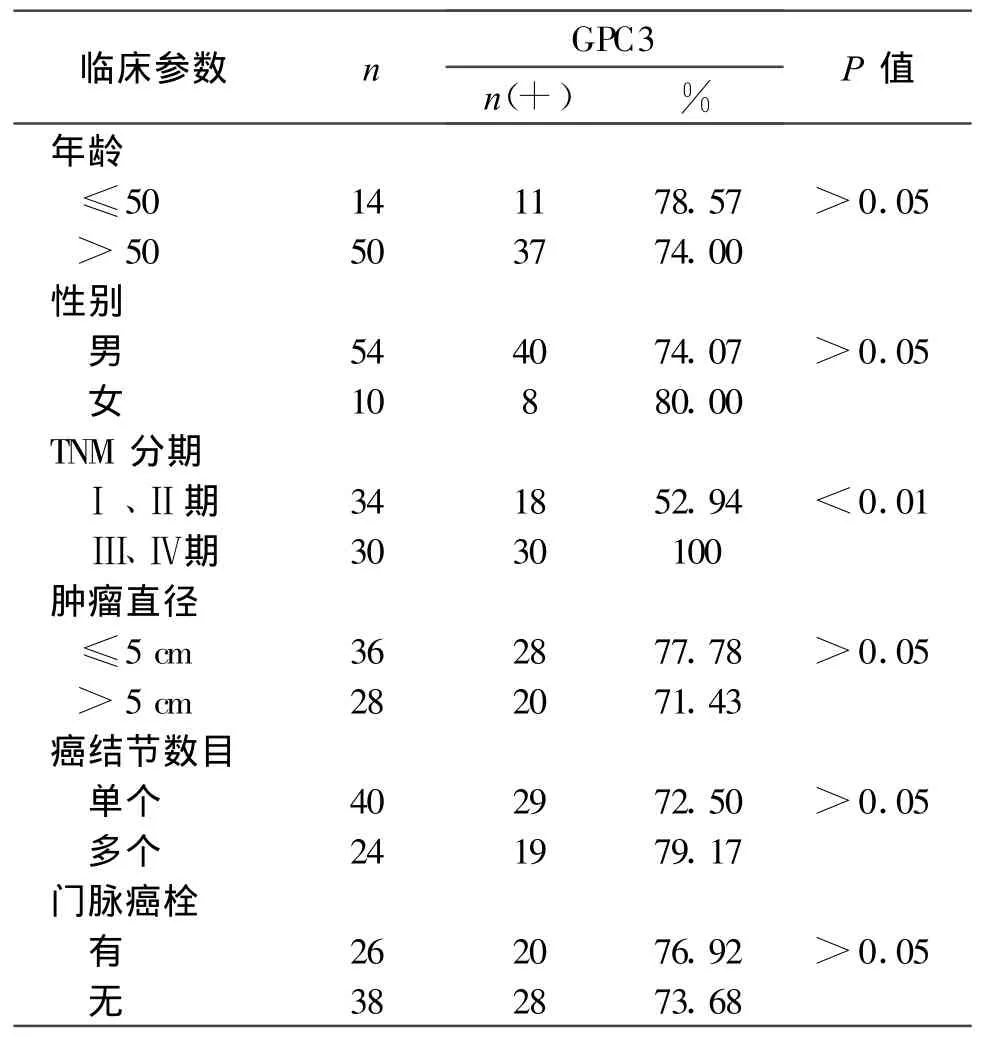
表3 不同临床参数的患者外周血GPC3的表达
2.4 GPC3与AFP联合检测对PHC诊断价值
单项检测GPC3的敏感性为75.00%,特异性为100%,漏诊率为25.00%,AFP的敏感性为73.43%,特异性为92.16%,漏诊率为26.57%。两者比较,差异无显著性(P>0.05)。二者联合检测,可使敏感性提高到93.75%,漏诊率降至6.25%,与GPC3、AFP单独检测相比,差异有显著性(P<0.05)。见表4。
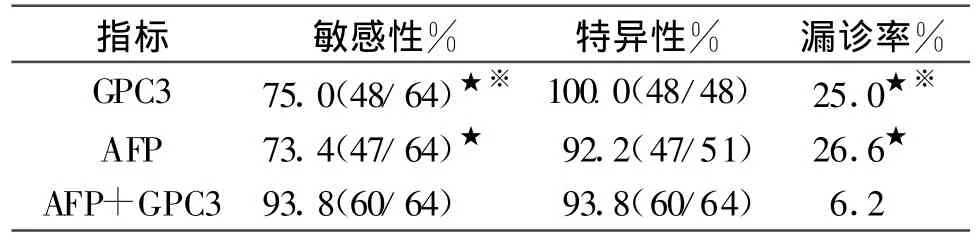
表4 GPC3与AFP联检对PHC诊断价值的比较
3 讨论
原发性肝癌(PHC)是一种常见、多发、死亡率高的恶性肿瘤之一。目前PHC的诊断主要依靠影像学的发现和血清肿瘤标志物(TM)的检测。PHC标志物分析有助于PHC早期诊断、疗效观察、术后随访及复发或转移监测,为早期诊断恶性肿瘤提供特异的科学依据。因此,希望找到一种特异性强,敏感度高的TM。由于肿瘤标志物只有相对特异性,大多数项目缺乏定位诊断价值,单一的肿瘤标志物作为诊断PHC的指标均有不同程度的局限性。
Capurro和Nakatsura等[1,2]在应用酶联免疫吸附实验(ELISA)方法检测到PHC患者血清中的Glypican-3,发现阳性率高,capurro报道的阳性有 53%(18/34),Nakatsura报道有40%(16/40),而在肝炎合并肝硬化患者血清中Capurro检测到1例阳性(共20例),正常人血清中未检测到。Yamauchi等[3]进一步证实了Glypican-3在PHC组织中的表达同基因水平相一致,在非癌肝组织中同样没有表达或表达量极低。这与本试验得出的结论相一致。而Capurro在肝炎合并肝硬化患者血清中检测到1例阳性,在随访时发现该患者发展为PHC,说明Glypican-3可用于PHC的早期诊断,有助于鉴别良、恶性肝病。因此,蛋白印迹、酶联免疫吸附法研究表明Glypican-3是一个良好的PHC 血清学标记物[1、2、4]。
Capurro M[2]和Filmus J[5]分别分析比较了PHC病人血清中Glypican-3和AFP的表达,结果显示在同一患者血清中两者的表达没有相关性,Glypican-3mRNA在小肝癌检出率明显比AFPmRNA和血清中的AFP高[6]。研究表明,Glypican-3在AFP阴性的PHC中有较高的表达[7],与我们的结果相一致,提示Glypican-3可提高AFP阴性PHC患者的诊断率。
我们的研究结果显示:Glypican-3蛋白表达与病理分级有显著相关性(P<0.05),而与肿瘤直径无明显相关性,这与国外报道相一致[8],提示Glypican-3蛋白作为一个特异性的肿瘤标记物,可能在细胞癌变的初始即有稳定的表达,发生于PHC的早期,检测血液中的Glypican-3的表达对于预测肿瘤的恶性程度、病情轻重及预后有重要价值。由此我们认为检测Glypican-3可作为诊断PHC的肿瘤特异性标志物。
本实验单独检测Glypican-3的敏感性为75.0%,漏诊率为25.0%,AFP的敏感性为73.4%,漏诊率为26.6%。两者比较,无显著性差异。表明Glypican-3与AFP在PHC中表达无相关性。AFP阴性PHC患者血清有较高的Glypican-3检出率。Glypican-3对AFP阴性及低浓度的原发性肝癌的筛选均有一定的临床诊断和鉴别诊断价值,有助于提高原发性肝癌的早期诊断率,减少漏诊。二者联合检测,可使敏感性提高到93.8%,漏诊率降至6.2%,我们认为若采用Glypican-3作为PHC血清标志物与AFP联合检测用于临床,可更进一步提高PHC诊断的阳性率,尤其是AFP阴性患者的诊断率。Glypican-3、AFP可以起到较好的互补作用,是解决AFP假阳性和假阴性问题的有效途径,是PHC血清学诊断方法发展的必然趋势。特别是在当前国内PHC有上升趋势,早期、快速、准确的筛查发现PHC,这一方法具有重要价值。
为了提高PHC的诊断灵敏度、准确性和鉴别诊断价值,减少漏诊率,建议采用Glypican-3、AFP联合检测。
[1]Nakatsura T,Yoshitake Y,Senju S,et al.Glypican-3,overexpressed Specifically in human hepatocellular carcinoma,is a novel tumor marker[J].Biochem Biophys Res Commun,2003,306:16.
[2]CapurroM,Wanless IR,Sherman M,et al.Glyp ican23:a novelserum and histochemical marker for hepatocellular carcinoma[J].Gastroenterology,2003,125:89.
[3]Yamauchi N,Watanabe A,Hishinuman M,et al.The glypican 3 oncofetal protein is a promising diagnostic markerforhepetocellularcarcinoma[J].Mod Pathol,2005,18(12):1591.
[4]Capurro M,Wanless IR,Sherman M,et al.Glypican-3:a novel-serum and histochemical marker for hepatocellular carcinoma[J].Gastroenterology,2003,125:89.
[5]Filmus J,Capurro M.Glypican-3 and alphafetoprotein as diagnostic tests for hepatocellular carcinoma[J].Mol Diagn,2004,8(4):207.
[6]Hsu HC,Cheng W,Lai PL.Cloning and expression of a developmentally regulated transcript MXR7 in hepatocellular carcinoma:biological significanceand temporospatial distribu-tion[J].Cancer Res,1997,57:5179.
[7]Debra L,ZyngerMD,Anita Gupta MD,et al.Expression of glypican-3 in hepatoblastoma:an immunohistochemical study of 65 cases[J].Human Patho-logy,2008,39:224.
[8]Franc?oise Degos MD,et al.Glypican-3 expression in hepatocellular tumors:diagnostic value forpreneoplastic lesions and hepatocellularcarcinomas[J].Human Pathology 2006,37:1435.

