C14orf48基因在人精液精子中的表达和生物信息学分析
李如凯,郭龙华
(1.深圳市石岩人民医院 检验科,广东 深圳518036;2.广东省中医院 检验科,广东 广州510120)
根据世界卫生组织(WHO)的统计资料,全世界范围内不孕不育症占育龄夫妇的20%左右,其中男性因素导致不孕不育的约占50%[1]。导致男性不育的原因很多,如遗传因素、营养缺乏、心理因素等,而弱精子症(Asthenozoospermia)或精子活动力低下被认为是导致男性不育的重要原因。有报道,82%的男性不育与精子活动障碍有关,其中20%左右与精子活动力低下直接相关[2]。弱精子症的发生机制现在还不清楚,其发生的分子机制一直是人们研究的重点。在人和哺乳动物的精子中大概含有2000多个转录本和一系列复杂的蛋白,这些蛋白在精子运动、获能和顶体反应中发挥着重要作用[3-6]。目前已经证实了一些基因与精子运动有关,其中某些基因在弱精中的表达显著降低,是弱精发生的原因,如:可溶性腺苷酸环化酶(sAC)[7,8]、钙离子通道(Catsper)、芳香化酶、睾丸特异蛋白-1(Testis-specific protein1)和乳酸脱氢酶C(Lactate dehydrogenase C)[6]。对于调控精子运动关键基因的研究有助于揭示弱精精子症患者的发生机制,为临床弱精子症患者的治疗提供有意义的探索。
1 材料与方法
1.1 样本收集与处理
精液标本来源于广东省中医院及深圳市石岩人民医院的门诊病人。严格按照世界卫生组织标准,筛选正常人精液(精液量2-6 ml,呈灰白色或淡黄色,pH7.2-7.8,30-60 min全部液化,精子密度≥20×106/ml,精子活力A级≥25%或A+B级≥50%,正常精子形态≥50%,白细胞<1×106)和弱精子症患者精液(精子活力A级<25%或A+B级<30%)。为避免圆形细胞(生精细胞和白细胞)的污染,按文献方法[5],将液化后的精液经Percoll(95%,76%,57%和47.5%)非连续梯度离心(300×g,25 min),收集95%Percoll以下和57%与76%Percoll层之间的精子。磷酸盐缓冲液洗涤2次(600×g,5 min),储存于-80℃备用。同时选取含有睾丸生精细胞和白细胞的精液标本作为C-KIT(生精细胞标志物)和CD45(白细胞标志物)的阳性对照。人对心 、肝 、脾 、肺 、肾 、胃 、脑 、睾丸组织来源于病人活检、手术或遗体捐献,患者年龄24-40岁,均有患者及家属签定的知情书,并经本院伦理委员会批准。
1.2 Affymetrix芯片分析
用基因芯片方法来比较正常男性和弱精子症患者精液精子表达谱差异,筛选差异表达基因。人的全基因组芯片(GeneChip Human Genome U133 Plus 2.0,Affymetrix Comp)涵盖了47000转录本,代表了38500多个已经明确的基因和EST序列。将纯化后精子的cDNA探针与Affymetrix全基因组芯片杂交。芯片购自美国Affymetrix公司,所以实验操作过程参考该公司实验手册。
1.3 生物信息学分析
NCBI做序列分析和Blastn同源性比较(http:WWW.ncbi.nlm.nih.gov/blast)。蛋白质序列分析采用DNAstar软件。亚细胞定位预测用PSORT II Prediction(http://psort.ims.u-tokyo.ac.ip/form2.htm1)。
1.3 半定量RT-PCR
采用Primer Premer5.0软件自行设计引物,并以磷酸甘油醛脱氢酶(GAPDH)为内参对照。为了避免基因组DNA的污染,上下游引物分别设计在不同的外显子上(引物由上海生工合成)。引物序列如下:人 C14orf48,上游引物 5′-CCGTTTCGGTCTGTC TTC ATCC-3′,下游引物 5′-CCGAATAAACGCCCATAGCAG-3′,扩增产物大小225 bp;GAPDH:s上游引物 5′-TCCCATCACCATCTTCCAG-3′, 下 游 引 物 5′-GAGTCCTTCCACGATACCA-3′,产物为 307 bp 。
取离心后精子,按照RNAfast200 Kit(上海飞捷)提取总RNA。紫外分光光度计定量后于-80℃储存备用。采用反转录反应试剂盒(Fermentas公司,美国)进行逆转录,按照说明书中方法合成cDNA第一链,以该链cDNA为模板,用上述引物对其进行PCR扩增。在20 μ l的反应总体积中加入以下物质:cDNA(500 ng/20 μ l):2 μ l,引物(10 pmol/L):0.4 μ l,10×PCR buffer:2.0 μ l,MgC12(25 mmol/L):1.6 μ l,dNTP(10 mmol/L):0.4 μ l,TaqDNA 聚合酶(1 μ/μ l):1 μ l。PCR反应条件为:94℃4 min,94℃30 s,56℃40 s,72℃35 s,共35个循环,72℃5min,1.5%的琼脂糖检测PCR产物大小。
2 结果
2.1 Affymetrix芯片结果
Affymetrix芯片探针为1570111-at的杂交信号校正值在正常男性和弱精子症患者精液精子中分别是141.2(P)和2.8(A)。A:Absent,表示在基因芯片中不表达;P:Present,表示在芯片中表达。可见1570111-at探针所代表的基因在弱精子症患者精液精子中不表达,在正常男性精液精子中高表达。以GAPDH为内对照,其芯片杂交信号校正值分别是209.2(P)和209.1(P)。
2.2 cDNA序列和蛋白特性的预测
1570111-at探针代表的基因登录号为BC031252.1,NCBI做Blastn分析发现,与登录号为NR-024182的cDNA序列有100%的同源性。NR-024182 cDNA全长1 952 bp,基因名称为C14orf48,定位14q32.12,含有9个外显子。用NCBI做Unigene分析发现该基因的EST序列只在在睾丸组织中检测到,人其他44个组织或者器官中检测相对量均为0,说明该基因具有睾丸表达特异性。生物信息学预测该基因编码140个氨基酸、分子量为15.808 kD的功能未知蛋白质Q8NCU1。亚细胞定位预测该基因在细胞质(39.1%)和细胞核(34.8%)中表达。
2.2 C14orf48在精液精子中的RT-PCR结果
正常男性和弱精子症患者组各选20例精液精子进行RT-PCR反应,均没有检测出C-KIT(生精细胞标志物)和CD45(白细胞标志物),表示纯化结果良好,没有白细胞和不成熟精子的污染。RT-PCR结果显示,弱精子症患者精液精子中没有检测到C14orf48表达,而该基因在正常男性精液精子中则表达强烈。内参GAPDH在正常和弱精子患者中表达没有差异。如图1所示。
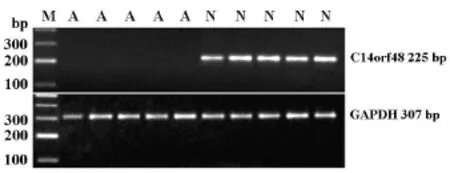
图1 C14orf48在正常男性(N)和弱精子症患者精液精子中的表达(A)
2.4 C14orf48多组织RT-PCR结果分析
在人 8种组织(心 、肝 、脾、肺 、肾 、胃、脑 、睾丸)RT-PCR结果表明,C14orf48基因在睾丸中呈现特异性表达,能够看到225 bp的PCR产物。而其他组织中均不表达(图3)。阳性内对照GAPDH均有特异性RT-PCR产物。
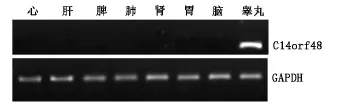
图2 C14orf48人多种组织的RT-PCR结果
3 讨论
弱精子症(精子活动力低下)是男性不育症最常见的精液异常改变之一,因其病因复杂,目前尚未有明确有效的治疗方法,多以内分泌治疗和辅助生育技术为主要方法而达到男性生育的目的。目前认为,与精子运动相关的几个生理过程是保证男性正常生育的重要基础,(1)精子尾部的大体形态和亚细胞结构;(2)精子的能量代谢,包括糖酵解和氧化磷酸化,此过程产生ATP;(3)调控精子运动的信号传导通路,包括cAMP/PKA信号传导通路,钙信号传导通路,小G蛋白信号传导通路[9,10]。根据以上分析可以推测弱精子症的发生可能是以上某个环节发生问题所导致的结果。
本实验通过比较弱精子症患者和正常男性精液精子的基因表达谱,找到了差异基因C14orf48,该基因在弱精子患者中的表达明显缺失,并通过PT-PCR的方法进一步得到验证。生物信息学分析结果显示该基因仅在睾丸中特异性表达,在人类其他44种组织中不表达,RT-PCR结果表明在人8种组织中仅在睾丸组织中表达。因此推测C14orf48基因的表达产物可能通过以上三种机制参与的精子运动,该基因在弱精子症患者精液精子中的表达缺失可能是弱精子症发生的原因之一。目前该基因的功能未知,进一步研究该基因的生物学功能,对于揭示人类弱精子症的发生机制具有重要意义。
[1]World Health Organization.Prevention and Management of Infertility:Progress[S].Geneva:World Health Organization,1990:15.
[2]Curi SM,Ariagno JI,Chenlo PH,et al.Asthenozoospermia:analysis of a large population.Arch Androl[J].2003,49(5):343.
[3]Dadoune JP,Pawlak A,Alfonsi MF,et al.Identification of transcripts by microarrays,RT-PCR and in situ hybridization in human ejaculate spermatozoa[J].Mol Hum Reprod,2005,11(2):133.
[4]Martins RP,Krawetz SA.RNA in human sperm[J].Asian J Androl,2005,7:115.
[5]OstermeierGC,Dix DJ,Miller D,et al.Spermatozoal RNA profiles of normal fertile men[J].Lancet,2002,360:772.
[6]Wang H,Zhou Z,Xu M,et al.A spermatogenesis-related gene expression profile in human spermatozoa and its potential clinical applications[J].J Mol Med,2004,82:317.
[7]Esposito G,Jaiswal BS,Xie F,et al.Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect[J].Proc Natl Acad Sci U S A,2004,101(9):2993.
[8]Cai ZM,Gui YT,Guo LD,et al.Functional expression of adenylyl cyclases and phosphodiesterases in ejaculated human spermatozoa[J].Chin J Androl,2006,12:195.
[9]Turner RM.Tales from tail:what do we know about sperm motility regulation[J].J Androl.2003;24:790.
[10]Turner RM.Moving to the beat:a review of mammalian sperm motility regulation[J].Reprod Fertil Dev,2006,18(1-2):25.

