ER阳性乳腺癌中MUC1的强阳性表达及其与预后的关系
裔海鹰 谢轶群 李圆 黄雷
1.上海市黄浦区中心医院乳腺外科,上海 200002;2.上海交通大学医学院医学遗传学教研室,上海 200025;
ER阳性乳腺癌中MUC1的强阳性表达及其与预后的关系
裔海鹰1谢轶群1李圆2黄雷2
1.上海市黄浦区中心医院乳腺外科,上海 200002;2.上海交通大学医学院医学遗传学教研室,上海 200025;
背景与目的:黏蛋白1(mucin 1,MUC1)主要作为血清学分子标记应用于乳腺癌患者术后肿瘤复发转移的监测,但其在乳腺癌患者术后早期检测对预后的价值尚不明确。本研究旨在通过检测乳腺癌组织中MUC1的强阳性表达,分析其与ER表达以及预后的关系,以探讨MUC1强阳性表达在乳腺癌术后早期检测对预后的作用。方法:采用免疫组织化学法检测134例乳腺癌组织中MUC1的强阳性表达情况,并分析其与ER表达以及预后的关系。结果:本组乳腺癌组织中MUC1强阳性表达率为47.0%,乳腺癌组织中MUC1强阳性表达与ER阳性表达存在着显著的正相关关系(χ2=10.09,P<0.01,r=0.27)。在ER阴性乳腺癌患者中尚不能认为MUC1强阳性表达与预后相关(P=0.26);经单因素和多因素分析,在ER阳性并接受他莫昔芬治疗的乳腺癌患者中,MUC1强阳性表达、Her-2强阳性表达和淋巴结转移状态均是独立的预后因子(P<0.05)。同时,多因素分析表明Her-2强阳性表达的优势比最大(OR=12.41),淋巴结转移状态次之,MUC1强阳性表达最小。结论:在乳腺癌组织中MUC1强阳性表达与ER表达正相关,在ER阳性并接受他莫昔芬治疗的乳腺癌患者中MUC1强阳性表达具有独立的预后价值。
乳腺癌; 黏蛋白1; 雌激素受体; 预后; 免疫组织化学
黏蛋白1(mucin 1,MUC1)是一种高相对分子质量糖蛋白,主要分布于呼吸道、乳腺、胃肠道等上皮组织[1]。临床上,MUC1通常作为血清学分子标记,应用于乳腺癌患者术后复发转移的监测。然而,乳腺癌术后早期血清MUC1变化较小,其临床价值较为有限。相关研究表明在乳腺癌组织中MUC1的阳性表达率较高(约78%~90%),与预后无明显相关[2-4],但也有研究显示MUC1强阳性表达与预后可能相关[5]。因此,我们认为在乳腺癌组织中测定MUC1的强阳性表达可能对乳腺癌术后早期更具价值。故 我们引入MUC1强阳性表达的概念,采 用免疫组织化学法测定乳腺癌组织中MUC1的强阳性表达情况。同时,由于国内外相关研究表明MUC1表达与雌激素受体(estrogen receptor,ER)表达相关[6]。因此,本研究进一步分析 了MUC1强阳性表达与ER表达的相关性,进而 在ER阳性和ER阴性乳腺癌患者中对预后进行分层分析。通过在ER阳性并接受他莫昔芬治疗的乳腺癌患者中对预后的单因素和多因素分析,明确MUC1的强阳性表达在ER阳性并接受他莫昔芬治疗的乳腺癌患者中是否为独立的预后因子。
1 资料和方法
1.1 一般资料
所有标本均为上海市黄浦区中心医院乳腺外科2004年—2005年间 手术切除的乳腺癌组织标本,共134例,并经病理HE染色和本院两位以上病理科医师确诊。各组织标本均有完整的术后病理资料。其中浸润性导管癌106例、浸润性小叶癌22例、浸润性神经内分泌癌2例、黏液腺癌4例。其中ER阳性95例(均接受他莫昔芬治疗5年),39例伴有腋窝淋巴结转移(淋巴结转移情况以术后病理检查为准)。乳腺癌患者手术前均未经过抗癌治疗(包括放疗、化疗及内分泌治疗等)。乳腺癌患者均为女性,年龄26~83岁(平均55岁)。
1.2 主要试剂
MUC1单克隆抗体由上海交通大学医学院遗传学教研室黄雷 教授提供;EnVision试剂购自上海蓝创生物科技发展有限公司;对二甲胺基偶氮苯(DAB)显色试剂盒购自福州迈新生物技术有限公司。
1.3 免疫组化染色
所有标本均经10%中性甲醛固定,经常规脱水透明石蜡包埋,做4 μm厚连续切片,备常规HE染色及免疫组织化学染色,免疫组织化学染色采用EnVision法。根据一抗说明书要求进行前处理。石蜡切片常规脱蜡至水后,以3%H2O2室温下温育10 min以阻断内源性过氧化物酶的活性。石蜡切片浸入0.05 mol/L EDTA的缓冲液(pH=8.0)微波(98℃)加炉热10 min,重复2次,自然冷却20 min,进行热诱导抗原修复。为阻断非特异性抗体结合,切片以10%羊血清PBS中室温温育30 min。滴加抗鼠MUC1单克隆抗体(1∶100),4 ℃温育过夜。滴加酶标记的二抗(EnVision试剂),室温湿盒中温育60 min。DAB显色3 min,苏木精衬染,常规酒精梯度脱水、二甲苯透明、中性树胶封片、光镜观察实验结果。实验中以PBS代替一抗作阴性对照,以已知阳性片作阳性对照,以确保实验的特异性和灵敏性。
1.4 免疫组化染色结果判定
MUC1染色阳性结果的判定标准:乳腺癌细胞膜和(或)胞质中出现棕褐色颗粒染色为MUC1阳性表达细胞。乳腺癌组织中 MUC1 表达强度分级,每张切片随机选择5个高倍视野,按阳性细胞数占同类细胞的百分率分4级:阳性细胞数<10%为阴性表达(-),10%~<30%为中度表达(+),30%~<50%为高表达(++),≥50%为强阳性表达(+++)[6](图1)。
ER、PR、Her-2均记为(+)和(-)。ER(+)为原术后病理资料ER(+~+++);ER(-)为原术后病理资料ER(-)。PR(+)为原术后病理资料PR(+~+++);PR(-)为原术后病理资料PR(-)。Her-2(+)为原术后病理资料Her-2(+++);Her-2阴性为原术后病理资料Her-2(-、+或++)。
1.5 随访
134例乳腺癌患者均从病理确诊时开始计算生存时间,随访截止时间为2010年3月。失访8例,随访率94%,中位随访时间5.3年。
1.6 统计学处理
采用SPSS 17 统计学软件进行数据分析。本组乳腺癌患者中MUC1的强阳性表达与ER的关系、ER阴性乳腺癌患者中MUC1的强阳性表达与预后的关系,采用χ2检验、Fish确切概率法进行分析,P<0.05 为有统计学意义。对影响ER阳性并接受他莫昔芬治疗的乳腺癌患者预后的因素进行单因素和多因素分析。单因素分析采用χ2检验、Fisher’s确切概率法,P<0.05 为有统计学意 义。多因素分析变量筛选法为向前逐步法,采用Wald检验,进入方程的检验水准为0.05,变量保留在方程的水准为0.10。
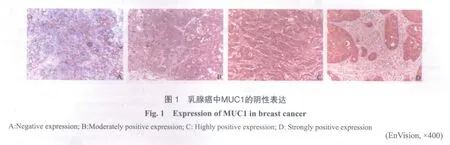
2 结 果
2.1 本组乳腺癌组织中MUC1强阳性表达与ER表达的关系
本组134例乳腺癌组织中ER阳性表达95例,阳性率70.9%;MUC1强阳性表达63例,强阳性率47.0%。MUC1呈强阳性表达的63例乳腺癌组织中53例ER呈阳性表达,阳性率为84.1%;MUC1呈非强阳性表达的71例乳腺癌组织中42例ER呈阳性表达,阳性率为59.2%。经χ2检验分析,本组乳腺癌中MUC1强阳性表达与ER阳性表达存在着显著的正相关关系(χ2=10.09,P<0.01,r=0.27)。
2.2 ER阴性乳腺癌患者中MUC1的强阳性表达与预后的关系
本组134例乳腺癌患者中ER阴性39例,获得随访37例,失访2例,5年总生存率为59.5%。MUC1强阳性表达组10例,死亡6例,5年总生存率为40.0%;MUC1非强阳性表达组27例,死亡9例,5年总生存率66.7%。本组ER阴性乳腺癌患者中MUC1强阳性表达患者生存率低于MUC1非强阳性表达者,经Fish确切概率法分析,两者差异无统计学意义(P=0.26),提示在ER阴性乳腺癌患者中尚不能认为MUC1强阳性表达与预后相关。
2.3 影响ER阳性并接受他莫昔芬治疗的乳腺癌患者预后的因素
2.3.1 单因素分析 本组134例乳腺癌患者,ER阳性95例,获得随访89例(均接受他莫昔芬治疗5年),失访6例,5年总生存率为80.9%。其预后经χ2检验、Fisher’s确切概率法分析,MUC1强阳性表达、Her-2强阳性表达和淋巴结转移状态对预后的影响有统计学意义(P<0.05,表1)。
2.3.2 多因素分析 将单因素分析中有意义的MUC1强阳性表达、Her-2强阳性表达和淋巴结转移状态共3个因素进行Logistic回归分析,结果显示三者在ER阳性并接受他莫昔芬治疗的乳腺癌患者中均是独立的预后因子(表2)。同时,可以看出Her-2强阳性表达的优势比(OR)最大,淋巴结转移状态次之,MUC1强阳性表达最小,说明Her-2强阳性表达对预后的影响作用在三者中最大,而MUC1强阳性表达最小。
3 讨 论
MUC1基因的编码产物黏蛋白1是一种高相对分子质量跨膜糖蛋白,主要分布于呼吸道、乳腺、胃肠道等上皮组织近管或腺腔面,呈顶端表达、极性分布,起润滑保护以及介导细胞间信号传导的作用[1]。在乳腺癌组织中,MUC1常出现过度表达且顶端定位不清,呈非极性分布[7]。临床上MUC1通常作为血清学分子标记(即CA15-3,MUC1的一个抗原决定簇)应用于乳腺癌患者术后复发转移的监测。研究发现在出现远处转移的乳腺癌患者中,有50%~80%伴有CA15-3水平升高[8]。然而,乳腺癌术后早期血清MUC1变化较小,其临床价值较为有限。同时,相关研究表明MUC1在乳腺癌组织中的阳性表达率较高(约78%~90%),与预后无明显相关[2~4]。但MUC1强阳性表达与淋巴结转移状态、预后可能相关[5]。因此,我们认为在乳腺癌组织中测定MUC1的强阳性表达可能对乳腺癌术后早期更具价值。故我们引入MUC1强阳性表达的概念并对其进行了初步研究,结果显示在本组134例乳腺癌患者中MUC1强阳性表达率为47%。
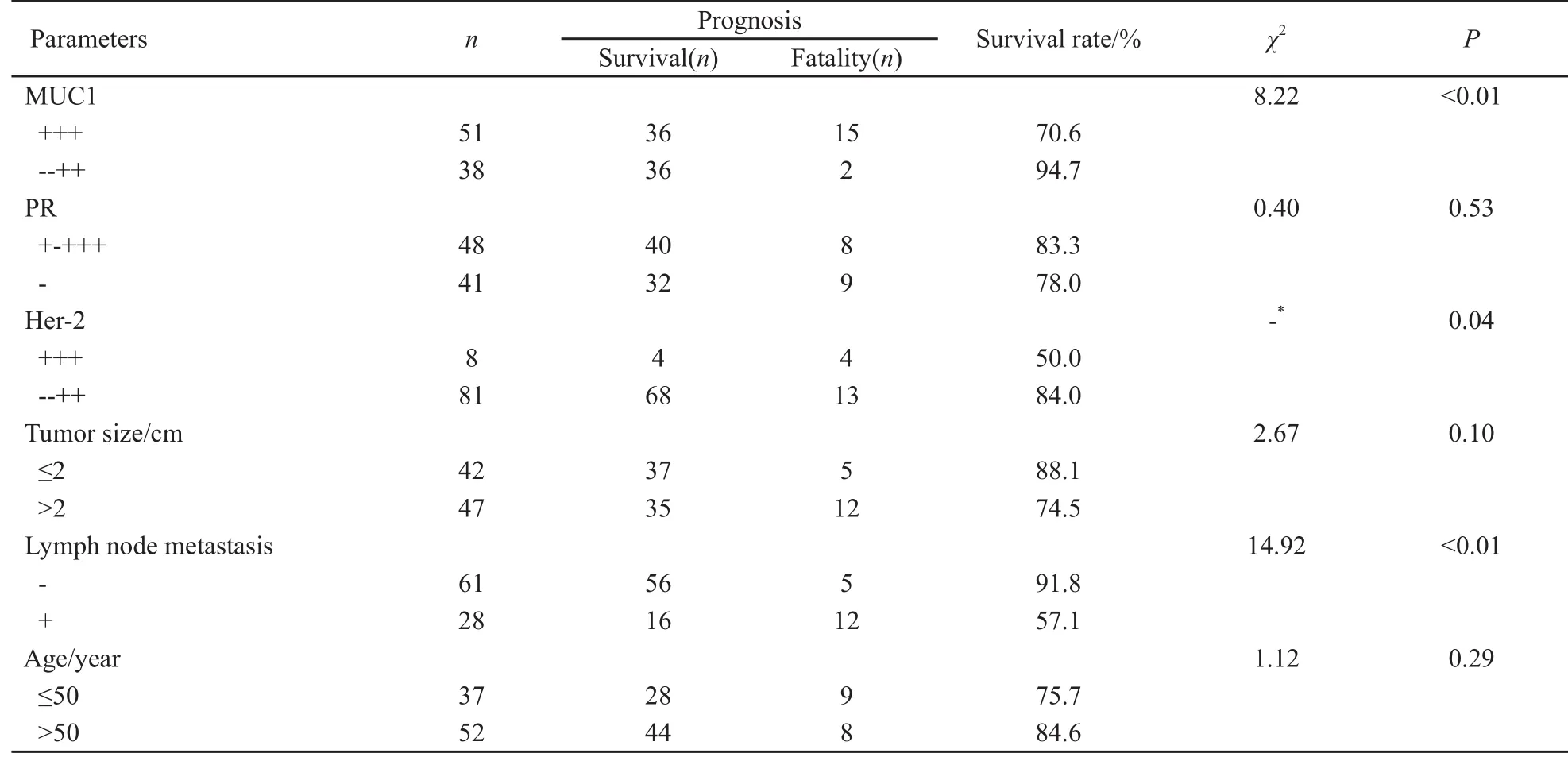
表 1 ER阳性并接受他莫昔芬治疗的乳腺癌患者预后的单因素分析Tab. 1 Univariate analysis of prognostic factors in ER-positive breast carcinoma with tamoxifen therapy
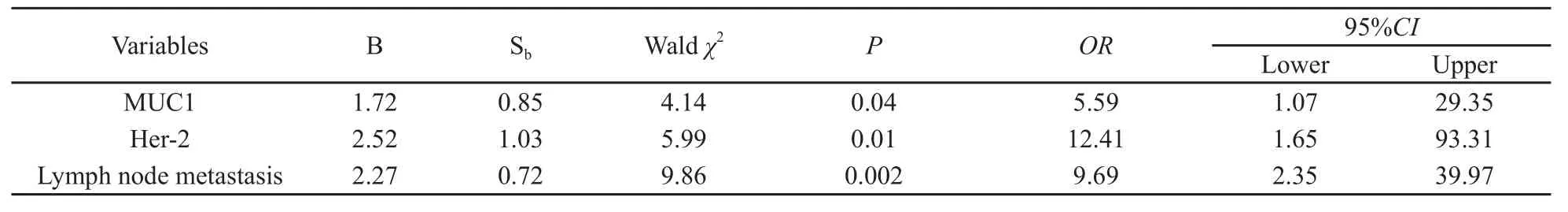
表 2 ER阳性并接受他莫昔芬治疗的乳腺癌患者预后的多因素分析Tab. 2 Multivariate analysis of prognostic factors in ER-positive breast carcinoma with tamoxifen therapy
相关研究表明MUC1表达与ER表达相关[9],故本研究首先测定了乳腺癌组织中MUC1强阳性表达与ER表达的关系。结果显示,本组134例乳腺癌组织中MUC1强阳性表达与ER阳性表达存在着显著的正相关关系(χ2=10.09,P<0.01,r=0.27),两者存在共线现象。尽管MUC1与ER在表达上存在一定相关,但相关性较低,且只能说明是表达上相关,而两者对乳腺癌预后的影响机制可能并不相同。本研究结果显示,MUC1强阳性表达在ER阴性乳腺癌患者中与预后不相关,在ER阳性并接受他莫昔芬治疗的乳腺癌患者中与预后相关,我们推测MUC1对预后的负面影响机制可能通过ER相关通路来实现,致使两者虽在表达上存在一定相关,但各自对预后的影响机制以及结果均不同。
本研究显示在ER阳性并接受他莫昔芬治疗的乳腺癌患者中MUC1强阳性表达提示预后较差,我们认为可能与其促进脂质代谢通路活化,以及导致他莫昔芬治疗失败有关。Wei等[10]认为MUC1癌蛋白能够稳定雌激素受体α,并激活其介导的转录,进而促使雌二醇介导的乳腺癌细胞生长。Khodarev等[11]的研究表明MUC1能调节胆固醇和脂肪酸代谢,而在ER阳性的乳腺癌患者中存在这些通路的活化均预示他莫昔芬治疗的失败。因而,MUC1与ER阳性的乳腺癌的发展相关,并可能导致癌细胞出现对他莫昔芬的抗药性,进而致使预后较差。此外,Khodarev等[12]的另一项研究认为在乳腺癌中MUC1可以诱导某些与肿瘤发生相关的转录过程而导致患者预后较差,其进一步研究表明在大约15%的乳腺癌中MUC1可致使转录信号转导子和活化子1(signal transducer and activator of transcription 1,STAT1)通路活化,导致患者预后较差[13]。
本研究引入MUC1强阳性表达的概念并探讨其价值,我们认为MUC1强阳性表达与ER在表达上存在一定相关,但两者对预后的影响机制以及结果并不同。尚不能认为MUC1强阳性表达在ER阴性乳腺癌患者中有预后价值;而在ER阳性并接受他莫昔芬治疗的乳腺癌患者中MUC1强阳性表达具有独立预后价值,MUC1强阳性表达提示预后较差。
[1]Ciborowski P, Finn OJ. Non-glycosylated tandem repeats of MUC1 facilitate attachment of breast tumor cells to normal human lung tissue and immobilized extracellular matrix proteins(ECM) in vitro: potential role in metastasis [J]. Clin Exp Metastasis, 2002, 19(4): 339-345.
[2]Kufe D, Inghirami G, Abe M, et al. Differential reactivity of a novel monoclonal antibody(DF3) with human malignant versus benign breast tumors[J]. Hybridoma, 1984, 3(3):223-232.
[3]Baldus SE, Wienand JR, Werner JP, et a1. Expression of MUC1, MUC2 and oligosaccharide epitopes in breast cancer:prognostic significance of a sialylated MUC1 epitope[J]. Int J Oncol, 2005, 27(5):1289-1297.
[4]王岭, 袁时芳, 凌瑞, 等. MUC1与ER、PR在乳腺癌组织中的表达及意义[J]. 中国现代医学杂志, 2003, 13(23): 29-32.
[5]王岭, 袁时芳, 姚青, 等. muc1基因在乳腺癌中的表达及其临床意义[J]. 第四军医大学学报, 2004, 25(13): 1222-1224.
[6]Kondo K, Kohno N, Yokoyama A, et a1. Decreased MUC1 expression induces E-cadherin-mediated cell adhesion of breast cancer cell lines[J]. Cancer Res, 1998, 58(9): 2014-2019.
[7]Schroeder JA, Thompson MC, Gardner MM, et a1. Transgenic MUC1 interacts with epidermal growth factor receptor and correlates with mitogen-activated protein kinase activation in the mouse mammary gland[J]. Bio Chem, 2001, 276(16):13057-13064.
[8]Bensouda Y, André F, Boulet T, et al. Prevalence of elevated serum CA 15-3 at time of metastatic relapse of breast cancer and correlation with hormone receptor status[J]. Bull Cancer, 2009, 96(10): 923-928.
[9]张立新, 王尧河, 陆雅芬, 等. MUC1粘蛋白在乳腺肿瘤中的表达及其生物学意义[J]. 中国组织化学与细胞化学杂志, 2002, 11(4): 417-420.
[10]Wei X, Xu H, Kufe D. MUC1 oncoprotein stabilizes and activates estrogen receptor alpha [J]. Mol Cell, 2006,21(2):295-305.
[11]Khodarev NN, Pitroda SP, Beckett MA, et al. MUC1-induced alterations in a lipid metabolic gene network predict response of human breast cancers to tamoxifen treatment [J]. Proc Natl Acad Sci U S A, 2009, 106(14): 5837-5841.
[12]Khodarev NN, Pitroda SP, Beckett MA, et al. MUC1-induced transcriptional programs associated with tumorigenesis predict outcome in breast and lung cancer. [J]. Cancer Res, 2009,69(7): 2833-2837.
[13]Khodarev N, Ahmad R, Rajabi H, et al. Cooperativity of the MUC1 oncoprotein and STAT1 pathway in poor prognosis human breast cancer [J]. Oncogene, 2010, 29(6): 920-929.
The strongly positive expression of MUC1 in ER-positive breast cancer tissues and the relationship between MUC1 prognosis of breast cancer
YI Hai-ying,XIE Yi-qun,LI Yuan,HUANG Lei(Department of Breast Surgery, Shanghai Huangpu Center Hospital, Shanghai 200002,China)
YI Hai-ying E-mail:yihaiying@163.com
Background and purpose:As a serum molecular marker, MUC1 was used to monitor recurrence and metastasis of breast cancer after surgery. But the value of MUC1 for prognosis of breast cancer in early postoperative patients was not clear. This study investigated the strongly positive expression of mucin 1(MUC1) in breast cancer tissue and analyzed the relationship between the strongly positive expression of MUC1 and expression of ER and prognosis of breast cancer, to explore clinical significance of MUC1 for prognosis in early postoperative patients.Methods:The strongly positive expression of MUC1 in 134 cases of breast cancer was detected by means of immunohistochemistry and the relationship between the strongly positive expression of MUC1 and expression of ER and prognosis of breast cancer was analyzed.Results:The strongly positive rate of MUC1 in 134 cases was 47.0 %.The strongly positive expression of MUC1 in breast cancer was significantly correlated with positive expression of ER(χ2=10.09,P<0.01,r=0.27) and was not correlated with prognosis (P=0.26) in ER(-) breast cancer patients. The strongly positive expression of MUC1, Her-2 and lymph node metastasis were independent prognostic factors (P<0.05) in ER(+)patients with tamoxifen therapy according to univariate and multivariate analysis. Multivariate analysis showed that the odds ratio of strong expression of Her-2 was the maximum (OR=12.41), followed by lymph node metastasis, MUC1 was the minimum.Conclusion:The strongly positive expression of MUC1 in breast cancer tissues was correlated with positive expression of ER and had independent prognostic value in ER(+) patients with tamoxifen therapy.
Breast neoplasms; Mucin 1; Estrogen receptor; Prognosis; Immunohistochemistry
10.3969/j.issn.1007-3969.2011.02.007
R737.9;R730.23
A
1007-3639(2011)02-0115-05
黄浦区卫生事业发展奖励金项目(No:HWY-07156)。
裔海鹰 E-mail:yihaiying@163.com
2010-07-06
2010-10-23)

