市售6种阿奇霉素制剂的人体生物等效性研究
汪华蓉,余蕾,易发红,何海霞(.重庆三峡中心医院药剂科,重庆市 404000;2.重庆医科大学附属第一医院临床药理室,重庆市 40006)
阿奇霉素(Azihromycin,AZ)[1]是大环内酯类抗生素,抗菌谱广、半衰期长、组织浓度高,在临床上可用于治疗多种细菌、支原体、衣原体感染,且其具疗效显著、安全性和耐受性好等特点,受到患者的青睐。临床上应用有片剂、颗粒剂、胶囊和注射剂,国内有多家药厂生产胶囊或片剂。鉴于市售品牌较多,笔者选择了市售国产5种阿奇霉素胶囊或片剂,以QLAZ厂生产的阿奇霉素胶囊为参比制剂,采用同一检测方法,从人体血药浓度和药动学参数角度进行了分析比较,考察其人体生物等效性,现报道如下。
1 材料
参比制剂:阿奇霉素胶囊(QLAZ厂,规格:每粒250 mg,批号:040400,批准文号:国药准字H10970061);受试制剂:阿奇霉素胶囊A(SCAZ厂,规格:每粒250 mg,批号:020301,批准文号:(97)卫药准字X-275-5号)、阿奇霉素胶囊B(HZAZ厂,规格:每粒250 mg,批号:040611,批准文号:国药准字H10970148)、阿奇霉素胶囊C(BJAZ厂,规格:每粒250 mg,批号:040205,批准文号:国药准字H10950065)、阿奇霉素片D(SHAZ厂,规格:每片250 mg,批号:050304,批准文号:国药准字H20000477)、阿奇霉素片E(SJZAZ厂,规格:每片250 mg,批号:031103,批准文号:国药准字H10980218);阿奇霉素标准品(中国药品生物制品检定所出品,购于重庆市药检所,批号:130352-200203,规格:946 IU·mg-1)。
藤黄微球菌(编号28001,重庆医科大学附属第一医院感染科提供)[2,3];蛋白胨(上海东海制药厂);牛肉浸膏(上海化学试剂站);酵母浸膏(上海化学试剂站);葡萄糖(重庆北碚化学试剂厂,分析纯,批号:900905);琼脂(日本进口分装,上海化学试剂站分装厂,批号:20518);水为蒸馏水。
2 方法
2.1 研究对象
男性健康志愿者,汉族,平均年龄(22.7±1.81)岁,平均体重(59.9±3.02)kg,平均身高(170.5±1.66)cm。试验前所有受试者经肝肾功能、血压、心电图检查均正常。于充分了解试验内容后自愿签署知情同意书。实施方案经重庆医科大学附属第一医院医学伦理委员会审批通过。
2.2 给药方案及血样采集
试验前禁食12 h后,于次日晨8∶00时空腹吞服500 mg[2]前述QLAZ厂和其余5厂家生产的阿奇霉素胶囊或片剂(200 mL温开水服药)。服药当日统一进标准餐。受试期间禁止大量活动,禁止吸烟、饮酒及含酒精、咖啡因类饮料,试验期间禁止一切非试验药物。于给药后 0.5、1.0、2.0、3.0、4.0、6.0、8.0、12.0、24.0、48.0、72、96.0、144 h时,抽取前臂静脉血3.0 mL,分离血清,低温(-20 ℃)保存,待测。文献报道[2,3],本品tmax≈2 h,t1/2≈48 h,根据2000年版《中国药典》“药物制剂生物利用度和生物等效性试验指导原则”的要求,笔者在达峰时间前取样3~4个点,在峰时间后取样8~10个点,取样持续到5个半衰期以上。
2.3 血清样品检测(微生物杯碟法)
2.3.1 标准液的配制:准确称取阿奇霉素标准品,用无水乙醇溶解后加缓冲液(pH7.8)稀释成1 mg·mL-1标准贮备液,置-40 ℃储存备用。
2.3.2 指示菌:选用藤黄微球菌[编号28001][2,3]。
2.3.3 培养基Ⅱ号[4]:蛋白胨6 g,牛肉浸膏1.5 g,酵母浸膏6 g,葡萄糖1 g,琼脂20 g,蒸馏水1000 mL,调pH 7.8~8.0,在115℃灭菌30 min后备用。
2.3.4 测定方法:参照文献[5],将培养基Ⅱ号熔化后冷至约50℃,加入适量藤黄微球菌菌液,混匀,于超净工作台上倒入经高压灭菌的平皿中(12 mL/皿),冷凝后放入不锈钢小杯,每个血样分别加入2个小杯,同时另放2个小杯,内加标准液。静置相同时间后,置37℃孵育14~16 h,取出,以游标卡尺测量抑菌圈直径,按标准曲线计算血液标本中的药物浓度。
2.4 方法学验证
2.4.1 标准曲线的制备:以正常人血清配制系列阿奇霉素标准液(浓度为2.4、1.2、0.6、0.3、0.15、0.075、0.038、0.019、0.009和0.005 μg·mL-1),组间距1∶2,中心浓度为0.1 μg·mL-1,用磷酸盐缓冲液(pH7.8)和正常人血清各半作为稀释液。测定抑菌圈,以血药浓度的对数为纵座标(Y),抑菌圈的直径为横标(X),作直线回归,得标准曲线方程Y=0.12657X-0.30464(r=0.9988),结果表明,阿奇霉素血药浓度在0.005~2.4 μg·mL-1范围内线性关系良好。本法最低检测浓度为0.005 μg·mL-1。
2.4.2 回收率及精密度试验:按照标准曲线制作方法,采用4种浓度的阿奇霉素标准液,各配制若干份,分别测定其抑菌圈,得出日内相对标准差(RSD)和回收率(见表1);并于日间按上述浓度测定方法计算出日间RSD和回收率。
2.4.3 冻融试验:将含药血清反复冷冻(-20℃)、溶解,1周内测定4次,结果见表2。
3 结果
3.1 药-时曲线
受试者单剂口服QLAZ厂和其余5厂家生产的阿奇霉素胶囊或片剂500 mg后,平均药-时曲线见图1。
3.2 数据处理
采用3p97计算机程序软件,计算各个体的药动学参数,cmax、tmax以实测值计算,AUC按梯形面积法计算。取值范围0~144 h。6厂家生产的阿奇霉素制剂在人体内的药动学参数见表3。
4 讨论
药物制剂要产生最佳疗效,其药物活性成分应当在预期时间段内释放、吸收并被转运到作用部位达到预期的有效浓度。大多数药物是进入血液循环后产生全身治疗效果,作用部位的药物浓度和血液中药物浓度存在一定的比例关系,因此可以通过测定血液循环中的药物浓度来获得反映药物体内吸收程度和速度的主要药动学参数,间接预测药物制剂的临床治疗效果,以评价制剂的质量。本研究血药浓度药-时曲线如图1所示,SCAZ、HZAZ和SJZAZ厂药物cmax分别为(0.38±0.13)、(1.07±0.53)和(1.24±0.75)μg·mL-1,明显低于参比制剂的(1.69±0.53)μg·mL-1(P<0.01)。按照此血药浓度推测,则SCAZ、HZAZ和SJZAZ厂制剂临床治疗效果是不如QLAZ厂制剂的临床治疗效果,或不能达到有效治疗效果。发生原因可能是各生产厂家药物的理化性质、剂型特征、所用辅料、制备工艺有所差异,值得调整制剂生产工艺等。
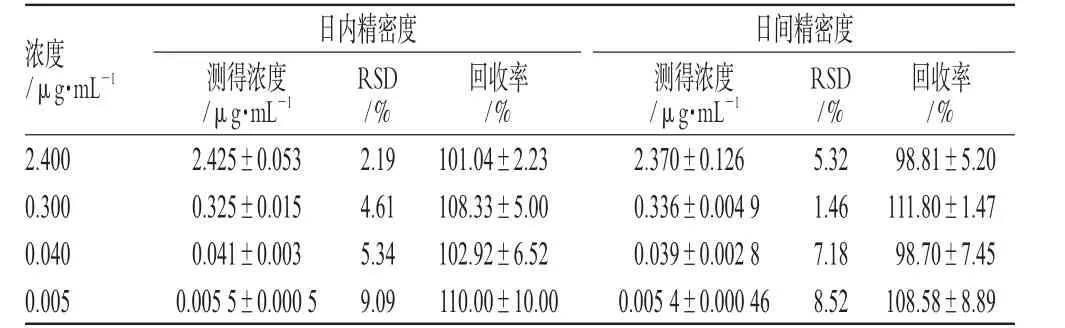
表1 精密度及回收率试验结果(n=6)Tab 1 Results of precision and recovery tests(n=6)

表2 冻融稳定性试验结果(n=4)Tab 2 Result of frozen-melt tests(n=4)
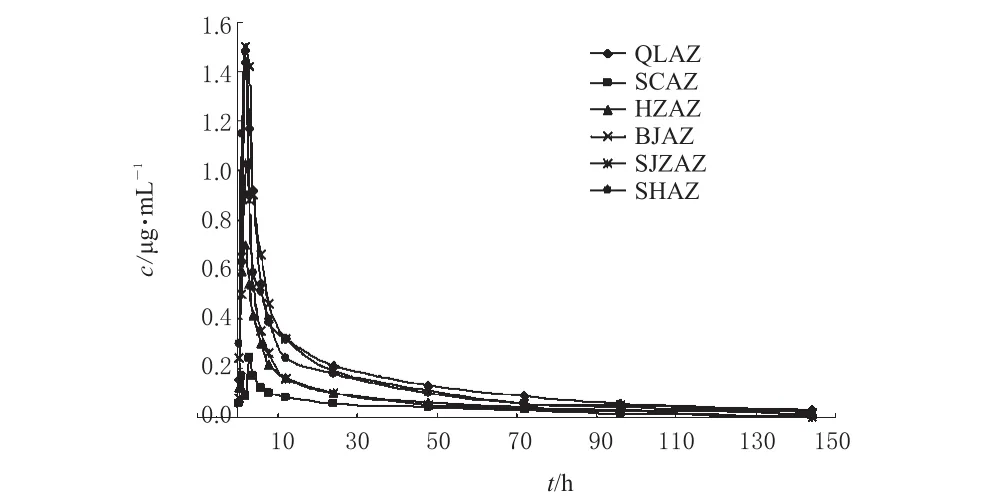
图1 健康受试者口服6种阿奇霉素制剂后的平均药-时曲线Fig 1 Mean serum concentration-time curves of azihromycin in healthy volunteers after oral administration of azihromycin preparations
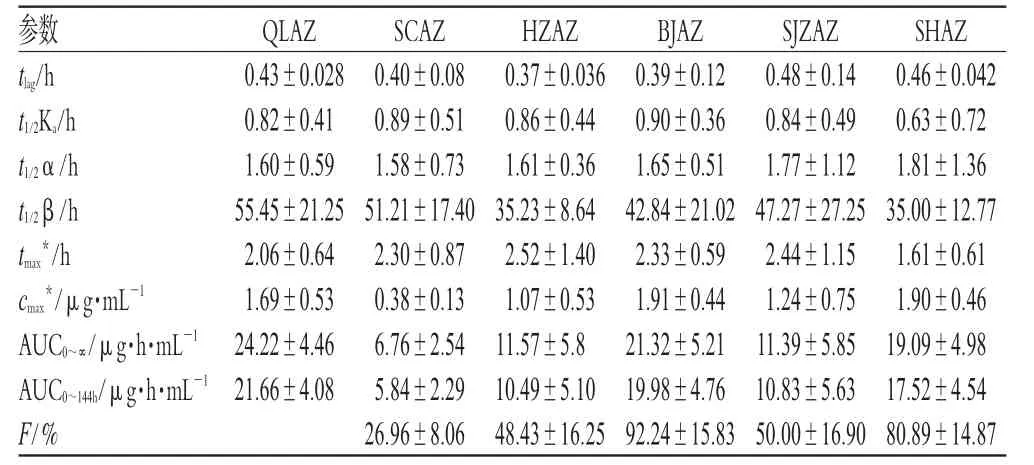
表3 6厂家生产的阿奇霉素制剂在人体内的药动学参数比较Tab 3 Comparison of the pharmacokinetics parameters of azihromycin preparations from 6 manufacturers in human body
生物利用度是反映药物活性成分吸收进入体内的程度的指标。目前,大家都认识到相同活性成分的仿制产品要替代其他原创制剂进入临床使用时,应与原创制剂有生物等效性,即生物利用度相近似。本研究结果表明,各生产厂家的生物等效性相差较大,提示各制剂使用后被吸收的速度和程度不一,可能对使用者的治疗目的造成一定影响,值得生产厂家在制剂进入市场前进一步验证其生物利用度。
[1]陈新谦,金有豫,汤 光主编.新编药物学[M].第15版.北京:人民卫生出版社,2005:90.
[2]张 青,郭蓓宁,张婴元.阿奇霉素临床药代动力学研究[J]. 中国临床药理学杂志,1996,12(2):89.
[3]贾琳静,乔海灵,张莉蓉,等.阿奇霉素颗粒剂的健康人体药物动力学和相对生物利用度[J].河南医科大学学报,2001,36(6):712.
[4]国家药典委员会编.中华人民共和国药典(二部)[S].2000年版.北京:化学工业出版社,附录ⅪA:81.
[5]张治锬编著.抗生素药品检验[M].北京:人民卫生出版社,1987:34.

