鸡传染性支气管炎病毒ck/CH/LHB/100801株的分离鉴定及分子特征研究
马会杰,刘孝珍,韩宗玺,邵昱昊,孔宪刚,刘胜旺*
(1.东北农业大学,黑龙江 哈尔滨 150030;2.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/禽传染病研究室,黑龙江 哈尔滨 150001)
鸡传染性支气管炎(Infectious Bronchitis,IB)是由IB病毒(IBV)引起的一种急性、高度接触性传染性呼吸道疾病,主要导致蛋鸡产蛋量和蛋品质下降,肉鸡增重和饲料报酬下降,给养禽业造成严重的经济损失[1]。根据IBV对组织的亲嗜性、损害的主要器官、引起的主要症状,将IBV分为呼吸型、肾型和肠型等[2]。
IBV为套式病毒目冠状病毒科冠状病毒属γ冠状病毒[3]。IBV基因组为不分节段的单股正链RNA,全长约27.6 kb[4]。IBV在感染细胞内产生具有共同3'末端的6种亚基因组mRNA(1~6),分别编码结构蛋白和非结构蛋白(NSP)[5]。其中mRNA1编码RNA多聚酶,含有1a和1b两个ORF[6]。mRNA2、mRNA3、mRNA4和mRNA6分别编码4个结构蛋白:纤突蛋白(S)、小膜蛋白(E)、膜蛋白(M)和核蛋白(N)[7]。而S蛋白被裂解为S1和S2亚基,均含有中和性抗原表位[8]。S1亚基决定IBV的血清型,并对细胞嗜性起重要作用[9]。IBV的3种结构蛋白中,M蛋白基因比较保守,而N蛋白在病毒的复制和转录中起作用,主要是与病毒RNA结合形成核衣壳[10]。mRNA3位于S基因与M基因之间,编码3个蛋白,分别为3a、3b和E,其中3a和3b为病毒的附属蛋白。mRNA5编码5a和5b两个附属蛋白。
近年来,尽管我国广泛使用IB疫苗,但肾型IB仍然频繁发生。本研究从河北省唐山市某鸡场发病鸡群濒死鸡的肾脏中分离一株病毒,经鉴定为IBV,并与台湾分离株TW2296/95的基因序列同源性高达99.8%。
1 材料和方法
1.1 实验材料 病料样品为2010年8月采集自河北省唐山市某鸡场鸡群疑似IB濒死病鸡的肾脏样品;SPF鸡胚购自中国农业科学院哈尔滨兽医研究所实验动物中心;扩增IBV全序列的19对引物为参照已发表的Beaudette(M95169)IBV株相应序列设计(如需要作者可提供),由TaKaRa公司合成;鼠源反转录酶(M-MLV)和TRIzol均购自Invitrogen公司;DNA片段快速纯化/回收试剂盒购自OMEGA公司;ExTaqDNA聚合酶、pMD18-T、DNA Marker(D515A)、5'-Full RACE Kit和 3'-Full RACE Core Set Ver.2.0购自TaKaRa公司;受体菌JM109由本实验室制备并保存。
1.2 病毒的分离与鉴定 参照文献[11]方法进行病毒的分离与鉴定,并将阳性鸡胚制备负染样品,进行电镜观察。
1.3 病毒RNA的提取和RT-PCR扩增 收集鸡胚尿囊液,提取总RNA,并以其为模板,以[N(-)]:5'-ACGCGGAGTAGGATCGAGGGTACA-3'为引物,于37℃反应2 h进行反转录。并进行PCR扩增,反应条件为:95℃ 5 min;94℃ 1 min、50℃ 1 min、72℃ 2 min,30个循环;72℃ 10 min。基因组5'末端和3'末端的扩增参照5`-Full RACE和3`-Full RACE使用说明书进行。
1.4 PCR产物的克隆和测序 将扩增片段分别连接于pMD18-T载体中,转化受体菌JM109,37℃培养8 h~12 h后,挑取白色单菌落,提取重组质粒,采用PCR法鉴定为阳性后,由北京六合华大基因科技股份有限公司进行测序。
1.5 ORF的确定和序列分析 应用Gene Runner 3.0软件对测序结果进行序列编辑和确定ORF,应用DNAStar中MEGALIGN程序对病毒株全序列进行拼接和比对,并进行S1基因的进化树分析。
2 结果
2.1 病毒的分离与鉴定 接种病料组织上清液的SPF鸡胚,在盲传第二代后鸡胚出现病变,表现为胚体卷曲、弥漫性出血、羊膜增厚。其尿囊液均不凝集鸡外周血红细胞,表明鸡胚尿囊液中不含正粘病毒、副粘病毒和腺病毒等。病毒颗粒在电镜下呈球形,直径约80 nm~120 nm,囊膜表面有疏松排列的棒状纤突,呈典型的冠状病毒颗粒的形态学特征,将分离病毒株命名为ck/CH/LHB/100801。
2.2 ck/CH/LHB/100801全基因组序列扩增、克隆及测序 从ck/CH/LHB/100801病毒RNA中分别扩增出17条与预计大小相符的片段。同时通过5'-RACE和3'-RACE得到基因组5'末端和3'末端两个扩增产物。将扩增片段分别克隆于pMD18-T载体中,筛选重组阳性质粒,每个片段选择5个以上独立克隆进行测序,保证病毒株序列测定的准确性。
2.3 ck/CH/LHB/100801全基因序列测定 将病毒基因组中获得的19个首尾重叠的基因片段进行拼接,与参考病毒株Beaudette进行比较,显示分离株ck/CH/LHB/100801基因组的组成特征为:5'-1a-1b-S-3a-3b-E-M-5a-5b-N-3',符合IBV基因组组成特征(表1)。测定的ck/CH/LHB/100801基因组全长为27675 kb,与TW2296/95株具有较高的核苷酸同源性,点突变、缺失、插入随机分布于整个基因组中。

表1 ck/CH/LHB/100801推测的ORFTable 1 Open reading frames encoded in ck/CH/LHB/100801 genome
2.4 ck/CH/LHB/100801 ORF1的遗传特征 ck/CH/LHB/100801 ORF1全长 19940 bp,包含 2个 ORF,即ORF1a和ORF1b。其中,ORF1a全长11910 bp,编码3969个氨基酸残基组成的多肽;ORF1b由7959个核苷酸组成,可编码2652个氨基酸残基组成的多肽。ck/CH/LHB/100801与TW2575/98株ORF1a核苷酸及推导的氨基酸序列同源性最高,分别为95.7%和 96.3%。ORF1中包含 14个 NSP,对ck/CH/LHB/100801 NSP2~NSP15氨基酸序列同源性分析显示,ck/CH/LHB/100801与TW2575/98株NSP2~NSP15同源性均在 94.7%以上(表 2)。ck/CH/LHB/100801与TW2575/98株具有相同的“滑脱序列”,即 TTTAAAC。在 ORF1a区,ck/CH/LHB/100801与参考株TW2575/98相比,缺失了18个碱基,主要分布在核苷酸第2983位~2997位,5085位,6971位~6973位,导致推导的氨基酸序列在第993位~997位连续缺失5个残基,2325位缺失1个残基;另外,在第5068位插入1个碱基,从而导致氨基酸序列在1685位~1690位6个残基突变。ck/CH/LHB/100801与TW2575/98株ORF1b核苷酸及推导的氨基酸序列同源性分别为94.5%和97.8%,由于点突变造成了58个氨基酸残基突变。
2.5 ck/CH/LHB/100801结构蛋白基因的遗传特征ck/CH/LHB/100801 S基因序列测定结果表明,分离株ck/CH/LHB/100801 S基因开放阅读框由3492个核苷酸组成,编码1163个氨基酸残基组成的多肽。推测S蛋白裂解后形成的S1亚单位由1614个核苷酸组成,编码含538个氨基酸残基的多肽,S2亚单位由1878个核苷酸组成,编码625个氨基酸残基组成的多肽。
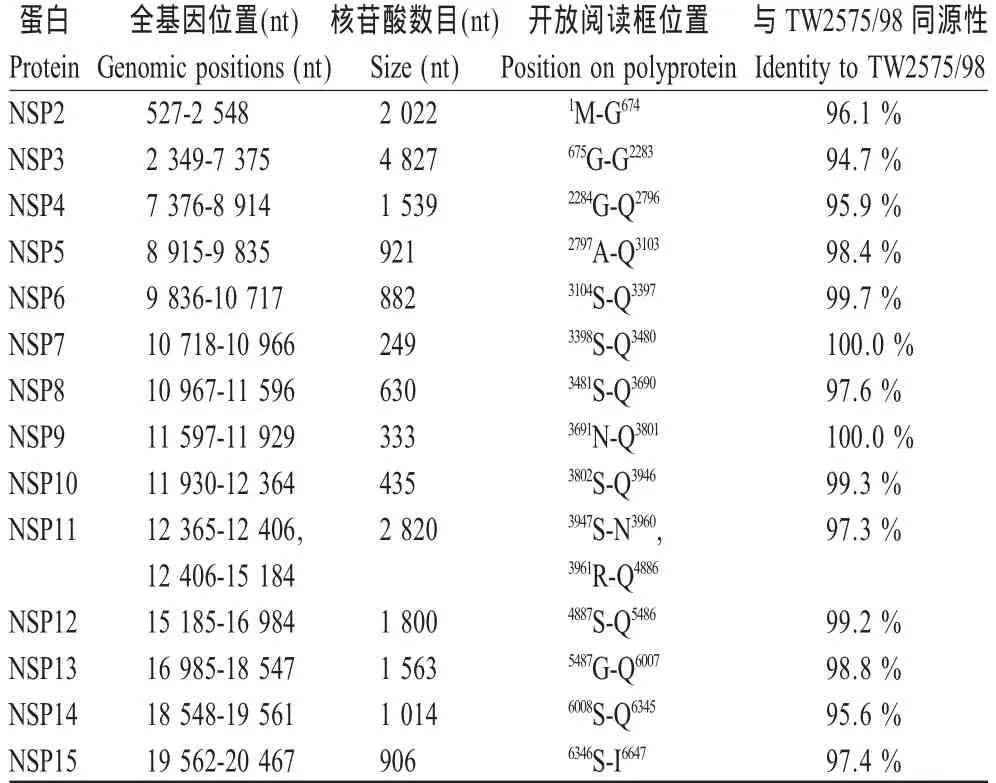
表2 ck/CH/LHB/100801 ORF1非结构蛋白同源性比较Table 2 ck/CH/LHB/100801 ORF1 non-structural proteins for homology comparison
ck/CH/LHB/100801与57株参考病毒株的S基因比较,核苷酸序列同源性在77.4%~99.6%之间,推导氨基酸序列同源性在76.7%~98.7%之间。在进化树分析中,ck/CH/LHB/100801与57株参考病毒株分为10个群:ck/CH/LHB/100801与台湾参考株TW2296/95、3263/04和T07/02之间核苷酸同源性较高,分别为99.6%、95.6%和94.4%。而且ck/CH/LHB/100801与台湾分离株TW2296/95为第Ⅱ群,两者氨基酸同源性最高(图1)。国内分离株与我国常用疫苗株及国外病毒株分别位于其他群,与ck/CH/LHB/100801 S1基因编码的氨基酸同源性低于第Ⅱ群,在77.3%~83.8%之间;与H120、M41和Beaudette等Mass型参考株S1基因同源性为82.8%~83.8%。与参考株HBN核苷酸序列差异较大,同源性为77.4%。ck/CH/LHB/100801与台湾分离株TW2296/95相比,S1基因核苷酸的突变为7处,只有6处为有义突变,氨基酸同源性达98.7%;S2基因核苷酸的突变仅为4处,导致推导的氨基酸序列有3个氨基酸发生变异,氨基酸同源性达99.5%(表 3)。
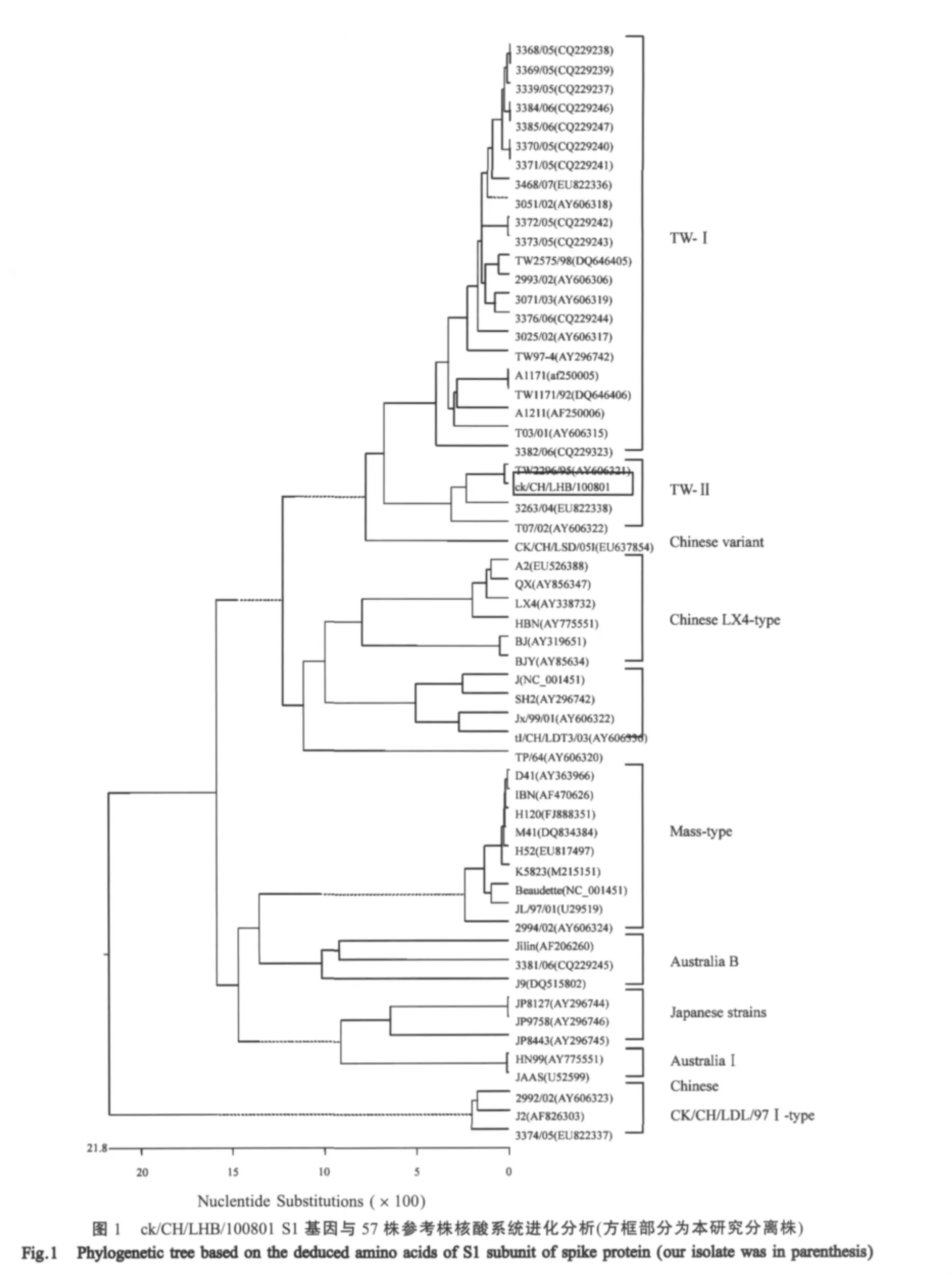

表3 ck/CH/LHB/100801与TW2296/95 S基因碱基及氨基酸比对Table 3 Pairwise comparison of nucleotides and amino acids of the S gene of ck/CH/LHB/100801 with TW2296/95
ck/CH/LHB/100801 M基因由666个核苷酸组成,编码221个氨基酸残基。ck/CH/LHB/100801 M基因与台湾参考株 A1171、2292/02、2294/02、TW2296/95、TW2575/98、3071/03、3263/04、3374/05和3468/07之间核苷酸序列同源性在88.6%~99.7%之间,推导氨基酸序列同源性在88.7%~94.1%之间。ck/CH/LHB/100801 M基因与TW2296/95相比存在两处氨基酸残基突变,第126位由异亮氨酸残基突变为苏氨酸残基,第189位由丙氨酸残基突变为苏氨酸残基。
ck/CH/LHB/100801 N基因由1230个核苷酸组成,编码409个氨基酸残基,ck/CH/LHB/100801 N基因与台湾参考株TW2296/95同源性为100%。
2.6 ck/CH/LHB/1008015'UTR和3'UTR的序列及部分结构分析 ck/CH/LHB/1008015`UTR由527个核苷酸组成,与TW2575/98相似性为99.2%,两者前导序列在5'UTR中,均为64 nt,其末端为基因1的转录调节序列(TRS),并且均为“CTTAACAA”。
ck/CH/LHB/1008013'UTR由465个核苷酸组成,对ck/CH/LHB/100801与8株台湾参考病毒株3'UTR进行序列分析表明,ck/CH/LHB/1008013'UTR在N基因下游第7位存在连续49个核苷酸缺失,并在118位缺失1个腺嘌呤(图2)。

3 讨论
本实验从河北省某鸡场鸡群中分离一株IBV,该分离株的全基因组序列长为27675 bp,3'末端编码的结构基因与台湾分离株TW2296/95株对应序列同源性高达99.8%。此外,对S1基因进化关系研究显示,ck/CH/LHB/100801与TW2296/95同属于TWⅡ型。ck/CH/LHB/100801 S基因的TAS和其ORF起始密码子ATG之间的核苷酸数目与TW2575/98及国内大部分分离株相同,均为52 bp,S蛋白切割识别位点序列为534RRFRR538。ck/CH/LHB/100801与TW2296/95 S1基因同源性达99.6%。ck/CH/LHB/100801与台湾分离株TW2296/95相比,ck/CH/LHB/100801 S1基因核苷酸的突变为7处,其中6处为有义突变,S2基因核苷酸的突变仅为4处,导致推导的氨基酸序列有3个氨基酸发生变异,表明ck/CH/LHB/100801 S基因突变过程中存在静默突变。在不同IBV病毒株,尤其地理位置相距较远的地区分离株之间,这种S基因的高度同源性较罕见,因此两分离株间可能存在联系。中国内陆地区与台湾地区存在一定的地域隔离,然而近年来两岸的IBV存在相关性。2004年在台湾分离到的2292/02与本实验室分离的CK/CH/LDL/97I和CK/CH/LDL/98I具有很高的同源性[12]。一般认为其他禽类长距离迁徙可能造成IBV远距离传播[13],因而我们推测两岸IBV的重组可能是由于携带IBV变异株的其他禽类迁徙所造成,同时也不能排除禽产品输入及疫苗不当使用过程中造成的外来病毒株的传播。
本研究结果表明ck/CH/LHB/100801的基因分群不属于我国近年的主要流行株。在中国大陆,目前已发现不少于9个型的IBV在免疫和非免疫鸡群中存在和流行;此外,还存在大量的变异病毒株[14]。
本研究首次在中国大陆分离到TWⅡ型病毒株,该病毒株不同于中国大陆流行的其他型病毒,而且根据S1基因同源性分析表明其与国内常用Mass型疫苗同源性低于85%,属不同型病毒。这种外来型的IBV不断传入大陆鸡群的现象提示疫苗、禽类及其产品的贸易中疫病监测的重要性,同时也表明中国大陆IBV存在和流行的复杂性,给该病的防控造成困难。
[1]Cavanagh D.Coronaviruses in poultry and other birds[J].Avian Pathol,2005,34(6):439-448.
[2]王玉东,王永玲,张子春,等.鸡腺胃型传染性支气管炎病毒(QXIBV)的分离和鉴定[J].中国动物检疫,1998,15(1):1-3.
[3]De Wit J,Swart W,Fabri T.Efficacy of infectious bronchitis virus vaccinations in the field:association between the IBV IgM response,protection and vaccine application parameters[J].Avian Pathol,2010,39(2):123-131.
[4]Boursnell M E G,Brown T D K,Foulds L J,et al.Completion of the sequence of the genome of the coronavirus avian infectious bronchitis virus[J].J Gen Virol,1987,68:57-77.
[5]Meulemans G,Van den Berd T P.Nephropathogenic avian infectious bronchitis viruses[J].World's Poultry Sci,1998,54:145-153.
[6]Liu D X,Brown T D.Characterisation and mutational analysis of an ORF 1a-encoding proteinase domain responsible for proteolytic processing of the infectious bronchitis virus 1a/1b polyprotein[J].Virol,1995,209(2):420-427.
[7]Cavanagh D.Coronavirus avian infectious bronchitis virus[J].Vet Res,2007,38:281-297.
[8]Wang Ching-ho,Huang Yuan-pin.Relationship between serotypes and genotypes based on the hypervariable region of the S1 gene of infectious bronchitis virus[J].Arch Virol,2000,145:291-300.
[9]Cavanagh D,Davis P J,Daarbysire J H,et al.Coronavirus IBV viral retaining spike glycopolypeptide S2 but not S1 is unable to induce virus-neutralizing or haemagglutination-inhibiting antibody,or induce chicken tracheal protection[J].Gen Virol,1986,67:1435-1442.
[10]Ignjatovie J,Galli L.Immune responses to structural proteins of avian infectious bronchitis virus[J].Avian Pathol,1995,22:313-332.
[11]龚利洋,张庆霞,韩宗玺,等.鸡传染性支气管炎病毒CK/CH/LHLJ/04V的分离鉴定及致弱的初步研究[J].中国预防兽医学报,2007,29(10):748-752.
[12]Chen Hui-wen,Huang Yuan-pin,Wang Ching-ho,et al.Identification of Taiwan and China-like recombiant avian infectious bronchitisvirusesin Taiwan [J].Virus Res,2009,140:121-129.
[13]Cavanagh D.Coronaviruses in poultry and other birds[J].Avian Pathol,2005,34:439-448.
[14]Han Zong-xi,Sun Chu-yang,Yan Bao-long,et al.A 15-year analysis of molecular epidemiology of avian infectious bronchitis coronavirus in China[J].Infect genet evol,2010,09,002.

