一株锦鲤疱疹病毒的分离与鉴定
朱 霞,李新伟,王 好,吕文亮,周井祥
(1.吉林农业大学动物生产及产品质量安全教育部重点实验室,吉林 长春 130118;2.吉林农业大学动物科技学院,吉林 长春 130118)
锦鲤疱疹病毒病(Kio herpesvirus disease,KHVD)是由锦鲤疱疹病毒(Kio herpesvirus,KHV)感染引起锦鲤、鲤鱼及其普通变种如框镜鲤等的一种高度传染性、致死性疾病。该病主要发生在春秋季节,水温18℃~28℃易发病,23℃~28℃易暴发流行。但是,目前该病具有在低温下发病的趋势[1]。KHV感染宿主范围狭窄,仅感染锦鲤、鲤鱼及其普通变种,而与鲤鱼种系相近的其他鱼类在适宜温度下也不发病;成鱼和鱼苗均可感染,但成鱼更易感,并且死亡率较高[2]。
KHVD于1998年首次在以色列的Magan Michael地区和美国爆发,病原鉴定为KHV[3]。同年,该病在英国爆发后,几乎蔓延至整个欧洲。2002年4月,印度尼西亚发生KHVD,我国广东省锦鲤也疑似发生该病[4]。同年12月我国台湾省检测到锦鲤感染KHV,韩国和马来西亚也较早发现该病[1,5]。2003年10月首次在日本证实了该病的存在[6];南非也于2003年报道了该病。由此可见,锦鲤和鲤鱼的国际性贸易以及缺乏相应的检测制度已经导致KHVD呈全球性分布。
2003年以来,我国东北地区的框镜鲤和普通鲤鱼爆发疾病,死亡率高达80%~90%,PCR检测为KHV阳性。KHVD给我国框镜鲤、鲤鱼的养殖业造成严重的经济损失。本研究在国内首次分离获得一株KHV,为预防和控制该病的研究奠定了基础。
1 材料和方法
1.1 病料样品及实验动物 患病鲤鱼采自辽宁省某渔场,充氧运输至实验室;健康框镜鲤和鲤鱼购自长春市某渔场。
1.2 主要试剂 新生牛血清、M199培养基购自GBICO公司;ExTaqDNA聚合酶、pMD18-T载体均购自TaKaRa公司;E.coliDH5α购自北京全式金生物技术有限公司;DNA胶回收试剂盒购自天跟生化有限公司;质粒小量提取试剂盒购自北京索来宝科技有限公司。
1.3 病毒分离
1.3.1 细胞培养 按照文献[7]和文献[8]的组织块培养法,将无菌处理的框镜鲤尾鳍剪碎成大约1 mm3块,接种于细胞培养瓶,以含20%FCS的M199培养基,26℃5%CO2恒温培养箱中培养,20 d~25 d长满单层。采用胰酶将细胞消化传代,并命名为框镜鲤鱼鳍细胞(KFC)。
1.3.2 病毒的分离 按照文献[9]中方法进行,采取活体患病鱼的肾细胞,制备成悬液与KFC单层细胞在22℃的条件下共培养。逐日观察细胞病变(CPE),收集CPE达70%~80%的细胞及上清液,保存于-20℃。同时设立不感染细胞对照。
1.4 电镜观察 将反复冻融2次的病毒培养物离心,取沉淀物以0.5%磷钨酸进行常规负染,透射电子显微镜下观察并拍照。
1.5 PCR鉴定及序列分析
1.5.1 引物设计与合成 参考GenBank登录的3个KHV株基因序列,选取保守的ORF25基因,应用primer5.0软件设计引物,P1:5'-GATATCATGTCAT GTTCCATCCGCCA-3';P2:5'-GAATTCTTAGGTGG CGTTGAGGTC-3',PCR扩增产物预期为849 bp。引物由上海生工生物工程技术服务有限公司合成。
1.5.2 病毒DNA的提取与PCR鉴定 将收集的病毒培养物反复冻融2次,碱裂解法提取病毒DNA,并进行PCR扩增。PCR反应条件为:95℃5 min;94℃ 40 s、55℃ 30 s、72℃ 1 min,35个循环;72℃10 min。扩增产物以琼脂糖凝胶电泳鉴定。
1.5.3 目的基因的回收与连接 PCR产物经纯化后连接于pMD18-T载体中,转化E.coliDH5α感受态细胞,在含有氨苄青霉素的LB琼脂平板上筛选单菌落,LB培养基中200 r/min振荡培养过夜,提取重组质粒,以EcoRⅠ和EcoRⅤ进行双酶切鉴定。1.5.4 序列比较及进化树绘制 阳性重组质粒由北京六合华大基因科技股份有限公司进行序列测定。利用DNAStar软件将测序结果与GenBank登录的参考病毒株进行序列同源性分析并构建系统进化树。
1.6 病毒效价测定及动物感染试验
1.6.1 毒价测定 将病毒液进行10倍系列稀释,分别接种96孔板培养的KFC单层细胞,每个稀释度进行8孔重复,22℃吸附1 h后,加入含5%新生牛血清的M199维持液,22℃继续培养,同时设阳性对照孔(未稀释的细胞毒)和阴性对照孔(维持液),逐日观察记录CPE,采用Karber法计算TCID50效价。
1.6.2 动物感染试验 选用体质量约500 g的健康鲤鱼30尾,实验室饲养观察4周无任何病症。以病毒培养物原液(TCID50效价为10-6.75)腹腔注射途径接种实验鱼20尾,每尾1 mL,维持水温在20℃~24℃;同时设未接种病毒对照鱼10尾。逐日观察试验组的临床症状。由表现临床症状的鱼组织中提取病毒DNA,进行PCR鉴定。取发病鱼鳃和肾脏组织进行病理切片检查。
2 结 果
2.1 病毒分离 将KFC与感染鱼肾细胞共培养,5 d~6 d后出现细胞体积增大及少量的细胞质空泡化,10 d后病变明显,细胞脱落;对照细胞生长良好。当CPE达到70%~80%时收取病毒。病毒分离过程中产生的CPE与Pikarsky等描述一致[10]。将第一代KHV培养物接种健康细胞,3 d~5 d出现典型CPE,7 d~9 d细胞开始脱落(图1)。

2.2 电镜观察 在透射电子显微镜下观察到典型的KHV粒子,病毒直径约为100 nm,二十面体对称,病毒粒子有囊膜,核衣壳表面有螺纹样结构(图2),与文献描述相符[9]。但本实验电镜观察到某些病毒粒子的囊膜生长不完全,即未成熟病毒。

2.3 PCR鉴定及序列分析
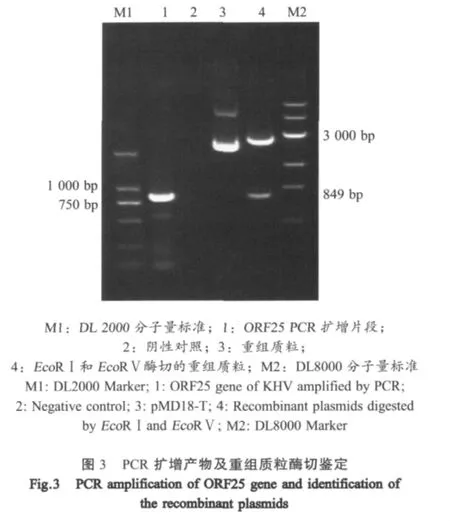
2.3.1 病毒基因的克隆及鉴定 将ORF25基因进行PCR扩增,产物凝胶电泳检测结果显示,扩增出约800 bp的特异性片段(图3);将其连接至pMD18-T载体中,经EcoRⅠ和EcoRⅤ酶切鉴定,含有目的片段(图3),与预期相符。
2.3.2 序列测定和分析 将测序结果与GenBank中登录的KHV序列进行比较,结果表明,ORF25基因与参考病毒株KHV-I、KHV-U和KHV-J的同源性均为99.9%。将分离株命名为KHV-cj。氨基酸序列分析表明,KHV-cj存在一个氨基酸位点的突变:第239位E突变为K。氨基酸抗原性分析表明该片段抗原性较好。
2.4 病毒毒价测定及动物感染试验
2.4.1 病毒毒价测定 经检测,KHV-cj第二代细胞培养物的TCID50效价为10-6.75。
2.4.2 实验鱼发病情况 实验鱼感染KHV-cj 4 d~5 d后,表现反应迟钝、食欲不振、皮肤出现灰白色斑点、体表粘液分泌增多、某些病鱼鳍基部及体表出血、随后鳃组织出血、有白色坏死斑,剖检肾脏可见出血点。感染后第8 d开始死亡。在感染后第30 d,发病率为100%(20/20),死亡率达75%(15/20)。对照鱼无临床症状。
2.4.3 PCR鉴定 采取出现临床症状的实验鱼鳃或肾脏组织,提取核酸,利用ORF25基因引物进行PCR扩增,得到849 bp的特异性目的片段。
2.4.4 病理学变化 采取感染后3 d实验鱼鳃组织,病理切片观察显示:鳃薄片减少,存在炎性细胞浸润;濒死鱼鳃组织表现鳃结构消失、鳃弓内血管充血、鳃耙变细;肾小管周围存在炎性细胞;濒死鱼肾脏出现严重的间质性炎症,并伴随血管充血。
3 讨 论
研究显示,KHV仅在KF-1、普通鲤鱼脑以及原始宿主细胞中增殖[8,11]。Calle等报道利用常用的鱼类细胞系较难分离到KHV,刘荭等也证实KHV无法在CO、CK和EPC鱼类细胞内复制[4]。因此,本研究选择框镜鲤尾鳍传代细胞进行KHV的分离。另外,有报道表明,较难从死亡时间稍长或冻存后的组织中分离到该病毒,而且肾脏是KHV增殖效率最高的器官[10,12]。因此,本研究采用活患病鱼的肾脏组织进行KHV分离,大大提高了病毒的分离几率。
KHV是鱼类疱疹病毒属中基因组最大的病毒,含有156个ORF,其中只有少数已经确定功能,根据Aoki等的报道,ORF25基因编码膜糖蛋白,在KHV的3个分离株中均未发生突变,属于较为保守的基因序列[13]。病毒的膜糖蛋白参与病毒吸附和穿入过程、病毒诱导的细胞融合过程及病毒从核膜出芽、释放过程等[14]。本研究中获得ORF25基因849 bp的部分片段,经氨基酸序列分析表明,有一个氨基酸位点发生突变,而氨基酸的抗原性较好。ORF25基因在体外的表达及其功能还需要进一步研究。另外,KHV-cj引起我国框镜鲤和鲤鱼发病,并且在目前具有低温下发病的趋势,是否与该株病毒某一基因的突变密切相关,以及KHV-cj基因突变是否会引起其他问题等还有待于深入研究。
本研究将具有典型KHVD症状鲤鱼的肾细胞悬液接种于MFC细胞,出现典型的KHV CPE,通过电镜观察、PCR鉴定和序列分析以及动物回归试验,表明已分离到KHV。这是我国首次分离到KHV的报道,为我国展开KHV的分子生物学、流行病学、检测与诊断以及免疫和预防等方面的研究提供了试验材料。
[1]朱霞,王好,李新伟,等.锦鲤疱疹病毒病的研究进展[J].中国兽医科学,2011,41(1):106-110.
[2]Dishon A,Perelberg A,Bishara-Shieban J,et al.Detection of carp interstitial nephritis and gill necrosis virus(CNGV)in fish droppings[J].Appl Environ Microbiol,2005,71(11):7285-7291.
[3]Hedrick R P,Gilad O,Yun S,et al.A herpesvirus associated with mass mortality of juvenile and adult koi,a strain of common carp[J].J Aquatic Animal Health,2000,12(1):44-57.
[4]刘荭,史秀杰,高隆英,等.进口锦鲤杯发病病原的nested-PCR鉴定[J].华中农业大学学报,2002,21(5):414-418.
[5]徐达,涂坚,郑穹翔,等.锦鲤疱疹病毒传播媒介之探讨[J].台湾兽医志,2007,33(2):88-95.
[6]Iida T,Sano M.Koi herpesvirus disease[J].Uirusu,2005,55(1):145-151.
[7]Hasegawa S,Somamoto T,Nakayasu C,et al.A cell line(CFK)from fin of isogeneic ginbuna crusian carp[J].Fish Pathol,1997,32:127-128.
[8]Neukirch M,Bottcher K,Bunnajirakul S.Isolation of a virus from Koi with altered gills[J].Bull Eur Assoc Fish Pathol,1999,19:221-224.
[9]Marina H,Ronen A,Perelberg A,et al.Description of an as yet unclassified DNA virus from diseased cyprinus carpio species[J].J Virol,2005,79(4):1983-1991.
[10]Pikarsky E,Ronen A,Abramowitz J,et al.Pathogenesis of acute viral disease induced in fish by carp interstitial nephritis and gill necrosis virus[J].J Virol,2004,78(17):9544-9551.
[11]刘宗晓,刘荭,江育林.锦鲤疱疹病毒病的研究进展[J].检验检疫科学,2006,16(4):77-80.
[12]Gilad O,Yun S,Andree K B,et al.Initial characteristics of koi herpesvirus and development of a polymerase chain reaction assay to detect the virus in koi,Cyprinus carpio koi[J].Dis Aquatic Organisms,2002,48(2):101-108.
[13]Aoki T,Hirono I,Kurokawa K,et al.Genome sequences of three koiherpesvirus isolates representing the expanding distribution of an emerging disease threatening koi and common carp worldwide[J].J Virol,2007,81(10):5058-5065.
[14]杨乔欣.单纯疱疹病毒糖蛋白的研究进展[J].国外医学病毒学分册,2000,7(5):139-141.

