褪黑素对间歇低氧大鼠海马损伤保护作用的研究
李 光,柴文戍,康 健
阻塞性睡眠呼吸暂停 (obstructive sleep apnea,OSA)在西方国家是一种常见的疾病,其发病率在男性约为 4%,女性约为 2%[1]。OSA可引起行为和神经精神障碍,包括日间嗜睡、短期记忆障碍及理解缺陷。不少研究表明,OSA患者存在氧化应激,进而导致海马神经元凋亡增加,与患者的神经功能损害有关[2]。褪黑素 (MEL)是松果体分泌的一种抗氧化剂,具有广泛的抗氧化能力,外源性应用褪黑素可对自由基起保护作用。因此,本研究选用间歇低氧 (intermittent hypoxia,IH)大鼠模型,模拟 OSA存在的缺氧/再复氧病理生理过程,同时应用抗氧化剂褪黑素进行干预,观察褪黑素能否通过增加抗氧化酶的表达来减轻间歇低氧诱导的海马损伤。
1 材料与方法
1.1 实验动物 为体质量 200~230 g的清洁级雄性健康 SD大鼠 (中国医科大学实验动物中心提供),共 30只。
1.2 主要仪器及试剂 间歇低氧造模设备 (Oxycycler Model A84XO;BioSpherix Instruments,Redfield,NY,USA),氧气和氮气,可见光分光光度计,PCR循环仪 (Sigma 2002),紫外分析仪 (UV3l0,以色列),褪黑素 (美国 Sigma公司产品),超氧化物歧化酶 (SOD)、丙二醛 (MDA)测定试剂盒(南京建成生物工程研究所),RT-PCR试剂盒 (Takara公司)。
1.3 间歇低氧大鼠模型的建立 雄性 SD大鼠置于间歇低氧设备(Oxycycler Model A84XO;BioSpherix Instruments,Redfield,NY,USA)中造模,使仓内氧浓度变化于 5%~21%之间,每 8 min循环 1次,最低氧浓度为 5%,最高氧浓度为21%,共 2周 (每天 8∶00~16∶00),对照组 SD大鼠暴露于室内空气中。动物自由进食饮水,动物室温度控制在 22~24℃,相对湿度为 30%~40%,光照 12 h/d(8:00开灯,20:00关灯)。
1.4 实验方法 用随机数字表法将大鼠分为对照组 (CON组)、间歇低氧组 (IH组)、褪黑素治疗组 (MEL组),每组10只,分笼饲养。褪黑素药物使用方法为临用前以无水乙醇溶解,再加 0.9%氯化钠溶液配制,使乙醇浓度为 2%,置 4℃冰箱保存备用,褪黑素 (10 mg/kg)于每天间歇低氧实验前 30 min腹腔注射。实验结束后立即将大鼠从间歇低氧设备中取出用于实验,取出大鼠海马组织,保存在 -80℃冰箱中备用。采用化学比色法测定海马组织 MDA和 SOD水平,并采取 RT-PCR方法检测海马组织中铜/锌超氧化物歧化酶 (Cu/ZnSOD)、谷胱甘肽过氧化物酶 (GPx)、组织过氧化氢酶(CAT)的 mRNA表达水平。
1.5 统计学方法 实验数据用 SPSS 11.5统计软件分析,计量资料以表示,组间比较采用单因素方差分析,p<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠海马组织 MDA水平 CON组为 (1.28±0.03)μmol/g protein,IH组的 MDA水平为 (1.67±0.03)μmol/g protein,MEL组为 (1.39±0.02)μmol/g protein,3组比较差异有统计学意义 (F=533.334,p<0.01);IH组的 MDA水平高于 CON组,褪黑素治疗后 MEL组的 MDA水平低于 IH组,差异均有统计学意义 (p<0.01,见图 1)。
2.2 各组大鼠海马组织SOD水平 CON组为 (60.95±2.99)×103NU/g protein,IH组的 SOD水平为 (44.59±2.67) ×103NU/g protein,MEL组为 (58.24±3.22) ×103NU/g protein,3组比较差异有统计学意义 (F=87.068,p<0.01);IH组的 SOD水平低于 CON组,褪黑素治疗后 MEL组的 SOD水平高于 IH组,差异均有统计学意义 (p<0.01,见图 2)。
2.3 各组大鼠海马组织抗氧化酶 mRNA表达的水平 IH组抗氧化酶 Cu/ZnSOD、GPx、CAT的 mRNA水平比对照组明显减少 (p<0.01),MEL治疗组抗氧化酶的 mRNA水平比 IH组明显增高 (p<0.01,见表1及图 3)。
表 1 各组大鼠海马组织抗氧化酶的平均 mRNA水平比较 Table 1 Comparison of mean mRNA levels of antioxidant enzymes in hippocampal tissues in the different groups of rats
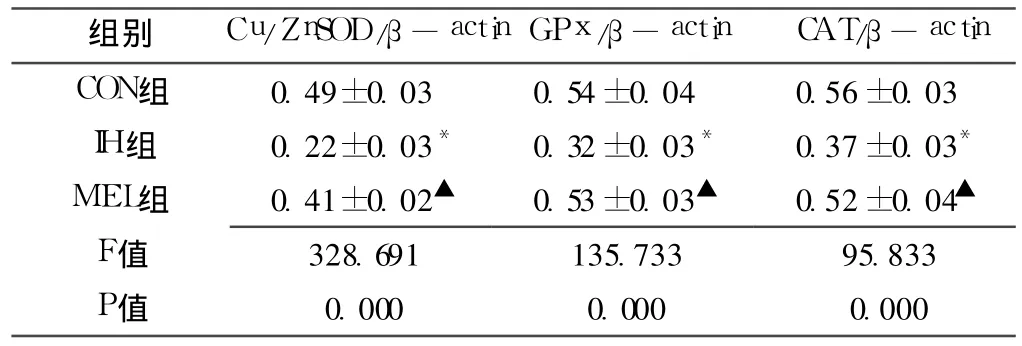
表 1 各组大鼠海马组织抗氧化酶的平均 mRNA水平比较 Table 1 Comparison of mean mRNA levels of antioxidant enzymes in hippocampal tissues in the different groups of rats
注:与 CON组比较,*p<0.01;与 IH组比较,▲p<0.01
组别 Cu/ZnSOD/β-actin GPx/β-actin CAT/β -actin CON组 0.49±0.03 0.54±0.04 0.56±0.03 IH组 0.22±0.03* 0.32±0.03* 0.37±0.03*MEL组 0.41±0.02▲ 0.53±0.03▲ 0.52±0.04▲F值.833 P值 0.000 0.000 0.000 328.691 135.733 95
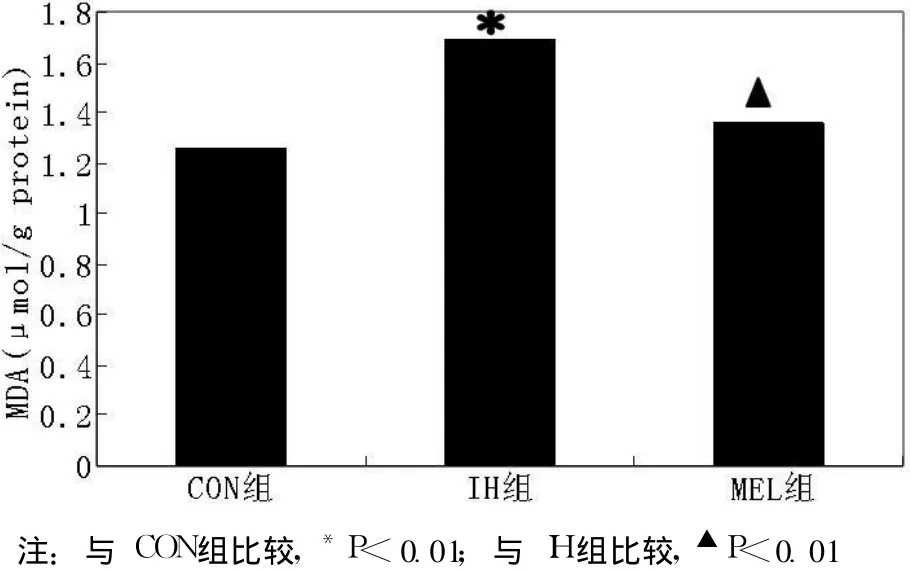
图 1 各组大鼠海马组织 MDA水平比较Figur e 1 Comparison of MDA levels in hippocampal tissues in the different groups of rats
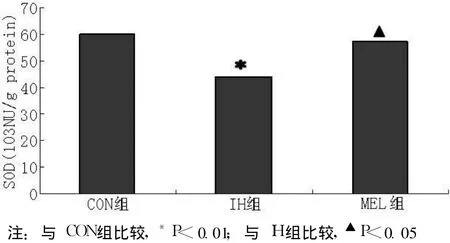
图 2 各组大鼠海马组织SOD水平比较Figur e 2 Comparison of SOD levels in hippocampal tissues in the different groups of rats
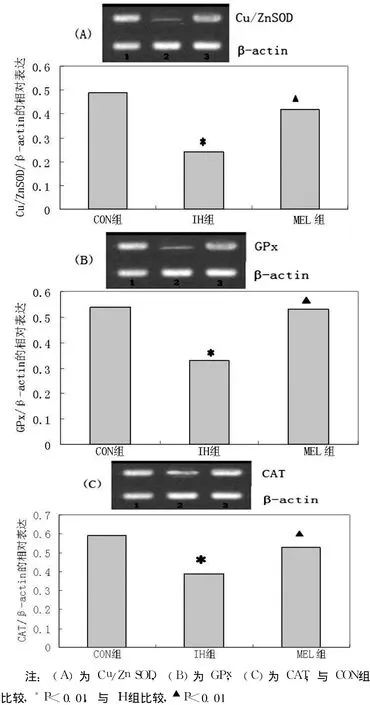
图 3 各组大鼠海马抗氧化酶的平均 mRNA水平比较Figur e 3 Comparison of mean mRNA levels of antioxidant enzymes in hippocampal tissues in the different groups of rats
3 讨论
海马在学习和记忆中起着重要作用,海马组织是富含多不饱和脂肪酸的神经组织结构,易受到自由基的攻击而遭到损伤,即易受氧化应激的损伤。OSA患者的海马损伤可能与 IH诱导的氧化应激有关。氧化应激是 OSA的病理生理机制之一,可以导致神经精神障碍[3-4]。本研究结果表明,在 IH组大鼠的海马组织存在明显的氧化应激状态,MDA水平升高,SOD水平降低,抗氧化酶的表达降低,说明 OSA患者存在的间歇缺氧状态可能导致海马组织的氧化应激状态,进而导致海马损伤。
褪黑素是一种自由基清除剂,具有广谱抗氧化能力。由于具有高度的脂溶性,它可以自由通过血 -脑脊液屏障[5]。由于海马组织含丰富的多聚不饱和脂肪酸并且具有相对较弱的抗氧化能力,使其容易受氧化应激的攻击,因此抗氧化剂褪黑素自由通过血 -脑脊液屏障的能力对其保护海马组织的氧化应激损伤具有重要的意义。本研究发现褪黑素 (10 mg/kg)可以阻止间歇低氧时海马组织 MDA水平的增高,并且降低 SOD的活性,这提示褪黑素可通过自由基清除和生物分子的抗氧化保护来减轻氧化应激。尽管 MEL组 MDA水平未降低到对照组水平,但这反映本研究中间歇低氧实验所用的最低氧浓度(5%)比其他实验 (10%)更低及大脑对间歇低氧的易感性。
抗氧化酶 SOD和 GPx在防御氧化应激方面有重要作用。超氧阴离子被 SOD催化,H2O2被 GPx转化成 H2O,CAT催化H2O2分子转化成 H2O和 O2,在正常情况下,线粒体产生的活性氧自由基 (ROS)能被这些抗氧化酶清除,以保持抗氧化/促氧化的平衡,然而,这些酶的能力被迅速增高的促氧化产物所抵消[6]。另外,氧化应激能调节抗氧化酶的活性和表达[7-9]。本研究结果证实间歇低氧大鼠海马组织抗氧化酶 mRNA的表达水平显著降低。氧化应激可以导致细胞凋亡,抗氧化酶表达的下降是内在机制之一。事实上,褪黑素能直接清除ROS,也能通过上调抗氧化酶进而减轻氧化应激。褪黑素能使抗氧化酶在转录和翻译水平上调[10-11],这也被本研究结果所证实。因此,除了清除自由基,褪黑素也能诱导抗氧化酶的表达,减弱抗氧化/促氧化的不平衡。
总之,褪黑素能通过对抗氧化酶转录水平的调节 (即它的抗氧化特性),来减轻间歇低氧诱导的海马损伤。这提示褪黑素可以用于防治间歇缺氧所致的神经功能损害,为 OSA患者的神经功能损害的防治提供了实验基础。
1 Young T,Palta M,Dempsey J,et al.The occurrence of sleep-disordered breathing among middle-aged adults[J].N Engl J Med,1993,328:1230-1235.
2 Gozal D,Daniel JM,Dohanich GP.Behavioral and anatomical correlates of chronic episodic hypoxia during sleep in the rat[J].J Neurosci,2001,21(7):2442-2450.
3 Malhotra A,White DP.Obstructive sleep apnoea[J].Lancet,2002,360:237-245.
4 Bedard MA,Montplaisir J,Richer F,et al.Obstructive sleep apnea syndrome:pathogenesis of neuropsychological deficits[J].J Clin Exp Neuropsychol,1991,13:950-964.
5 Menendez-Pelaez A,Poeggeler B,Reiter RJ,et al.Nuclear localization of melatonin in different mammalian tissues:immunocytochemical and radioimmunoassay evidence[J].JCell Biochem,1993,53:373-382.
6 Hung MW,Tipoe GL,Poon AM,et al.Protective effect of melatonin against hippocampal injury of ratswith intermittent hypoxia[J].J Pineal Res,2008,44:214-221.
7 Ramanathan L,Gozal D,Siegel JM.Antioxidant responses to chronic hypoxia in the rat cerebellum and pons[J].JNeurochem,2005,93:47-52.
8 Jesudason EP,Baben B,Ashok BS,et al.Anti-inflammatory effect of melatonin on abeta vaccination in mice[J].Mol Cell Biochem,2007,298:69-81.
9 Veasey SC,Davis CW,Fenik P,et al.Long-term intermittent hypoxia in mice:protracted hypersomnolence withoxidative injury to sleep-wake brain regions[J].Sleep,2004,27:194-201.
10 Munoz-Casares FC,Padillo FJ,Briceno J,et al.Melatonin reduces apoptosis and necrosis induced by ischemia/reperfusion injury of the pancreas[J].JPineal Res,2006,40:195-203.
11 Esparza JL,Gomez M,Rosa NM,et al.Melatonin reduces oxidative stress and increasesgene expression in the cerebral cortex and cerebellum of aluminum-exposed rats[J].J Pineal Res,2005,39:129-136.

