炎症性肠病患者肝胆胰病变检出情况研究
杨迅,孟洁
炎症性肠病 (inflammatory bowel disease,IBD)是慢性特发性免疫介导的胃肠道的炎症性疾病,克罗恩病 (Crohn′s disease,CD)和溃疡性结肠炎 (ulcerative colitis,UC)是 IBD最主要的两类疾病。文献报道有 21%~47%的 IBD患者伴有肠外表现[1-3],可累及多个器官。目前针对主要消化器官肝胆胰的并发症的报道不多,尚未引起足够的重视。本研究采用病例对照研究方法,分析我院近 20年 IBD患者各种肝胆胰病变的发生情况,为深化对 IBD并发症及其临床特点的认识和诊治提供参考。
1 资料与方法
1.1 病例纳入标准 入选标准:参照 2010年世界胃肠病学组织 IBD诊断和治疗指南以及世界卫生组织 CD诊断标准[4]:(1)UC:有典型的临床表现 +影像检查阳性或内镜检查阳性+典型的切除标本病理组织学检查,排除诊断:慢性血吸虫病、阿米巴病、肠结核、缺血性结肠炎、放射性结肠炎、结肠部位的 CD。(2)CD:有临床表现 +影像检查阳性或内镜检查阳性 +典型的切除标本病理组织学检查,排除诊断:慢性肠道感染 (小肠结核、阿米巴病等)、性病性淋巴性肉芽肿、放线菌病、肠淋巴瘤、慢性憩室炎、缺血性结肠炎、Behcet病、UC、非甾体类抗炎药 (NSAID)相关性肠病。
1.2 一般资料 收集我院 1990—2010年确诊的 IBD患者 606例,年龄 17~72岁,平均 (37.3±11.6)岁;男 333例,女273例;UC患者 538例 (88.78%),CD患者 68例(11.22%)。UC病变部位:直肠 -乙状结肠 269例,左半结肠 207例,全结肠 62例;CD病变部位:回肠 13例,回肠和结肠 24例,结肠 30例,上消化道 1例。
采用配对的方法,按人数 1∶1,另选择同期我院门诊健康体检者 606例作为对照组,与病例组的年龄、性别、体质指数(BMI)匹配。对照组无 IBD及手术史,无其他慢性系统性疾病史 (包括高血压、糖尿病、血脂异常),无家族遗传病、肿瘤病史,无传染病史,无烟酒嗜好,无有毒物质接触史,无药物中毒性肝损害、NSAID肠病,非妊娠、哺乳期妇女。IBD患者及健康对照者临床资料见表 1。
此外,还收集了一些相对少见的肝胆胰病变,包括原发性胆汁性肝硬化 (PBC)311例、原发性硬化性胆管炎 (PSC)89例、慢性胰腺炎 (CP)213例、自身免疫性肝炎 (AIH)60例、肝淀粉样变性 2例以及 AIH-PSC重叠综合征 5例,均为 1990—2010年在我院确诊的住院患者。
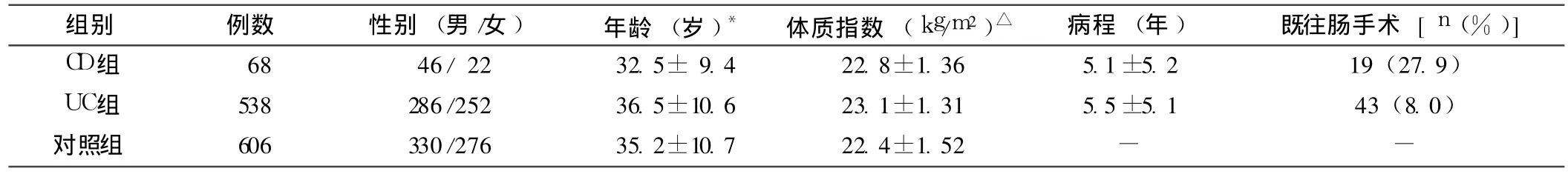
表 1 IBD患者及健康对照者的临床资料Table 1 Clinical characteristics of IBD patients and healthy controls
1.3 方法 比较 IBD组与对照组肝胆胰病变发生情况。(1)肝脏病变:非酒精性脂肪性肝病 (NAFLD)、AIH、PBC、PSC、肝淀粉样变性等。 (2)胆系病变:胆石病、胆管癌。(3)胰腺病变:CP、自身免疫性胰腺炎 (AIP)等。胆石病和 NAFLD诊断主要依据超声、CT等影像学特征性变化[5-6];AIH、PBC、PSC、AIH-PSC重叠综合征、CP、肝淀粉样变性等疾病分别参照相关文献诊断标准[7-12]。
1.4 统计学方法 采用 SPSS 11.5统计软件进行统计学分析。计量资料以表示,用 Logistic回归模型进行统计分析,按各统计率统计分析比值比 (OR)、95%可信区间 (CI)和 P值,p<0.05为差异有统计学意义。
2 结果
2.1 IBD合并胆石病情况 Logistic回归模型统计显示,IBD组共有 218例 (35.97%)患者合并胆囊结石伴慢性胆囊炎或者胆管结石,而对照组仅检出 50例 (8.25%)。其中 CD和UC患者发生胆石病的 OR值分别达 10.96[95%CI(4.181,28.724)]和5.79[95%CI(4.053,8.264)],差异有统计学意义 (p<0.01,见表 2)。
2.2 IBD合并 NAFLD情况 Logistic回归模型统计显示,IBD组共有 417例 (68.81%)患者合并 NAFLD,而对照组为 126例 (20.79%)。其中 CD和 UC患者发生 NAFLD的OR值分别为8.56[95%CI(3.854,18.994)]和8.41[95%CI(6.378,11.084)],差异有统计学意义 (p<0.01,见表 3)。
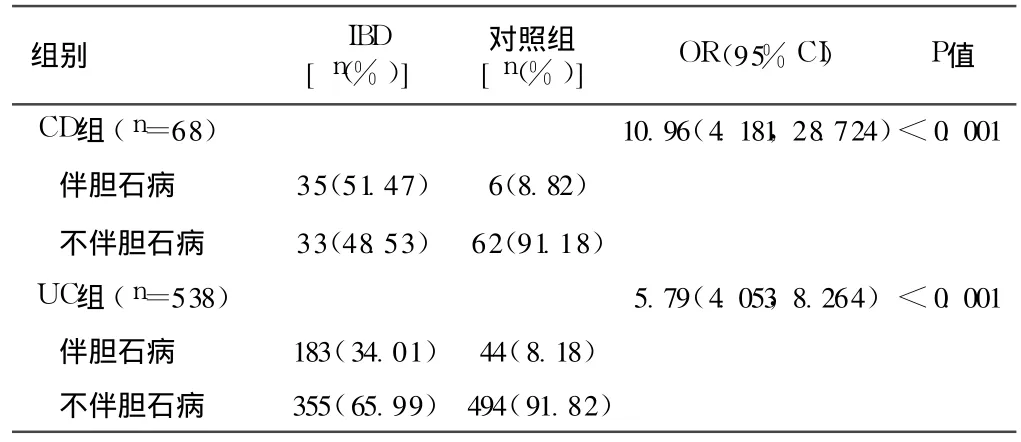
表 2 CD和 UC患者胆石病的检出率Table 2 Frequency of gallstone disease among CD and UCpatients

表 3 CD和 UC患者 NAFLD的检出率Table 3 Frequency of NAFLD among CD and UCpatients
2.3 IBD合并其他少见肝胆胰病变情况 由于涉及 IBD的肝胆胰并发症不典型、隐匿,或与 IBD临床表现相互掩盖,或与 IBD疾病的活动性不一致,可能一些少见的并发症被忽视而漏诊。故从已确诊的 PSC、AIH、PBC、CP等肝胆胰疾病中,进一步筛查 IBD,IBD检出率分别为 2.25%、4.49%、3.33%、0.93%等 (见表4)。对照组中均未检出上述 IBD少见并发症。

表 4 少见的肝胆胰病变患者中 IBD检出率Table 4 Frequency of IBD in patients with uncommon hepatopancreatobiliary diseases
3 讨论
本组报道的 IBD的临床特点符合与西方国家不同的东方国家的特点,即 CD患病率不如 UC患病率高 (UC 88.78%,CD 11.22%),病变发生在近段结肠和小肠的 CD相对少,累及肛门的病变少[4]。以往文献报道的 IBD肠外表现多侧重于关节、皮肤、口腔、眼受累及,可能与 CD患者肠外表现涉及皮肤、眼和关节等,常与疾病活动性相关,而涉及肝胆和非典型的病例不一定与疾病的活动性一致[13]。而且有关 IBD肝胆胰病变的报道缺乏大样本或缺乏与普通人群发病的对照,更少与年龄、性别、BMI匹配的病例对照研究。故IBD患者肝胆胰病变准确的患病率不详。
3.1 有小样本 IBD合并肝胆疾病的报道,检出率为 UC 11%~49%,CD 15%~30%[14]。本研究结果显示,CD和 UC患者并发胆石病的风险分别比对照组高达 10倍和 5倍之多,其中 CD并发胆石病的风险比 UC并发胆石病的风险更高 [CD:OR=10.96,95%CI(4.181,28.724);UC:OR=5.79,95%CI(4.053,8.264)]。IBD患者肝胆胰病变比一般人群发生肝胆胰病变的风险大,与文献报道相似[5],本组此特点更显著。
IBD并发胆石病的机制尚不明。一般的解释是伴回肠末端病变回肠切除患者,胆汁酸吸收减少或丢失过多,导致胆汁中胆固醇过饱和而促发胆石形成[15]。但也有报道 CD患者回肠切除者胆汁胆固醇饱和度正常或较低[14]。这表明尚有其他致病因素。对回肠和结肠病变的 CD患者研究发现,脂肪餐诱导的胆囊排空障碍,提示胆囊动力减低,促使胆固醇过饱和[16]。IBD患者长期全肠外营养者,胆囊排空能力明显减低。有研究表明住院超过 40 d者全肠外营养,增加胆石风险 20倍。
综上所述,与成石相关因素有:年龄、病变部位、回肠切除手术、临床复发次数、住院时间、肠外营养[17]。
3.2 NAFLD是最常见的 IBD并发肝损害的病因,此类脂肪肝患者通常无症状,或表现为流感样症状,检测到转氨酶增高。一项 511例 IBD患者超声检查报道,CD和 UC患者脂肪肝检出率分别为 39.5%和 35.5%[18]。有报道 CD和 UC肝活检脂肪肝常见,检出率高达 13.5~100.0%[19]。本组 CD和 UC患者并发 NAFLD的风险均比对照组高达 8倍之多 [CD:OR=8.56,95%CI(3.854,18.994);UC:OR=8.41,95%CI(6.378,11.084)]。
IBD并发 NAFLD的发病机制不明。营养不良、蛋白丢失和应用皮质激素治疗可能是导致脂肪肝的因素[19-21]。近来认为 IBD肠源性内毒素血症可能是 NAFLD重要的发病机制。来自肠腔的细菌及其产物促进肠黏膜通透性增加。NAFLD患者存在细菌过度生长,细菌和内毒素诱导促炎症状态,细菌内毒素 (脂多糖)进入血液循环与内毒素结合蛋白 (LBP)结合,形成复合体转运给 kupffer细胞膜表面受体 CD14,经过细胞膜上多种 Toll样受体 (TLR),主要是在 TLR4区相互识别后,激活肝 kupffer细胞,诱导炎症途径下游区的激活,促进包括肿瘤坏死因子 α(TNF-α)等多种细胞因子和化学因子的转录、合成与释放,增加胰岛素抵抗,促进形成氧自由基,诱导氧化应激,引起肝脏的炎症损害[14]。
3.3 某些肝胆胰疾病和 IBD可能有共同免疫介导的发病机制,包括 PBC、PSC、AIH、CP。但此类疾病不一定与 IBD同期发病,可间隔若干时间先后发病,加之临床表现各异,不典型,易于漏诊[22]。一项基于人群的调查显示 UC中 PBC患病率高于无 UC者,男性多于女性,主要见于青年人。伴 PBC的UC病情往往较轻,结肠炎较局限 (如仅有直肠炎)[23]。本组311例 PBC患者中检出 7例 IBD(2.25%)。据报道有1.4% ~7.5%的 IBD患者在疾病过程中发生 PSC,而 70%~80%的PSC伴有 IBD,UC和 CD伴 PSC的发生率分别为 2.0% ~7.5%和 1.4%~3.4%[22]。大多数 PSC患者在诊断 IBD时无症状,UC可能在诊断 PSC后几年甚至在肝病终末期原位肝移植后才发病,而新发 PSC可能在确诊 UC后多年才诊断。60%的患者病程中陆续出现乏力、瘙痒、黄疸、腹痛、体质量减轻等症状。胆汁淤积性肝功能异常、碱性磷酸酶 (AKP)增高是 PSC患者的生化特点,可检测到各种自身免疫抗体包括:ANA、ASA、pANCA等,ERCP或 MRCP胆管影像检查显示弥漫性、多灶性中等大小的肝内胆管和中等及中等以上的肝外胆管结构异常。本组4例 IBD出现上述临床表现,经进一步胆管影像检查方确诊并存 PSC。PSC与 IBD并发的特点是直肠炎症发生率高、反流性回肠炎发生率高、与结肠炎相关的肿瘤发生率高、存活率低。该风险在肝原位移植患者依然存在。因此,PSC患者应在诊断 PSC后每年行结肠镜筛查一次,以便早期诊断 IBD,早期用5-氨基水杨酸预防可能有益[22]。
IBD相关性胰腺炎在临床、形态学和组织学特征方面类似于 AIP,如弥漫性胰管狭窄常见、假性囊肿或钙化少见。在IBD相关性胰腺炎中,主因是 AIP。一份 71例 AIP研究报道中4例 (5.6%)并发 IBD。IBD伴胰腺炎大多数无症状,有临床表现者仅占 2%,CD或 UC尸检报告有胰腺炎变化者达38%~53%,其中胰腺纤维化占 38%,但无一例有临床症状、放射影像学和实验室检查征象[23]。实验室检测表明 21%~80%胰腺外分泌存在不足[24]。本组 213例 CP患者中仅 2例并发 UC,而因缺乏典型的 CP临床表现,大部分 IBD未能深入针对此病检查和诊断。IBD伴发 CP的病因和发病机制未明,可能由于胃肠道和胰腺组织上皮细胞有相类似的易受损细胞分子靶点[25]。
一份前瞻性研究报道,41例 PSC患者中 7例有 AIH-PSC重叠综合征,2例伴 UC。免疫抑制剂治疗似乎有益,比单伴PSC者存活期长[26]。本组未发现此类病例,可能与临床认识不足有关。
肝淀粉样变性少见,有研究报道 30例淀粉样变性中,累及肝脏者占 58.33%[27],但只有 2例符合其诊断,参考依据为:(1)肝组织切片刚果红染色证实存在淀粉样物质,免疫组化等检查证实淀粉样物质系淀粉样轻链成分 κ或 λ;(2)血清胆红素高于 85μmol/L;(3)显微镜下肝组织内有肝内胆汁淤积的证据;(4)无肝外胆道梗阻的证据;(5)除外多发性骨髓瘤等恶性浆细胞病所伴发的淀粉样变性及其他继发性系统性淀粉样变性[12]。在 IBD并发肝病的原因中,不少报道认为与 IBD治疗中出现的药物性肝损害有关,主要的药物是硫唑嘌呤 (AZA)、硫嘌呤 (MP)等。由于本组应用较少,未进行系统随访和统计。在部分患者 (4%)出现的丙氨酸氨基转移酶 (ALT)、天冬氨酸氨基转移酶 (AST)等异常一般较轻,停药后较快恢复正常,符合文献报道所观察的规律[27]。
鉴于肝胆胰病变和 IBD可能存在共同的免疫缺陷,而且发病机制、临床表现不典型 (甚或无症状)对原发病的临床经过、治疗方案和预后有明显的影响,故不少临床医生呼吁在IBD患者中重视筛查 PBC、AIH、PSC、CP;在 PBC、AIH、PSC、CP等疾病诊断中重视筛查 IBD,此项措施很有必要。推荐进行相应的影像学、实验室免疫学检查、肠镜检查、病理学检查等。不论伴有或不伴有肠切除手术,应用免疫调节剂或生物品制剂者均需行肝功能监测[22]。为进一步阐明导致 IBD相关的肝胆胰并发症的多因素,下一步我们拟进行相关因素深入分析研究。
1 Bernstein CN,Blanchard JF,Rawsthorne P,et al.The prevalence of extra intestinal diseases in inflammatory bowel disease:a population based study[J].Am J Gastroenterology,2001,96:1116-1122.
2 Bernstein CN,Wajda A,Blanchard JF.The clustering of other chronic inflammatory diseases in inflammatory bowel disease:a populationbased study[J].Gastroenterology,2005,129:827-836.
3 Mendoza JL,Lana R,Taxonera C,et al.Extra intestinal manifestations in inflammatory bowel disease:differences between Crohn′s disease and ulcerative colitis[J].Med Clin(Barc),2005,125:297-300.
4 Bernstein CN,Fried M,Krabshuis JH,et al.World gastroenterology organization practice guidelines for the diagnosisand management of IBD in 2010[J].Inflammatory Bowel Diseases,2010,16(1):112-123.
5 Parente F,Pastore L,Bargiggia S,et al.Incidence and risk factors for gallstones in patients with inflammatory bowel disease:a large casecontrol study[J].Hepatology,2007,45:1267-1274.
6 中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南 (2010年修订版)[J].中华肝病杂志,2010,18(3):163-166.
7 范雪,贾继东 .亚洲地区原发性胆汁性肝硬化的诊疗现状 [J].临床肝胆病杂志,2010,26(4):365-367.
8 Silveira MG,Lindor KD.Primary sclerosing cholangitis[J].Can J Gastroenterology,2008,22(8):689-698.
9 Manns MP,Czaja AJ,Gorham JD,et al.AASLD practice guidelines:diagnosis and management of autoimmune hepatitis[J].Hepatology,2010,51:2193-2213.
10 Nair RJ,Lawler L.Chronic pancreatitis[J].American Family Physician,2007,76(11):1679-1688.
11 Ben-Ari Z,Czaja AJ.Autoimmune hepatitis and its variant syndromes[J].Gut,2001,49:589-594.
12 Ebert EC,Nagar M.Gastrointestinal manifestations of amyloidosis[J].Am JGastroenterology,2008,103:776-787.
13 于燕,齐玲芝,李春荣 .炎症性肠病 65例临床分析 [J].中国全科医学,2010,13(5):1683.
14 Solís Herruzo JA,Solís-Muñoz P.Hepatobiliary manifestations of inflammatory bowel disease[J].Rev Esp Enferm Dig(Madrid),2007,99(9):525-542.
15 Fraquelli M,Losco A,Visentin S,et al.Gallstone disease and related risk factors in patients with Crohn′s disease:analysis of 330 consecutive cases[J].Arch Intern Med,2001,161:2201-2204.
16 Annese V,Vantrappen G.Gallstones in Crohn′s disease:another hypothesis[J].Gut,1994,35:1676-1676.
17 Parente F,Pastore L,Bargiggia S,et al.Incidence and risk factors for gallstones in patients with inflammatory bowel disease:a large casecontrol study[J].Hepatology,2007,45:1267-1274.
18 Bargiggia S,Maconi G,Elli M,et al.Sonographic prevalence of liver steatosis and biliary tract stones in patients with inflammatory bowel disease:study of 511subjects at a single centre[J].Clin Gastroenterol,2003,36:417-420.
19 de Dombal FT,Goldie W,Watts JMc K,et al.Hepatic histological changes in ulcerative colitis[J].Scand J Gastroenterol,1966,1:220-227.
20 Riegler G,D′Inca R,Sturniolo GC,et al.Hepatobiliary alterationsin patients with inflammatory bowel disease:a multicenter study[J].Scand J Gastroenterology,1998,33:93-98.
21 Navaneethan U,Shen B.Hepatopancreatobiliary manifestations and complications associated with inflammatory bowel disease[J].Inflammatory Bowel Diseases,2010,16(9):1598-1619.
22 Lever E,Balasubramanian K,Condon S,et al.Primary biliary cirrhosis associated with ulcerative colitis[J].Am J Gastroenterology,1993,88:945-947.
23 Barthet M,Lesavre N,Desplats S,et al.Frequency and characteristics of pancreatitis in patients with inflammatory bowel disease[J].Pancreatology,2006,6:464-471.
24 Hegnhoj J,Hansen CP,Rannem T,et al.Pancreatic function in Crohn′s disease[J].Gut,1990,31:1076-1979.
25 Stocker W,Otte M,Ulrich S,et al.Autoimmunity to pancreatic juice in Crohn′s disease.Results of an autoantibody screening in patientswith chronic inflammatory bowel disease[J].Scand J Gastroenterology Suppl,1987,139:41-52.
26 Floreani A,Rizzotto ER,Ferrara F,et al.Clinical course and outcome of autoimmune hepatitis/primary sclerosing cholangitis overlap syndrome[J].Am JGastroenterology,2005,100:1516-1522.
27 Gisbert JP,Luna M,Gonza′lez-Lama Y,et al.Liver injury in inflammatory bowel disease:long-term follow-up study of 786 patients[J].Inflammatory Bowel Diseases,2007,13:1106-1114.

