致仔猪水肿病大肠杆菌的分离鉴定及耐药性分析
李求知,杭柏林,王青,胡建和
(1.辉县市畜牧局,河南辉县 453600;2.河南科技学院,河南新乡 453003)
猪水肿病(edema disease of pigs,ED),是由某些特定血清型产类志贺毒素大肠杆菌(Shiga-like toxinEscherichia coli,SLTEC)引起的小猪的一种肠毒血症,以头部、眼睑、耳部等处水肿、共济失调和急性死亡为主要特征[1-2].该病发病率不高,但病死率很高,给猪的养殖造成很大损失,成为危害养殖业的一大难题[2].仔猪水肿病病原血清型较多,各地流行菌株不尽相同,血清型之间的交叉保护性不高,菌苗的免疫效果并不理想.因此,一般通过抗生素治疗仔猪水肿病.然而,不合理使用抗生素易导致细菌产生耐药性,使得治疗越发困难[3].2010年6月至8月,辉县市几个猪场出现了断奶仔猪突然死亡的病例,从病猪的临床症状和剖检病变方面初步诊断为仔猪水肿病.为了确诊该病,进行了病原分离与鉴定,并进行了耐药性检测,旨在为防治该病提供帮助.
1 材料与方法
1.1 试验材料
1.1.1 病料采集 肝、脾、肺、心、血液等病料采集自辉县市几个猪场的疑似仔猪水肿病病死猪,共16份病料.用保温杯加冰袋冷藏保存,并于3 h内送达实验室,保存于4℃,24 h待检.
1.1.2 培养基与试剂 普通营养琼脂、麦康凯琼脂、伊红美蓝琼脂、微量生化反应管等购自杭州天和微生物试剂有限公司.药敏纸片、营养肉汤培养基、半固体培养基和枸橼酸盐培养基为本实验室自行制备并保存,各种抗生素购自河南科技学院动物医院,TaqDNA聚合酶、dNTPs、Taq buffer和DNAMarker等均为大连宝生物公司产品.其他为实验室常规试剂.
1.1.3 试验动物 22只试验用小白鼠(16~20 g)购自新乡医学院实验动物中心.
1.1.4 PCR引物的设计及合成 使用文献[4]设计的特异性引物,序列见表1,引物由大连宝生物公司合成.

表1 引物序列
1.2 试验方法
1.2.1 临床症状及病理变化的观察 临床症状主要观察发病猪的精神状态、食欲、体温、呼吸、运动等情况;病理变化的观察通过解剖病、死猪,观察胃底黏膜、胃大弯、胃贲门部、心包、胸腔、腹腔等的病理变化情况.
1.2.2 细菌的分离 将血液用灭菌生理盐水进行稀释,取不同稀释度的稀释液0.5mL,用涂布法接种普通营养琼脂培养基.心、肝、肺和脾脏用剪刀以烫灼法进行表面消毒,以无菌镊子取一小块组织,用涂布法接种普通营养琼脂培养基.37℃恒温培养18~24 h后观察细菌生长情况和菌落特征.挑取单个菌落接种于麦康凯琼脂平板,37℃恒温培养18~24 h,挑取红色、中等大小、光滑的可疑菌落进行涂片、革兰染色和镜检.同时挑取单个菌落接种于伊红美蓝琼脂平板,37℃培养18~24 h,挑取黑色、带金属光泽的中等大小菌落进行涂片、革兰染色和镜检.革兰染色、形态、大小及菌落培养性状等均符合大肠杆菌菌株的特征,初步确定为大肠杆菌,并用普通营养琼脂纯化,以供作细菌生理生化鉴定.
1.2.3 细菌生化试验 按照文献[5]的方法进行.对疑似大肠杆菌的菌株进行吲哚试验、甲基红试验、维倍(VP)试验、硫化氢(H2S)试验、枸橼酸盐利用试验和5种糖类发酵试验.
1.2.4 细菌致病性试验 为了鉴定所分离的大肠杆菌是否具有致病性,使用小白鼠进行动物试验.按照文献[6]的方法进行.将生化鉴定为大肠杆菌阳性的菌株纯培养物接种普通营养琼脂培养18~24 h,用灭菌生理盐水洗下,调节菌悬液的细菌浓度约为2.0×108CFU/mL,通过腹腔途径注射5只健康小白鼠0.5 mL/只.对照组小白鼠注射等量的灭菌生理盐水.小白鼠死亡后进行剖检观察,将病变明显组织按方法1.2.1中心包、肝脏和脾脏的方法进行接种,若培养特性、形态、染色反应和生理生化鉴定等均符合大肠杆菌的菌株则判定为致病性大肠杆菌.
1.2.5 菌落PCR 按照文献[4]的方法进行.用灭菌牙签轻轻从麦康凯培养基上挑取于37℃培养16~18 h、中等大小、粉红色典型菌落于PCR反应体系中混匀,直接用于PCR扩增.反应体系:模板为牙签挑取的适量菌落,Taq酶(2U/L)0.5μL,dNTPs(2mmo1/L)1μL,MgC12(25mmo1/L)1.0μL,10×Taq buffer(不含Mg2+)2μL,各对引物中每种引物 1.0μL(10μmol/L),加灭菌双蒸水至 20μL.反应步骤:95℃4min,94℃lmin,58℃lmin,72℃lmin,25个循环后,72℃延伸l0min,4℃保存待鉴定.
取5μL扩增产物与1/6体积的DNA电泳上样缓冲液混匀,点入配制好的琼脂糖凝胶样品孔中,在1×TAE电泳缓冲液中加以5~10 V/cm的电场使DNA样品向正极泳动30~60min.电泳结束后在凝胶成像系统紫外灯下观察并照像.
1.2.6 药敏试验 采用圆纸片法进行.取37℃培养18 h的致病性大肠杆菌,置于1mL灭菌生理盐水中,充分混合后用移液枪吸取150μL,均匀涂布于普通营养琼脂培养基表面.待琼脂表面干燥后,用灭菌镊子小心取已备好的各种药敏纸片,每个药敏纸片设3个重复.37℃恒温培养24 h,测定抑菌圈直径.判定标准[7]:抑菌圈直径大于20mm为极度敏感,15.1~20mm为高度敏感,10.1~15mm为中度敏感,0~10mm为耐药.
2 结果与分析
2.1 发病猪的临床症状与病理变化
发病猪只精神高度沉郁,食欲废绝,体温达38~39℃,眼睑红肿,步态失调,继而卧地不起,四肢划动呈游泳状,呼吸快而浅,进而口吐白沫,叫声嘶哑,后抽搐而死.剖检病死猪,可见胃底黏膜弥漫性出血,胃大弯和贲门部水肿,切开水肿部,黏膜层和肌层之间有一层胶胨样水肿液;心包、胸腔、腹腔有淡色积液,暴露空气中5min后即凝结成胶胨样;膀胱黏膜轻度充血.根据以上临床症状和病理变化参照文献[2]初步判断为仔猪水肿病.
2.2 细菌的分离与培养结果
在16份疑似猪水肿病的病料中,10份病料中的细菌在普通营养琼脂培养基上长出灰白色、圆形、稍隆起、光滑、湿润、边缘整齐的中等大小菌落(直径约1~2mm),在麦康凯培养基上长出砖红色、圆形隆起、光滑、湿润、边缘整齐的菌落,在伊红美蓝琼脂培养基上长出深黑色、圆整、湿润、中等大小、具有黄绿色金属光泽的菌落,在半固体培养基中可见穿刺线周围的培养基有菌生长,呈倒三角形状.将以上培养物进行常规涂片,革兰染色后镜检,见到革兰阴性、中等大小的杆菌.将培养特征和镜检特征比对文献[8]中大肠杆菌的特征描述,认为分离到疑似大肠杆菌菌株10株.
2.3 细菌的生理生化鉴定结果
10株疑似大肠杆菌菌株的生理生化鉴定结果如表2所示.将10株疑似菌株的生理生化试验结果与文献[8]中大肠杆菌生理生化特性的描述进行比对,确定分离到的10株疑似大肠杆菌菌株均为大肠杆菌.

表2 细菌生理生化试验结果
2.4 分离菌株的致病性试验结果
试验组小白鼠在2~3 d内都出现了一些变化,精神沉郁,体温升高,采食量大幅减少,7 d后全部死亡;而对照组全部正常存活,这说明接种菌株为致病性菌株.解剖死亡小白鼠,可见肝脏肿大、边缘钝圆,肠道弥漫性出血.采用麦康凯培养基,37℃培养24 h,在平板上形成粉红色或砖红色,表面光滑,圆整,隆起,湿润和中等大小的菌落.经镜检和生理生化鉴定为大肠杆菌.这表明,所分离到的10株大肠杆菌均具有致病性.
2.5 菌落PCR结果
经菌落PCR后,从10株菌株中均扩增出510 bp大小的条带(见图1),说明这10株大肠杆菌为致仔猪水肿病的病原.
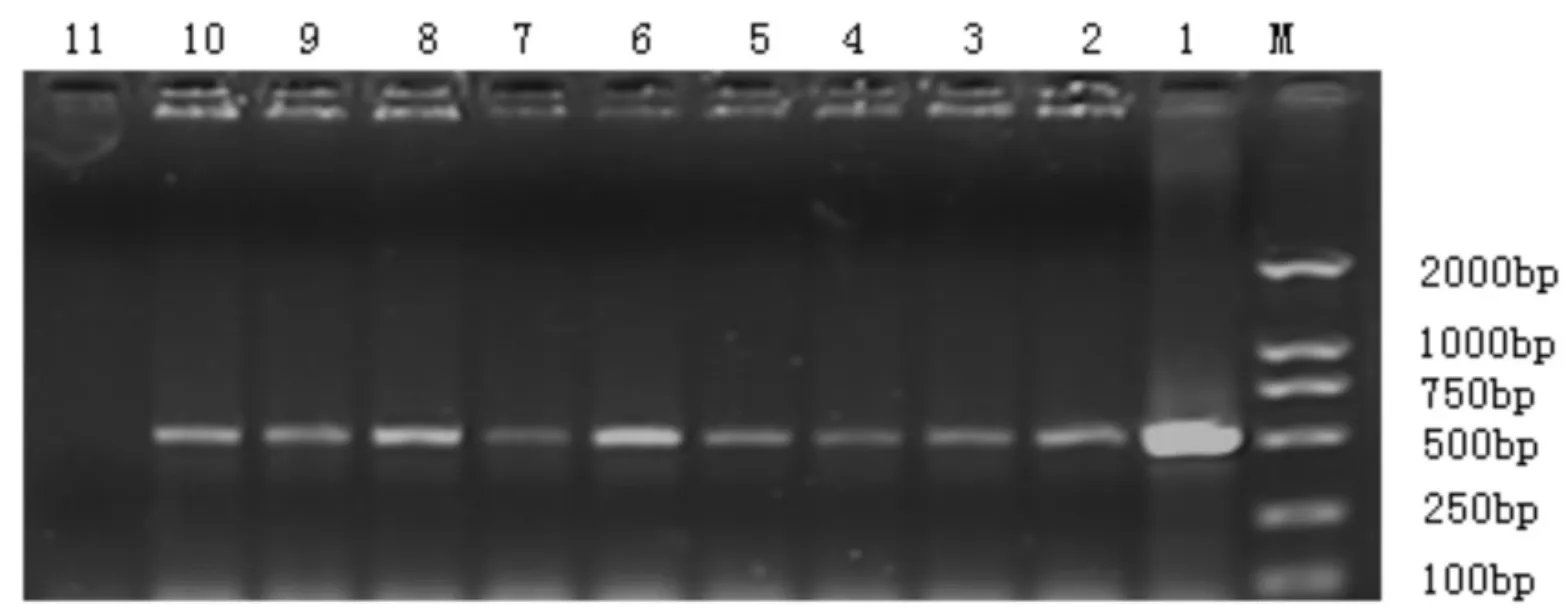
图1 FedA亚基PCR扩增产物电泳
2.6 分离菌株的耐药性分析
10株致病性大肠杆菌的药敏试验结果如表3所示.从表3中可以看出,就受试抗生素而言,所分离的10株大肠杆菌对青霉素和阿莫西林均耐药,对庆大霉素、阿米卡星、沙拉杀星、洛美沙星和头孢噻呋均没有耐药性.第 1、2、3、9 株为两重耐药,第 4、6、7、8、10 株为三重耐药,第 5 株为四重耐药.9 种抗生素中敏感性较高的是洛美沙星,极度敏感的有2株(2/10),高度敏感的有8株(8/10);其次是庆大霉素,极度敏感的有1株(1/10),高度敏感的有7株(7/10).
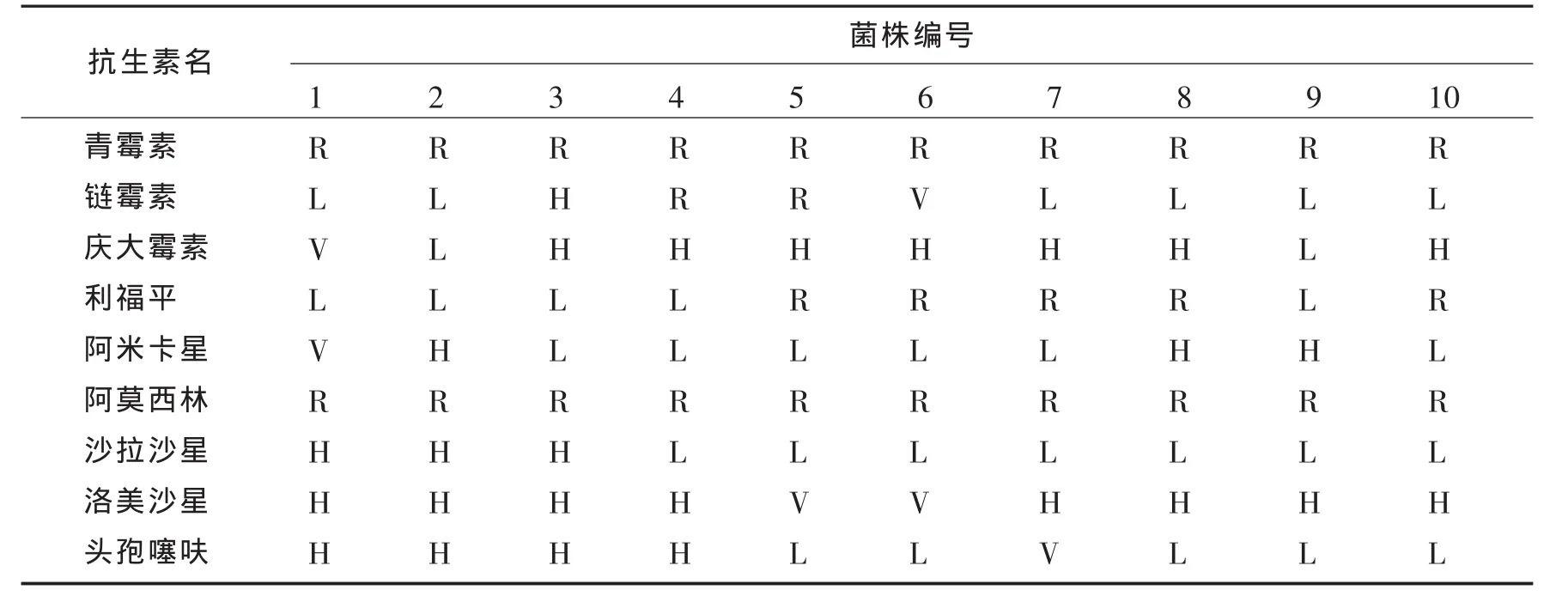
表3 药敏试验结果
3 小结与讨论
该研究首先对疑似仔猪水肿病的病、死仔猪进行临床症状和病理变化的观察,再通过观察分离菌株的形态、分离培养、生化反应、小白鼠感染试验和PCR鉴定,最终确定引起该猪场仔猪发病的病原为猪水肿病大肠杆菌.通过细菌分离、生理生化试验、小白鼠试验后得到的结论是所分离菌株是致病性大肠杆菌,但却不能确定是导致仔猪水肿病的病原.FedA是F18ab(F107ab)菌毛的主要结构亚单位基因,而F18ab菌毛与仔猪水肿病有关[9],是致水肿病大肠杆菌的主要毒力因子之一[10].因此,若通过PCR扩增出FedA基因,则能表明所分离的大肠杆菌为导致仔猪水肿病的病原.本试验正是通过这一原理证实了所分离的菌株为仔猪水肿病病原.
通过药敏试验筛选敏感药物用于治疗大肠杆菌病是目前常用的方法[2].药敏试验结果表明,从这几个猪场分离到的菌株对不同的抗生素产生了耐药性,有的还是多重耐药,但是仍然有对所分离菌株都比较敏感的抗生素,如洛美沙星和庆大霉素.目前,动物源性大肠杆菌耐药性呈现出以多重耐药为主的趋势[11].因此,中药和其它抗生素替代品是未来用防治大肠杆菌病的希望.
[1]AlexaP,Hamrik J,StouracovaK,etal.Passiveimmunoprophylaxis of edemadiseaseinweaned piglets[J].VetMed,2004,49(12):447-452.
[2]陈溥言.兽医传染病学[M].北京:中国农业出版社,2006:111-119.
[3]易本驰,陈敏,何敏,等.信阳地区规模化猪场大肠杆菌耐药性监测[J].中国兽医杂志,2010,46(2):25-26.
[4]杨明柳.致猪水肿病大肠杆菌二重PCR检测方法及三价灭活菌苗研究[D].武汉:华中农业大学硕士学位论文,2007.
[5]胡建和,王丽荣,杭柏林.动物微生物学[M].北京:中国农业科学技术出版社,2006:398-406.
[6]史丽华.仔猪致病性大肠杆菌的分离与鉴定[J].中国兽医杂志,2010,46(6):53-54.
[7]朱模忠.兽药手册[M].北京:化学工业出版社,2002:42-43.
[8]陆承平.兽医微生物学[M].北京:中国农业出版社,2007:99-107.
[9]Imberechts H,De Greve H,Schlicker C,et al.Charactenzation of F107 fimbriae of Escherichia coli 107/86,which causes edema disease in pigs,and nucleotide sequence of the F107major fimbrialsubunitgene,fed A[J].Infect Immun,1992,60(5):1963-1971.
[10]Smith HW,Halls S.The production of edema disease and diarrhoea in weaned pigs by the oral administration of Escherichia coli:factors thatinfluence the courseorexperimentaldisease[J].JMed Microbiol,1968(1):45-59.
[11]夏伦斌,左瑞华,葛凯,等.规模化猪场致病性大肠杆菌的耐药性分析[J].中国畜牧兽医,2010,37(6):183-185.

