猪瘟与蓝耳病混合感染的诊断与治疗方法
陈桂香,银梅,范国英
(河南科技学院,河南新乡 453003)
猪瘟(classicalswine fever,CSF)是由猪瘟病毒引起的一种以高热稽留、出血和高死亡率为主要特征的高度接触性传染病,是严重威胁养猪业的病毒性疾病.近年来猪瘟的发病特点发生了很大变化,由过去的典型猪瘟转变为病理变化不典型、临床症状轻微的非典型猪瘟[1].猪蓝耳病又称“猪繁殖与呼吸障碍综合征”,是由猪繁殖与呼吸障碍综合征病毒引起的一种高度接触PRRSV性传染病.高致病性猪蓝耳病是由PRRSV变异毒株引起的一种急性高致死性传染病,病毒致病力强,传播速度快,猪群发病率和死亡率高[2].它不仅引起猪群发生严重的原发性病原感染,更为严重的是还可引起猪的免疫抑制,导致猪群混合或继发感染其他传染病,给养猪户带来了严重的经济损失.目前,全世界主要养猪国家均有该病存在,已严重威胁着全世界的养猪业.本文旨在为确诊为猪瘟和蓝耳病混合感染的猪的防治提供依据.
1 材料和方法
1.1 病料来源
所采用的病料来自于新乡市长垣县赵堤镇某猪场的病猪,共选呼吸困难、喘气、咳嗽、腹泻、耳部发绀等症状典型的60~70日龄的病猪10头,其中剖检3头.
1.2 药品、试剂与器材
药品:菌毒急救(由吉林省五星动物保健药厂生产,主要成分:三甲氧苄啶、环丙氟哌酸、α-吡咯烷酮等,批准文号:吉兽药字X013576[2002])、杂症一针(由商丘天一生物技术有限公司生产,主要成分:黄芪多糖,批准文号:兽药字160242714[2006])、防蓝灵(湖南广安生产,主要成分:泰乐菌素,批准文号:兽药字183651326[2005]号)、金方案Ⅱ型(商丘天一生物技术有限公司生产,主要成分:板蓝根、穿心莲、葛根、生地、连翘、黄芪、甘草、氟苯尼考、美他环素、解热因子、止咳因子及诱食剂,批准文号:豫兽药字Z501185[2002])、猪瘟活疫苗(武汉中博生化有限公司,规格:50头份,批准文号:兽药字170261004[2006])、抗猪瘟血清(安徽生物药业有限责任公司生产,批准文号:皖生药字117713[2003])、电解多维(山东潍坊生产,批准文号:X341628[2004])、ORS(河南科技学院动物医院配制).
试剂:革兰氏染色液、美蓝染液(为实验室自己配制)、猪蓝耳病ELISA诊断试剂盒一套(由华中农业大学动物医学院动物病毒室购得,批号:20060921)、猪瘟正向间接血凝板一套(由中国农业科学院兰州兽医研究所综防技术研究组购得,批号:20060910)、载玻片、盖玻片、10mL无菌注射器、一次性移液器吸头、洁净吸水纸、蒸馏水.
器材:80-2型高速离心机(上海手术器械厂)、BH-2型高倍显微镜(上海普丹光学仪器厂)、BIO-550型酶标仪(美国伯乐公司生产)、HG303-3型恒温箱(南京电器三厂制造).
1.3 方法
1.3.1 流行病学调查 根据传染病的流行过程采取现场调查的方法调查该猪场不同阶段的存栏情况、免疫接种情况、饲养环境、发病率、死亡数、用药史.
1.3.2 临床表现 采用常规临床检查方法,观察被毛、精神、皮肤、食欲、体温、粪便、呼吸、眼睑等.
1.3.3 病理剖检 挑选3头具有典型症状的病猪按常规方法解剖病猪,观察胸腔及腹腔变化,并着重检查心、肺、肝、脾、肾等组织器官的病变.
1.3.4 实验室检验
1.3.4.1 细菌学检查 无菌采取3头病猪的心、肝、脾、肺、肾,按实验室常规方法进行组织抹片,分别采取革兰氏、美蓝染色后在400倍镜下镜检.
1.3.4.2 正向间接血凝试验 血清制备:10mL无菌注射器前腔静脉采血,高速离心机2 500 r/min,离心20 min,要求血清清亮,无溶血.
按照中国农业科学院兰州兽医研究所综防技术研究组提供的猪瘟正向间接血凝抗原使用说明书严格操作.
判定标准:以呈现“++”凝集的最大稀释倍数为该份血清的抗体效价.接种猪瘟疫苗的猪群免疫抗体效价达到1:16(即第4孔,呈现“++”凝集)为免疫合格.
1.3.4.3 酶联免疫吸附试验(ELISA) 试剂盒检测PRRS血清制备方法同1.3.4.2,按照华中农业大学动物医学院动物病毒室提供的猪蓝耳病抗体检测试剂盒使用说明书严格操作.
判定标准:以空白孔调零,在酶标仪上测各孔OD630值.样品OD630值大于0.42,判为阳性;样品OD630值在0.38到0.42之间,判为可疑;样品OD630值小于0.38,判为阴性.
1.4 治疗方法
对于发病的猪,挑取30头体重相近的病猪随机分成3组,每组10头,分别按照3种不同的治疗方法作比较,第1组采用自家苗疗法,5mL/头,肌肉注射.第2组采用抗猪瘟高免血清疗法,按1mL/kg,肌肉注射,连用3 d.第3组采用大剂量接种猪瘟疫苗疗法,20头份/头,肌肉注射.以上3种疗法同时配合菌毒急救按0.1mL/kg,杂症一针按0.2mL/kg,分别上、下午肌肉注射,连用3~5 d,饲料中添加防蓝灵按治疗量0.8%连续拌料饲喂2周,金方案Ⅱ型按每袋100 g拌料50 kg,连用1周,饮水中添加ORS及电解多维[1-2].
对于未发病的猪采用药物预防:在饲料中按上述治疗量添加防蓝灵,金方案Ⅱ,饮水中添加Vc或多维,以提高猪体的免疫力和抵抗力,同时可防止细菌继发感染.
加强饲养管理,严格消毒,做好栏圈清洁卫生,保持圈内通风、干燥,调整饲养密度,减少各种应激,保持圈栏良好的饲养环境.严格实施消毒制度,采用各种有效的消毒剂或3%的烧碱溶液对门卫消毒池、猪栏走道、运输用具定期彻底消毒.
2 结果与分析
2.1 流行病学调查
经调查该场已建场多年,现有存栏母猪120头,种公猪8头,断奶仔猪150头,育肥猪230头,一直实施公猪春秋两防,母猪配种前10天免疫,仔猪25~30日龄,免疫一次细胞苗(2头份/头)的猪瘟免疫程序,母猪定期免疫蓝耳病、细小病毒、伪狂犬病、乙脑等多种疫苗.同时经调查得知周围有数家用泔水养猪的小规模猪场,相距不远.2006年9月初60~70日龄的断奶仔猪开始出现体温升高,食欲下降,呼吸困难,喘气,腹部皮下出现大量蓝紫色出血点,腹泻,耳发绀等不良症状,发病率约占断奶仔猪的20%,曾使用复方增效磺胺、环丙沙星、恩诺沙星治疗,均无显著疗效,已死亡2头.
2.2 临床症状
本次挑选3头症状典型的病猪,其共同特征大致如下:被毛粗乱,精神沉郁,全身潮红,食欲下降,挤堆,体温升高至40~42℃,顽固性腹泻,腹泻物恶臭,呈黄色或褐色,呼吸加快,咳嗽,肌肉震颤,共济失调,后躯麻痹,眼睑水肿,两耳、鼻盘发绀,腹下、后躯内侧、四肢见针头大小的出血斑点.
2.3 病理剖检
剖检的3头病猪,其共同病变大体如下:肺呈灰白色至棕色,花斑状,质地坚实呈“肝样”,肺小叶间质增宽,心脏松弛,心肌充血,全身淋巴结特别是颌下、肺门、肠系膜、腹股沟淋巴结出血肿大,切面呈大理石样,胃内充气、空虚,内有少量黄色带泡沫状粘液,胃底出血,胃黏膜脱落;肠系膜充血,肠浆膜斑状出血点,肝脏发黄有出血点,肾发黄,有麻雀蛋样出血点,有沟会回,脾脏边缘有数量不等的紫黑色出血性梗死灶,膀胱黏膜有出血点.
2.4 实验室检验结果
2.4.1 细菌学检验结果 将无菌采取的心、肝、脾、肺、肾经革兰氏染色、美蓝染色后置显微镜400X下镜检,结果未见细菌.
2.4.2 正向间接血凝试验 CSF正向间接血凝抗原试验检验结果显示,检测的10份血清中有8份抗体效价均在1:16以下,没有达到有效的免疫保护水平,为免疫不合格,有2份在1:16以上,为免疫合格,即猪瘟感染阳性率为80%.
2.4.3 酶联免疫吸附试验 使用华中农业大学动物病理实验室提供的ELISA试剂盒检测PRRS,结果表明,检测的10份血清中有2份为阴性,2份可疑,6份阳性,即蓝耳病的感染阳性率至少为60%,该场蓝耳病的存在非常严重.
2.5 治疗效果
5d以后病情得到了稳定,整个猪群疫情得到了控制,所采取的3种不同治疗措施其结果如表1所示.
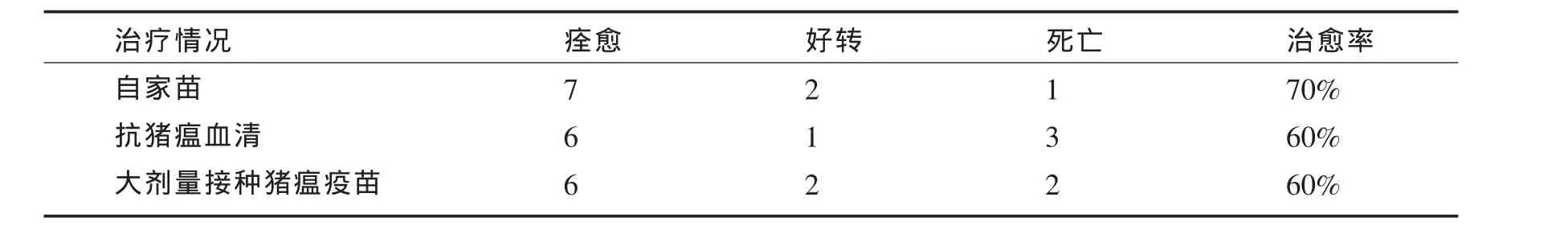
表1 CSF和PRRS混合感染3种不同治疗方法的治疗结果
从表1可以看出,3种治疗方法中,自家苗治疗效果要明显好于抗猪瘟血清和大剂量免疫接种疫苗这2种方法,统计分析结果表明,自家苗与其它2种方法相比治疗效果差异显著(P<0.05),而其中死亡原因有可能是药物本身的因素,也有可能是猪体抵抗力或应激因素存在,故有条件的情况下最好还是采用自家苗疗法.
3 讨论
通过以上流行病学调查,临床表现,病理剖检作出初步诊断,然后经实验室检查最后确诊为CSF与PRRS混合感染.因目前猪病病情严重,且基本上都是混合感染,症状非典型化,只通过流行病学和临床观察不能确诊,必须借助实验室快速、准确的检测手段才能确定病因,为临床用药提供正确的指导方向.
从实验检测结果看,部分猪瘟抗体水平仍能达到合格,这可能是由于机体处在病毒感染初期或者末期,机体的免疫系统和功能没有受到损害或者已恢复.尽管这时PRRS抗体大部分为阳性,但是体内的病毒含量较少,可能已经不会对机体的免疫系统和功能造成损害,因而不会对猪瘟的免疫应答产生明显的影响,这样猪瘟的抗体水平就有可能达到1:16及以上,猪群在感染PRRSV严重时,免疫猪瘟的效果很不理想,因此,在临床上处理猪瘟和PRRSV混合感染时,紧急预防需要加大免疫剂量,加强免疫才能够产生1:16以上水平的抗体[3],对于蓝耳病尚无有效的治疗措施,主要靠综合防制来控制该病的发生和传播,在PRRS显示阳性的猪场,使用弱毒苗时,尽量接种同源疫苗,病情严重时制备自家灭活苗,效果较好[4],故我们在采取的3种治疗方法中以自家苗治疗效果显示最好.
对于目前全国猪病严重的情况,尤其是由于PRRS的存在,使机体抵抗力下降,引起免疫抑制,易继发感染猪瘟和细菌性疾病,因此,应杜绝滥用抗生素,避免长期使用有免疫抑制性的药物(如地塞米松等糖皮质激素类药物)[5],同时,提高猪群的营养水平,避免饲喂霉败玉米,增强猪群的免疫功能.针对本猪场还应改进免疫程序,使得免疫更科学,更合理.对于种公猪和母猪按照相同的免疫日龄加大免疫剂量至8头份/头,仔猪在65日龄左右再加强1次免疫,2次免疫剂量均加大至4头份/头(以上所用均为细胞苗),其他疫苗正常免疫,所用疫苗质量必须稳定可靠.蓝耳病弱毒苗应在猪瘟免疫2周后进行,否则会影响猪瘟疫苗的使用效果,为了提高PRRS和CSF抗体水平,在注苗前几天可使用免疫增强剂如黄芪多糖等,防猪瘟苗也可同时使用低剂量(1/4~1/3驱虫量)左旋咪唑驱虫[6].
由于PRRSV在肺巨噬细胞中大量复制,它攻击猪体的免疫系统,导致机体免疫功能降低,引起猪体免疫抑制,使免疫猪抗体水平得不到应有的上升.故该场虽免疫猪瘟但仍抵抗不了外界CSF强毒的侵袭.因此采取加强饲养管理,严格消毒,同时做好CSF和PRRS的抗体检测工作,以提高猪群免疫时机的准确性和群体的高度及整齐度.
4 小结
对该猪场的发病情况通过常规流行病学调查、临床表现、病理剖检与实验室相结合的办法作出了快速准确的诊断,又采取了相应的综合治疗措施,从而使该场的病情很快得到了控制,并取得较好的治疗效果.但作为兽医工作者或猪场的管理工作人员,最重要的就是做好平时的饲养管理、环境卫生、免疫接种、预防保健等工作,不能在猪发病时再以治病、治好病为工作重心,否则将会给养殖户带来很大的经济损失.
[1]赵丽华,张凯,张国江,等.应用“复方黄芪多糖Ⅲ号”注射液治疗猪瘟与蓝耳病混合感染[J].养殖技术顾问,2006,6(6):52.
[2]陈志明,周艳平,汪有益.猪无名高热综合征的防治[J].中兽医学杂志,2007(2):31-33.
[3]张盼,张芳,杜根成,等.浅谈PRRS和PCV-Ⅱ对猪瘟抗体水平的影响[J].河南畜牧兽医,2007,28(2):31.
[4]周海范,尹玉涛,张立新,等.猪繁殖与呼吸综合征的免疫学特性和控制措施[J].河南畜牧兽医,2007,28(3):27.
[5]陈杖榴.兽医药理学[M].第二版.北京:中国农业出版社,2001.
[6]孙宝全.哺乳与保育仔猪猪蓝耳病猪瘟混合感染的诊治[J].猪场兽医,2006,1(1):48.

