78例NSCLC血清VEGF表达临床意义分析
刘新姿 钱晓萍 王朝霞 王科明 刘宝瑞 胡文静 王立峰 杨阳 禹立霞
1.南京医科大学第二附属医院肿瘤科,江苏 南京 210011;2.南京大学附属鼓楼医院肿瘤中心,江苏 南京 210008
血管形成在肿瘤的发生、发展、侵袭及转移中发挥着重要作用,已成为肿瘤治疗的新靶点之一。血管形成受血管刺激因子与抑制因子间平衡的调控,同时也涉及多种其他因子,如凋亡相关因子、生长素、生物酶和黏附因子等[1]。血管内皮生长因子(vascular endothelial growth factor,VEGF)是一种重要的促血管形成因子,是目前已知最有效最特异的因子,它通过与血管内皮细胞上的相应受体结合,能促进内皮细胞生长,同时可增强血管通透性使内皮细胞迁移,抑制内皮细胞凋亡,激活蛋白酶致使细胞外基质降解,有利于新生血管生长及延伸[2]。近年来许多学者应用免疫组织化学法检测NSCLC患者肿瘤组织中的VEGF表达,发现VEGF有助于预测患者预后,但是目前关于NSCLC患者血清VEGF变化的研究尚不是很多。笔者采用酶联免疫吸附试验(ELISA)检测了78例非小细胞肺癌(non-small cell lung cancer,NSCLC)患者化疗前血清VEGF水平,并探讨了其与疗效、预后的关系。
1 资料与方法
1.1 一般资料
收集笔者所在医院肿瘤科2001年12月~2006年1月住院的临床资料完整的NSCLC患者78例,经病理学或细胞学证实,均为初治患者。其中男44例,女34例;年龄28~76岁,中位年龄60岁。腺癌50例,鳞癌22例,其他6例(包括腺鳞癌3例,大细胞癌2例,肉瘤样癌1例)。依据国际抗癌联盟1997年修订的TNM分期标准,本组患者Ⅰ、Ⅱ期10例,Ⅲ、Ⅳ期67例,分期不明1例。其中远处转移患者包括肺转移12例,骨转移10例,肝转移3例,脑转移5例,肺骨转移5例,肾上腺转移3例,肺肾上腺转移1例,骨脑转移5例,骨肾上腺转移1例,心包转移2例。化疗前功能状态KPS评分≥70分,预计生存期>3个月。所有患者均在化疗前抽取静脉血清标本,每份血10 μL。
1.2 治疗方案
所有患者均采取新一代含铂两药联合方案为主的一线化疗,21 d为1个周期,化疗2~6个周期。NP(盖诺+顺铂)方案,GP (键择+顺铂)方案,TP(艾素+顺铂)方案,剂量为健择(GEM)800 mg/m2,d1、d8,顺铂(DDP)60 mg/m2分 5 d 用,盖诺(NVB)25 mg/m2,d1、d8,艾素(TXL)75 mg/m2,d1、d8。
1.3 检测方法
VEGF酶联免疫分析试剂盒为美国LIFEKEY生物医学技术公司产品。采用ELISA法,按照试剂盒说明书进行操作。血清VEGE>125 pg/mL视为阳性,血清VEGF≤125 pg/mL视为阴性。
1.4 疗效评价
按2000年RECIST实体瘤标准,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。疾病进展时间(TTP)为化疗开始至疾病进展的时间。CR+ PR计算总有效率。生存期(OS)为从开始化疗至死亡或末次随访的时间。
1.5 统计学处理
应用SPSS13.0软件进行统计学分析,率的比较采用x2检验或Fisher确切概率法检验,用Kaplan-Meier生存曲线及Log-Rank检验比较其预后意义,P<0.05为差异有统计学意义。
2 结果
2.1 VEGF在NSCLC患者血清中的表达
78例NSCLC患者血清VEGF水平,其中24例阳性,54例阴性,阳性率为30.8%。
2.2 NSCLC患者血清VEGF与临床特征的关系
经x2检验,VEGF表达与淋巴结转移与否、远处器官转移与否以及肿瘤TNM分期密切相关(P<0.05)。有淋巴结转移者VEGF阳性率(43.9%,18/41)明显高于无淋巴结转移者(17.6%,6/31);有远处转移者VEGF阳性率(45.8%,22/48)较无远处转移者显著升高(6.67%,2/37);TNM分期中Ⅲ、Ⅳ期者VEGF阳性率(38.5%)较Ⅰ、Ⅱ期者显著升高(0.0%),以上均有统计学意义(P<0.05)。NSCLC患者血清VEGF与患者的性别、年龄无关(P >0.05)。VEGF在腺癌中的阳性率(34%)高于鳞癌(18.2%),但差异无统计学意义(P >0.05)。见表1。
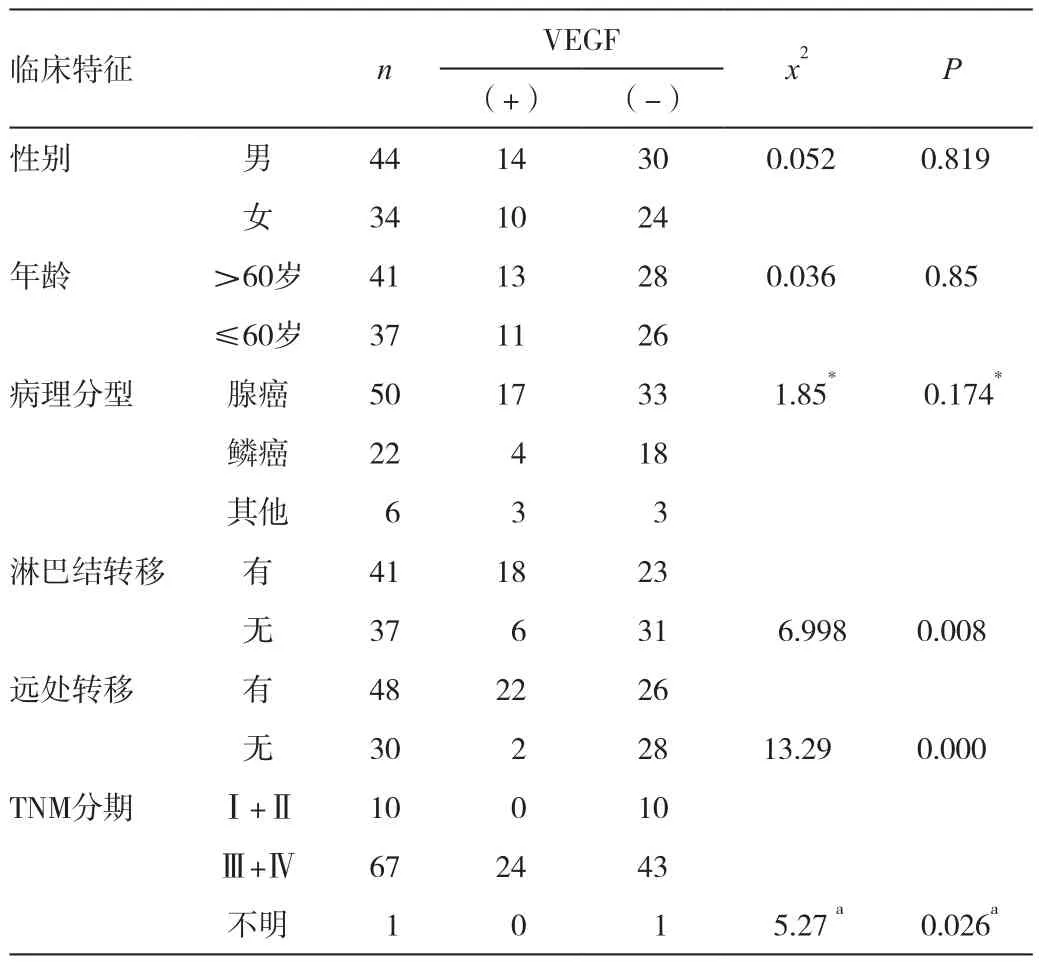
表1 肺癌VEGF与临床特征间的关系
2.3 NSCLC患者血清VEGF与化疗疗效及生存期的关系
78例患者共接受化疗248个周期,均可评价疗效,无一例完全缓解,PR 20例,SD 40例,PD 18例。VEGF阳性者的化疗有效率为4.2%(1/24),阴性患者为35.2%(19/54),后者显著高于前者(P<0.05)。见表2。随访至2006年9月30日,13例患者失访,其中5例血清VEGF阳性,8例VEGF阴性。从Kaplan-Meier生存曲线看,VEGF表达阳性组的生存曲线高于VEGF阴性组,但Log-Rank检验,两者总体生存未达到统计学上显著性差异(P=0.0741,图1)。VEGF升高患者的生存期为2~57个月,中位生存期20个月,95%CI为(8.8~31.2个月);1年生存率为63.6%,2年生存率为32.7%,3年生存率为16.4%。VEGF正常患者的生存期为2~51个月,中位生存期36个月,95%CI为(11.3~60.7个月);1年生存率为79.7%,2年生存率为52.1%,3年生存率为44.6%,两者3年生存率差异有统计学意义(P<0.05)。见表3。78例患者有77例统计了TTP,1例未计入,为VEGF阳性表达。VEGF高表达和低表达患者的中位TTP均为8个月,95%CI分别为1.6~14.4个月,4.8~11.2个月,两者TTP差异无统计学意义(P=0.2802)。见图2。
以乘积极限法计算VEGF表达阳性及阴性患者的1年、2年、3年累积生存率及两组的中位生存期。阴性组累积生存率及中位生存期较阳性组为高,提示VEGF为负性预后因子。见表3。

表2 NSCLC患者VEGF与化疗疗效的关系

表3 NSCLC患者VEGF与生存期的关系

图1 VEGF表达对NSCLC患者生存曲线的影响

图2 血清VEGF表达与TPP分析
3 讨论
肿瘤的生长和转移首先依赖于血管的生成,血管的形成过程是促进因子和抑制因子作用的结果。VEGF是血管生成过程最重要的正向调控因子,与多种肿瘤的生长、转移和预后密切相关[3]。VEGF在许多肿瘤中表达上调,导致肿瘤微环境促血管生成和抑制血管生成因子的失衡,从而促进血管化作用和生长[4-5]。
NSCLC循环VEGF水平的临床意义是有争论的。Jiang等[6-10]报道,血清VEGF在原发性NSCLC中表达增高,在淋巴结转移组表达显著高于无淋巴结转移组,而且随着肿瘤分期的进展,其水平逐渐增高,差异有统计学意义,提示与肿瘤进展与转移有关。笔者的研究也支持以上结果。而另一些研究显示相反的结果,70例SCLC或NSCLC患者并未发现血清VEGF水平与肿瘤分期或远处转移情况有显著相关性[11-14,21]。
目前还没有报道显示血清VEGF与NSCLC不同组织类型(鳞癌、腺癌、大细胞癌)有相关性[6-8],支持了笔者的发现。
笔者的研究结果表明,VEGF在非小细胞肺癌患者血清中的表达与患者的性别、年龄无关(P>0.05),而与肿瘤淋巴结转移与否、远处器官转移与否以及肿瘤的TNM分期密切相关(P<0.01)。即随着临床分期、淋巴结转移及远处转移的进展,血清VEGF阳性率可出现明显升高。这一结果说明VEGF在肺癌的生物学演进上扮演了重要角色,是肺癌恶性生物学行为的重要标记。在高度恶性、处于进展阶段的肺癌中,肿瘤组织增生活跃,分泌大量的VEGF入血,是血清中检测到高水平VEGF的重要原因,而VEGF能够增加内皮细胞磷脂酶C的活性,通过肌醇酯水解促进第2信使产生,诱导内皮细胞增殖,同时增殖了的内皮细胞又可分泌多种促肿瘤生长物质,VEGF通过以上方式与肿瘤的生长、侵袭、转移紧密联系[15]。笔者认为,肺癌患者血清VEGF高表达,在排除创伤和炎症的前提下,可能提示肿瘤的活跃生长及潜在转移。
有报道,通过免疫组化方法检测NSCLC与正常肺组织的VEGF与微血管密度的表达,研究发现两者差异具有统计学意义,NSCLC的微血管密度随VEGF表达增强而增多,VEGF表达与肺癌分化程度、分期和预后密切相关,VEGF高表达者易转移,生存期短,提示VEGF参与肺癌的发生、发展过程,其表达强度可作为判断预后的独立指标[17]。
治疗前NSCLC患者血清VEGF的预后价值还不十分清楚,仍有争议。在大多数研究中,血清VEGF对生存期无预后影响[14,21]。在肺癌中,一些报道指出血清VEGF高表达与肿瘤大小以及预后相关[9,18-20]。Laack等[7]发现血清VEGF高水平表达患者生存期显著长于低表达患者,118例NSCLC患者单因素分析中发现血清VEGF表达水平是重要的预后因子。
笔者的研究结果显示,VEGF正常患者的生存期优于VEGF升高患者,接近统计学意义(P=0.0741),可能是由于本研究患者病例较少,可进一步扩大样本量进行研究。VEGF高表达和低表达组的1年、2年生存率差异无统计学意义(P>0.01),但是从两者的生存曲线看,VEGF阳性组高于阴性组,阳性组和阴性组3年生存期差异有统计学意义(P<0.05)。以上结果提示,血清VEGF水平升高晚期NSCLC患者,其生存期缩短,预后差。将血清VEGF水平作为判断晚期NSCLC患者预后,可能具有一定的价值。
本研究还显示,78例NSCLC患者经新一代疗效类似的含铂方案化疗后评价疗效,PR 20例,SD或PD 58例,有效率为25.6%。VEGF高表达和低表达患者的有效率分别为4.17%、35.2%,其差异具有统计学意义(P<0.05),这表明NSCLC患者血清VEGF水平增高与患者的治疗反应性存在显著的负相关。这些结果直接或间接的显示铂类的治疗对较少产生VEGF的NSCLC是有效的。总之,NSCLC患者VEGF低表达可能预示对铂类反应好。
综上所述,血清VEGF可作为NSCLC患者肿瘤转移、化疗敏感性及预后的一个良好的预测指标,且ELISA测定血清VEGF检测方便,既容易又可重复,价格便宜,且创伤性达到最低,临床应用价值很大。
[1]刘叙仪.抗肿瘤新靶点药物的临床应用进展[J].中国肺癌杂志,2001,4(5):203-206.
[2]Lutsenko SV,Kiselev SM,Severin SE.Molecular mechanisms of tumor angiogenesis[J].Biochemistry (Mosc) , 2003, 68(1): 286-300.
[3]ShimanukiY,Takahashi K,Cui R,et al. Role of serum vascular endothelial growth factor in the prediction ofangiogenesis and prog-nosis for non-small cell lung cancer[J].Lung,2005,183(1):29-42.
[4]Jain RK. Tumor angiogenesis and accessibility: role of vascular endothelial growth factor[J].Semin Oncol,2002,29(suppl 16):3-9.
[5]Folkman J.Role of angiogenesis in tumor growth and metastasis[J].Semin Oncol,2002,29(suppl 16):15-18.
[6]Jiang X, Zhou JH,Deng ZH.Expression and significance of Notch1,Jagged1 and VEGF in human non-small cell lung cancer[J].Journal of Central South University Technology[J]. 2007,32(6):1031-1036.
[7]Laack E,Khler A,Kugler C,et al.Pretreatment serum levels of matrix metalloproteinase-9 and vascular endothelial growth factor in non-small-cell lung cancer[J].Annals of Oncology,2002,13(5): 1550-1557.
[8]Tamura M,Ohta Y,Kajita T, et al.Plasma VEGF concentration can predict the tumor angiogenic capacity in non-small cell lung cancer[J].Oncol Rep,2001,8(6):1097-1102.
[9]Matsuyama W,Hashiguchi T,Mizoguchi A,et al.Serum levels of vascular endothelial growth factor dependent on the stage progression of lung cancer[J].Chest,2000,118(2):948-951.
[10]Laack E,Kohler A,Kugler C,et al.Pretreatment serum levels of metalloproteinase-9 and vascular endothelial growth factor in non-small-cell lung cancer[J].Ann Oncol,2002,13(7):1550-1557.
[11]Choi JH,Kim HC,Lim HY,et al.Vascular endothelial growth factor in the serum of patients with non-small cell lung cancer: correlation with platelet and leukocyte counts[J]. Lung Cancer,2001,33(2):171-179.
[12]Suzuki M,Iizasa T,Ko E, et al. Serum endostatin correlates with progression and prognosis of non-small cell lung cancer[J].Lung Cancer,2002,35(5):29-34.
[13]Jager R,List B,Knabbe C,et al.Serum levels of the angiogenic factor pleiotrophin in relation to disease stage in lung cancer patients[J].Br J Cancer,2002, 86(5):858-863.
[14]Brattstro MD,Bergqvist P,Hesselius A,et al.Elevated preoperative serum levels of angiogenic cytokines correlate to larger primary tumours and poorer survival in non-small cell lung cancer patients[J].Lung Cancer,2002,37(1):57-63.
[15]杨毅军,石景森.血管内皮因子与肿瘤血管生成[J].中国普外基础与临床杂志,2001,8(3):205-207.
[16]Lutsenko SV,Kiselev SM,Severin SE. Molecular mechanisms of tumor angiogenesis[J]. Biochemistry (Mosc),2003,68(4):286-300.
[17]Fontanini G,Boldrini L,Vignati S,et al. Bcl22 and P53 regulate vascular endothelial growth factor (VEGF)-mediated angiogenesis in non-small cell lung carcinoma[J].Eur J Cancer,1998, 34(5):718-725.
[18]Brattstrom D,Bergqvist M,Hesselius P,et al.Elevated preoperative serum levels of angiogenic cytokines correlate to larger primary tumours and poorer survival in non-small cell lung cancer patients[J].Lung Cancer,2002,37(2): 57-63.
[19]Trape J,Buxo J,deolaguer JP. Serum concentrations of vascular endothelial growth factor in advanced non-small cell lung cancer[J].Clin Chem,2003,49(1):523-525.
[20]Kaya A,Ciledag A,Gulbay BE,et al.The prognostic significance of vascular endothelial growth factor l.vels in sera of non-small cell lung cancer patients[J]. Respir Med,2004,98: 632-636.
[21]Takigawa N,Segawa Y,Fujimoto N,et al.Elevated vascular endothelial growth factor in sera of patients with lung cancer[J].Anticancer Res,1998,18(2): 1251-1254.

