脱细胞真皮基质作为Beagle犬骨髓基质细胞移植载体的实验研究
黄永玲 闫福华 钟泉 江俊 林敏魁 赵欣 骆凯
·论著·
脱细胞真皮基质作为Beagle犬骨髓基质细胞移植载体的实验研究
黄永玲 闫福华 钟泉 江俊 林敏魁 赵欣 骆凯
目的探讨脱细胞真皮基质(Acellular dermal matrix,ADM)作为Beagle犬骨髓基质细胞(Bone marrow stromal cells,BMSCs)移植载体的可行性。方法将BMSCs复合到ADM载体上,体外观察ADM与BMSCs的生物相容性;ADM-BMSCs复合物植入裸鼠皮下,以单纯ADM为对照组,分别于术后4周和8周进行大体标本观察及组织学分析。结果体外观察ADM与BMSCs的生物相容性良好。裸鼠皮下植入实验显示,实验组4周后ADM部分降解吸收,BMSCs生长良好,出现新生组织,部分形成类骨样结构;8周后,ADM大部分吸收,形成大量的新生组织和类骨样结构;对照组新生组织形成较少,ADM支架材料降解速度与实验组类似。结论ADM可作为Beagle犬BMSCs的移植载体。
脱细胞真皮基质骨髓基质细胞支架材料裸鼠
牙周病治疗的目的是控制炎症并重建丧失的牙周组织,形成新的附着及牙槽骨的再生。近年来,组织工程学的迅速发展,为牙周组织再生提供了新的思路,其研究的内容包括种子细胞、支架材料及组织再生有关的生长因子等多个方面。在牙周组织工程中选择合适的支架材料是个重要的问题。脱细胞真皮基质(Acellular dermal matrix,ADM)具有良好的组织相容性、低抗原性、快速血管化和一定的稳定性等优点[1]。本实验以Beagle犬BMSCs为种子细胞,ADM为支架材料,观察细胞在ADM表面的黏附情况;并将细胞载体复合物植入裸鼠皮下,观察组织形成情况,探讨ADM作为牙周组织工程支架材料的可行性。
1 材料和方法
1.1 实验动物
雄性裸鼠6只,6周龄,体质量16~18 g(购于上海斯莱克实验动物有限公司)。雄性Beagle犬1只,体质量约10 Kg(购自四川省医学科学院四川省人民医院实验动物研究所)。实验动物购买后,饲养于中国人民解放军南京军区福州总医院比较医学科。
1.2 实验试剂与主要仪器
DMEM-LG培养基(Gibco,美国),新生牛血清(Gibco,美国),胰蛋白酶(Sigma,美国),L-谷氨酰胺(Sigma,美国),地塞米松(Sigma,美国),维生素C(Sigma,美国),β-甘油磷酸钠(Sigma,美国)。生物安全柜(上海力申科学仪器有限公司,上海),CO2培养箱(Heraeus,德国),荧光倒置相差显微镜(Olympus,日本),脱细胞真皮基质(桀亚莱福生物技术有限公司,北京),XL30型扫描电镜(飞利浦有限公司,荷兰)。
1.3 方法
1.3.1 ADM膜极性鉴别
通过肉眼大体观察,常规HE染色,扫描电镜观察ADM的表皮面和真皮面结构。
1.3.2 Beagle犬BMSCs体外成骨诱导培养及鉴定
参照文献[2]方法,以全骨髓培养法培养BMSCs。氯胺酮全麻下,从Beagle犬股骨近端抽取骨髓7 mL,无菌条件下注入含无血清培养基20 mL的离心管,1 000 r/min、5 min离心2次,弃上清液,于100 mL培养皿中进行培养,分别加入8 mL含10%胎牛血清的DMEM成骨诱导培养基(10-8mol/L地塞米松,50 mg/L维生素C,10 mmol/L β-甘油磷酸钠)。于37℃、5%CO2、饱和湿度下培养,2 d后半量换液,5 d后全量换液。以后每隔3 d换液,倒置显微镜下观察细胞的形态及生长状况。当细胞汇合度达90%时,用2.5 g/L胰蛋白酶+1 g/L EDTA消化传代。选取第3代成骨诱导培养基培养的细胞和未加成骨诱导培养基培养的细胞,分别以5.0×104个/孔接种于24孔板,每组6孔,每隔3 d换液,连续培养至出现肉眼可见的白色结节,行Von Kosssa染色,倒置显微镜下观察二者矿化结节染色情况,鉴定BMSCs是否成骨诱导成功。
1.3.3 细胞材料复合体的制备
将1 cm×1 cm的ADM剪成5 mm×5 mm大小,浸泡于含成骨诱导培养液的培养皿中,观察极性,使真皮面朝上。浸泡30 min后,吸去培养液,将其置入24孔板内。将第3代BMSCs消化传代后,调整细胞密度为1×107cells/L,每片ADM接种30 μL,然后37℃、5%CO2孵育2 h后取出,每孔中加入含10%胎牛血清的DMEM矿化诱导培养基800 μL,孵育24 h,倒置显微镜下观察细胞附着情况。
1.3.4 Beagle犬BMSCs与ADM生物相容性的观察
细胞-材料复合物制备后,孵育24 h,倒置相差显微镜、常规HE染色和扫描电镜观察BMSCs与ADM的复合情况。
1.3.5 BMSCs-ADM复合物植入裸鼠皮下
将24个细胞-材料复合物体外培养48 h后植入裸鼠一侧皮下,于另一侧裸鼠皮下植入单纯ADM为对照组,每侧分别植入2个样本,共6只裸鼠进行实验。所有的操作均在SPF级动物房的超净台内进行。将裸鼠用100 mg/Kg氯胺酮麻醉后消毒,于背部作前后两个约0.6 cm的切口,分离皮下,将ADM真皮面朝下,从切口处塞向两侧,每个切口左右各塞一片膜。然后用5-0 Prolene不可吸收线严密缝合切口。术后将各组动物无菌条件下分笼饲养,观察其生长状况。分别于术后4周、8周时两组随机各选3只裸鼠切取标本,4%多聚甲醛固定后,大体观察标本,10%EDTA脱钙,梯度乙醇脱水,石蜡包埋,切片,进行Gomori[3]特殊染色。
2 结果
2.1 ADM极性鉴别
ADM在组织结构上可分为表皮面和真皮面。肉眼观察,表皮面对光反射时有光泽,表面有许多点状凹陷和皮纹。真皮面对光无光泽,表面多隆起,无点状凹陷和皮纹。组织学切片显示,ADM的表皮面胶原较致密,孔隙较少,而真皮面胶原稀疏,存在很多不规则的空隙(图1-A)。扫描电镜显示:ADM膜表皮面组织致密(图1-B);真皮面组织疏松,见大量的不规则的孔隙,呈筛孔状(图1-C)。
2.2 Von Kosssa染色鉴定BMSCs成骨诱导
成骨诱导组的BMSCs约3~4 d后有结节形成,未诱导组约6~7 d后才有结节形成。1周后,Von Kossa染色可见成骨诱导组形成的结节数目明显高于未诱导组(图2)。
2.3 Beagle犬BMSCs与ADM生物相容性的观察
接种24 h后,倒置相差显微镜观察,显示ADM膜内的BMSCs生长旺盛,细胞呈梭形,排列具有一定的方向性,未见ADM对BMSCs产生明显影响(图3-A)。HE染色(图3-B)和扫描电镜下观察(图3-C)均见接种的BMSCs在ADM膜中贴附伸展状态良好,部分细胞伸出伪足到ADM膜孔隙中。
2.4 BMSCs-ADM复合物置入裸鼠体内生长情况
大体观察:术后4周时,对照组ADM变得具有弹性,透明度下降;实验组ADM肉眼可见大面积的乳白色区域,整个ADM开始变硬。8周时,对照组出现部分白色区域,部分ADM开始吸收、变小;实验组标本乳白色区域面积更大,质地更为坚硬。
Gomori特殊染色:对照组4周后周围细胞开始进入ADM内部,借助原有的胶原支架,开始自体化,Gomori染色阴性(图4-A)。实验组标本可见BMSCs聚集生长,分泌基质,并有血管长入,形成的基质经Gomori特殊染色,部分被染为红色,证明为新形成的骨组织(图4-B)。8周时,对照组周围细胞大面积进入ADM膜,部分ADM出现完全自体化。尽管周围细胞进入较多,但新生成的胶原纤维仍较少,周围细胞只是占据原有的胶原支架生长,Gomori染色阴性(图4-C)。实验组Gomori特殊染色见红色区域(即类骨样组织)面积在增大(图4-D)。
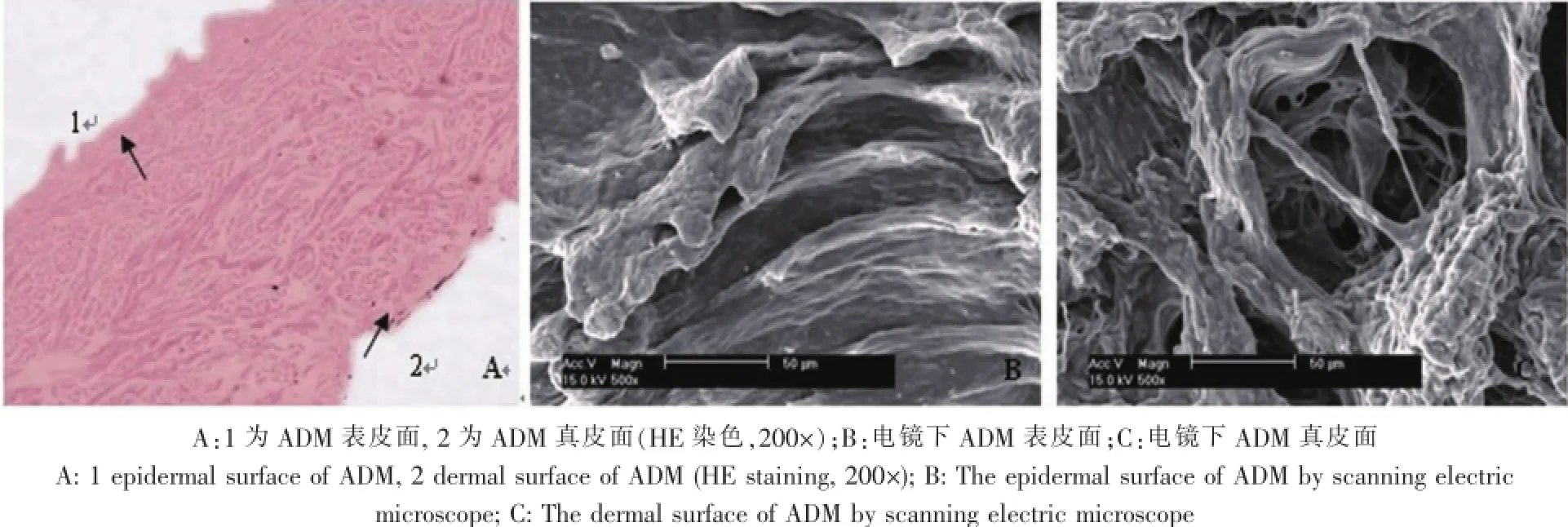
图1 ADM结构Fig.1The structure of ADM

图2 Von Kosssa染色(100×)Fig.2Von Kosssa staining(100×)
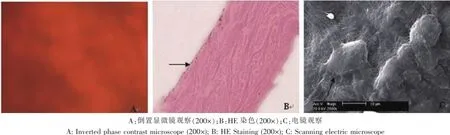
图3 BMSCs与ADM的生物相容性观察Fig.3The biocompatibility of ADM and BMSCs
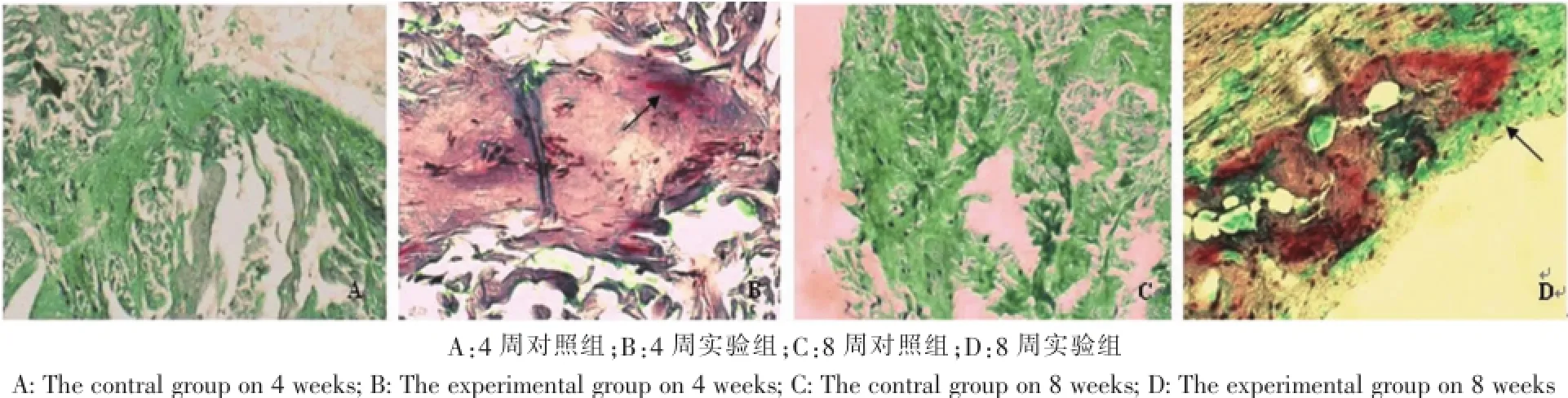
图4 Gomori特殊染色(400×)Fig.4Gomori special staining(400×)
3 讨论
近年来,组织工程学的迅速发展为牙周组织再生提供了新的思路。种子细胞、支架材料是组织工程研究中的两个重要方面。BMSCs是成体干细胞之一,具有多向分化潜能,在不同环境和相应细胞因子作用下,能向骨、软骨、肌肉和神经等中胚层或外胚层组织细胞分化[4-5],是目前用于牙周组织工程研究中主要的种子细胞之一,但对于其适宜的支架材料的选择仍不明确。
支架材料是组织工程技术应用的基础,在实施修复的过程中,不仅直接支持细胞和组织,还能影响细胞的形态,调控细胞的正常代谢、迁移、增殖。理想的支架材料应具备良好的生物相容性和表面活性,良好的可塑性以及生物降解性,并且具备三维立体结构及高度的多孔性,以便于种子细胞的植入和黏附,同时也要保证营养成分的渗入以及代谢产物的排出[6]。目前,BMSCs常用的支架材料有人工合成的聚酯类材料(如乙烯-乙酸乙烯共聚物、聚乙交酯、聚乳酸等)、羟基磷灰石、β-磷酸三钙、可溶性钙磷玻璃等生物活性材料以及胶原蛋白等多种类型。
ADM是最近几年发现的一种天然生物材料,最初用作真皮替代物,现已用于烧伤整形[7-8]、普通外科学[9]、口腔医学[10-13]等学科领域的研究。国内外已有大量的研究表明,ADM具有良好的生物相容性、低抗原性、快速血管化等优点[14]。Vendramini等[15]通过一氧化氮及过氧化氢实验,表明ADM与巨噬细胞生物相容性良好。Krejci等[16]证实成纤维细胞接种于ADM后,不仅能在其中生长,而且还能沿着原毛囊及汗腺向真皮内部浸润生长达到真皮网状层。汪海轮等[17]通过细胞毒性实验及皮下埋藏实验表明ADM无毒性,成纤维细胞在ADM微粒上增殖良好,且无排异反应。马绍英等[18]的研究也表明,人成纤维细胞可以在ADM中黏附增殖。本实验通过倒置相差显微镜、HE染色及电镜下观察Beagle犬BMSCs与ADM复合情况,提示ADM无毒性,BMSCs可在其中生长增殖,二者生物相容性较好。
在牙周病学领域,ADM受到越来越多研究者的重视。Fotek等[10]在植骨术中,比较了ADM膜和聚四氟乙烯酸(Polytetrafluoroethylene,PTFE)膜覆盖创面后的愈合效果,结果表明二者愈合效果无显著差异。大量研究表明,ADM膜也是一种较好的引导骨再生的材料[19-21]。但目前大部分研究都只关注ADM膜的屏障功能,有关ADM膜是否可直接作为成骨细胞载体使用的报道较少。江健等[22]将其作为软骨细胞移植载体修复兔软骨缺损,证明ADM的组织相容性好,适于细胞黏附及长期生长。ADM胶原支架在兔体内可基本降解,未见排异反应,12周时实验组兔软骨缺损基本修复,24周后软骨缺损修复且ADM在体内完全降解。本实验选用ADM作为BMSCs的支架材料进行裸鼠皮下实验。结果表明,BMSCs在裸鼠体内生长良好,且随着时间的延长,ADM逐渐降解,而BMSCs增殖旺盛并分泌大量基质,同时可见血管的长入,并有特征性类骨样结构的生成。因此,我们认为ADM膜与成骨细胞具有良好的生物相容性,细胞可在其中生长繁殖。我们在前期研究中使用ADM作为载体,在裸鼠背部皮下植入PDGF-B转染的牙龈成纤维细胞,也发现转染组中ADM具有类骨样结构[23]。
本实验通过体内外研究表明,ADM与Beagle犬的BMSCs具有良好的生物相容性,可作为其移植载体。研究结果也进一步表明,ADM可为细胞的生长和分化提供理想的三维空间,并具备作为牙周组织工程支架材料的潜力,在组织工程化牙周膜的构建中具有良好的应用前景。
[1]刘道峰,左金华.脱细胞真皮基质体内转归的研究进展[J].滨州医学院学报,2008,31(1):53-57.
[2]Li H,Yan F,Lei L,et al.Application of autologous cryopreserved bone marrow mesenchymal stem cells for periodontal regeneration in dogs[J].Cells Tissues Organs,2009,190(2):94-101.
[3]程敏,王颖,李保泉,等.改良的Gomori特殊染色在口腔硬组织切片中的应用[J].华西口腔医学杂志,2006,24(2):185-186.
[4]Bianco P,Riminucci M,Gronthos S,et al.Bone marrow stromal stem cells:nature,biology,and potential applications[J].Stem Cells,2001,19(3):180-192.
[5]杨琴,曾志磊,谢鹏,等.体外培养大鼠骨髓基质细胞生物学特性研究[J].重庆医科大学学报,2007,32(9):926-929.
[6]殷春一,章锦才.组织工程[J].广东牙病防治,2002,10(2):151-153.
[7]左海斌,彭代智,郑必祥,等.异体颗粒状脱细胞真皮基质与自体刃厚皮复合移植修复大鼠皮肤缺损创面效果观察[J].中华烧伤杂志,2011,27(1):10-15.
[8]Askari M,Cohen MJ,Grossman PH,et al.The use of acellular dermal matrix in release of burn contracture scars in the hand[J]. Plast Reconstr Surg,2011,127(4):1593-1599.
[9]Campbell KT,Burns NK,Rios CN,et al.Human versus non-crosslinked porcine acellular dermal matrix used for ventral hernia repair: comparison of in vivo fibrovascular remodeling and mechanical repair strength[J].Plast Reconstr Surg,2011,127(6):2321-2332.
[10]Fotek PD,Neiva RF,Wang HL.Comparison of dermal matrix and polytetrafluoroethylene membrane for socket bone augmentation:a clinical and histologic study[J].J Periodontol,2009,80(5):776-785.
[11]Fernandes PG,Novaes AB Jr,de Queiroz AC,et al.Ridge preservation with acellular dermal matrix and anorganic bone matrix cell-binding peptide P-15 after tooth extraction in humans[J].J Periodontol, 2011,82(1):72-79.
[12]Barker TS,Cueva MA,Rivera-Hidalgo F,et al.A comparative study of root coverage using two different acellular dermal matrix products[J].J Periodontol,2010,81(11):1596-1603.
[13]Núnez J,Caffesse R,Vignoletti F,et al.Clinical and histological evaluation of an acellular dermal matrix allograft in combination with the coronally advanced flap in the treatment of miller class I recession defects:an experimental study in the mini-pig[J].J Clin Periodontol,2009,36(6):523-531.
[14]刘道峰,左金华.脱细胞真皮基质体内转归的研究进展[J].医学院学报,2008,31(1):53-57.
[15]Vendramini AP,Melo RF,Marcantonio RA,et al.Biocompatibility of acellular dermal matrix graft evaluated in culture of murine macrophages[J].J Appl Oral Sci,2006,14(2):67-70.
[16]Krejci NC,Cuono CB,Langdon RC,et al.In vitro reconstitution of skin:fibroblasts facilitate keratinocyte growth and differentiation on acellular reticular dermis[J].J Invest Dermatol,1991,97(5): 843-848.
[17]汪海轮,吕咸,余春艳,等.改良消蚀法制备脱细胞真皮基质微粒及其生物相容性评价[J].中国美容医学,2007,16(12):1683-1686.
[18]马绍英,李宝明,董丽,等.异种(猪)无细胞真皮基质的制备及体外生物相容性[J].中国组织工程研究与临床康复,2009,13(38): 7424-7428.
[19]Borges GJ,Novaes AB Jr,Grisi MF,et al.Acellular dermal matrix as a barrier in guided bone regeneration:a clinical,radiographic and histomorphometric study in dogs[J].Clin Oral Implants Res, 2009,20(10):1105-1115.
[20]Jung RE,Lecloux G,Rompen E,et al.A feasibility study evaluating an in situ formed synthetic biodegradable membrane for guided bone regeneration in dogs[J].Clin Oral Implants Res,2009,20(2): 151-161.
[21]刘曼,王少安,莫安春,等.人脱细胞真皮基质的结构及与MG63成骨样细胞生物相容性的研究[J].华西口腔医学杂志,2008,26 (2):129-132.
[22]江健,孙磊,冯华,等.脱细胞真皮基质的改建及其作为软骨细胞移植载体在兔软骨缺损修复中的应用[J].中国运动医学杂志, 2008,27(4):412-415.
[23]钟泉.hPDGF-B基因修饰的组织工程化复合物修复牙周组织缺损的实验研究[D].福建:福建医科大学学位论文,2009.
An Experimental Study on Cellular Dermal Matrix as a Transplantation Scaffold for Bone Marrow Stromal Cells in Beagle Dogs
ObjectiveTo explore the feasibility of the acellular dermal matrix(ADM)as a transplantation scaffold for bone marrow stromal cells(BMSCs)in Beagle dogs.MethodsThe induced BMSCs were seeded onto ADM and the biocompatibility of ADM and BMSCs were observed in vitro.The ADM and BMSCs complex were then implanted subcutaneously in nude mice as the experimental group,and the only ADM was also implanted at the other side of the nude mice as the control group.Formed tissues were harvested for gross observation and histological analysis at 4 and 8 weeks after implantation.ResultsThe biocompatibility of ADM and BMSCs was good in vitro.In the experimental group, histological analysis demonstrated obvious degradation of ADM,good growth of BMSCs,extensive formation of new tissue and bone-like tissue at 4 weeks after surgery.At 8 weeks after surgery,the degradation of ADM was even more obvious,and more extensive formation of bone was observed.In the control group,less new tissue was formed and the degradation speed of ADM scaffold materials was similar with the experimental group.ConclusionIt is feasible for ADM as a transplantation scaffold for BMSCs in Beagle dogs.
Acellular dermal matrix;Bone marrow stromal cells;Scaffold;Nude mice
Q813.1+2
A
1673-0364(2011)04-0181-05
HUANG Yongling,YAN Fuhua,ZHONG Quan,JIANG Jun,LIN Minkui,ZHAO Xin,LUO Kai.Key
Laboratory of Stomatology,School of Stomatology,Fujian Medical University,Fuzhou 350002,China.Corresponding author: YAN Fuhua(E-mail:fhyan2005@126.com).
2011年5月23日;
2011年7月2日)
10.3969/j.issn.1673-0364.2011.04.001
国家自然科学基金(30471892),福建省自然科学基金(2008J0085),福建医科大学附属口腔医院重点学科建设学术发展基金(闽医大口腔[2008]39号)。
350002福建省福州市福建省高校口腔医学重点实验室,福建医科大学口腔医学院。
闫福华(E-mail:fhyan2005@126.com)。

