酶联免疫法测定土壤中莠去津
胡晓航,王皙玮,吴玉梅,周 芹,许庆轩
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.农业部甜菜品质监督检验测试中心,哈尔滨150080;3.黑龙江大学农作物研究院,哈尔滨150080)
酶联免疫法测定土壤中莠去津
胡晓航1,2,3,王皙玮1,2,3,吴玉梅1,2,3,周 芹1,2,3,许庆轩1,2,3
(1.黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨150080;2.农业部甜菜品质监督检验测试中心,哈尔滨150080;3.黑龙江大学农作物研究院,哈尔滨150080)
用定量酶联免疫法对土壤中莠去津的残留进行初筛,然后对阳性样品用气相色谱-质谱法进行确证,并对两种方法的回收率、精密度及检测限进行评价。向土壤样品中分别添加0.3、1.0、3.0μg/kg浓度水平的莠去津标准品时,ELISA的平均回收率为92.20%~97.14%,变异系数为1.69%~4.11%,检测限为0.04μg/kg;GC-MS的平均回收率为85.46%~87.68%,变异系数为2.93%~4.05%,检测限为0.03μg/kg。对酶联免疫试剂盒筛选的3个阳性样品用GC-MS进行确证,测定结果基本一致,结果满意。研究表明酶联免疫法重复性好、准确度较高,是一种土壤中莠去津残留的快速筛选方法。
土壤;莠去津;酶联免疫法;气相色谱-质谱法
莠去津是一种三嗪除草剂,又名阿特拉津,化学名称为2-氯-4乙氨基-6-异丙氨基1,3,5三嗪,结构式见图1。分子量为215.7,熔点为175~177℃,化学性质稳定[1],作为除草剂,莠去津持效期长,对下茬敏感作物的残留药害问题影响大。近年来,莠去津在环境中的残留不断被检测到,从而日益引起学术界和公众对环境污染和防治的广泛关注。目前,土壤中莠去津的残留分析采用的分析方法主要是高效液相色谱-质谱、液相色谱/紫外检测器、气相色谱-质谱、气相色谱/氮磷检测器、气相色谱/电子捕获检测器检测[2-5]及酶联免疫分析技术法[6]。酶联免疫法作为一种筛选方法已经受到广泛重视。本实验运用酶联免疫法和气相色谱-质谱法对甜菜地中受莠去津残留危害的土壤进行测定,并对两种方法的回收率、精密度及检测限进行评价。
1 材料与方法
1.1材料、试剂和仪器
1.1.1 样品及其制备实验所用受害土壤经风干研磨,粉末状。
1.1.2 试剂莠去津标准品(纯度≥99%,德国Dr ehrenstorfer),Atrazine ELISA(BRAXIS,Microtiter Plate)试剂盒(其中包括96微孔,6种浓度的Atrazine标准溶液,酶结合物,抗体,样品稀释液,显色液TMB,终止液,检测缓冲液,洗涤缓冲液),丙酮(Fisher色谱纯),正己烷(色谱纯),乙腈(Fisher色谱纯),甲醇(DIKMA色谱纯),NaCl(优级纯)。
1.1.3 仪器Agilent 7890/5975-MSD气相色谱-质谱联用仪,配备CTC-PAL自动进样器,Agilent 19091s-433毛细管柱(30m×250μm×0.25μm);KQ-300DE型数控超声波清洗器(产地昆山市);净化小柱Agela technologies Cleanert-Florisil-SPE(1000mg/6mL);旋转蒸发仪(英国RE300);酶标分析仪(DNM-9602G北京普朗);电脑洗板机(DNX-9620北京普朗)
1.2方法
1.2.1 样品前处理方法(1)ELISA法在一个60mL的离心管中,称取10g土壤样品(去除水分),加入30样品提取液(22.5 mL甲醇+7.5 mL水),剧烈震荡混匀,低速离心3000r/min,30min,然后放置过夜。取1mL上清用样品稀释液50倍稀释。(2)GC-MS法柱子活化,预先用5 m L正己烷+丙酮(9∶1)、5 mL正己烷淋洗Florisil-SPE萃取小柱,弃去淋洗液。称取5g土样,加入乙腈+水(5∶1)30 mL,超声20min,转移至装有NaCl的具塞量筒中,剧烈震荡,静止15min,取乙腈层15mL,70℃旋蒸近干,用2mL正己烷溶解,转移至Florisil-SPE萃取小柱,弃去淋出液,用5mL正己烷+丙酮(9∶1)淋洗萃取小柱两次,收集两次淋洗液,40℃旋蒸近干,加入1 mL正己烷定容,等待上机。
1.2.2 气相色谱-质谱(GC-MS)仪器条件Agilent毛细管柱19091S-433(30m×0.25mm i.d.×0.25μm),柱初始温度为60℃,保持1min,以15℃/min的速度升到250℃,保持4min不分流进样,进样量1μL,载气为高纯氦气,流速1.1Ml/min,进样口温度为260℃,GC-MS接口温度280℃,离子源温度230度,EI电子能量70eV,溶剂延迟时间1.7min,定量离子200扫描方式为全离子扫描。
1.2.3 ELISA分析步骤将标准品和样品所用的微孔条插入微孔架,记录标准品和样品的位置。用多道移液器在每个微孔中加入25μL检测缓冲液,在对应的微孔中加入100μL标准品或样品,再加入50μL酶结合物,在室温下孵育30min。倒出孔中液体,将微孔架倒置在吸水纸上拍打3次以保证完全除去孔中液体,每个微孔至少加入250μL,1×洗涤缓冲液,再倒掉孔中液体,重复操作3次。在每个孔中加入100μL显色剂,室温孵育20min。加入50μL终止液,30min后以各自空白为空白,在450nm下读取每个孔的吸光度值(OD)。
1.2.4 ELISA标准曲线的制作及样品浓度计算将所获得的标准品和样品的吸光度按下式折算成百分比吸光度B/B0(%):用Excel绘制出标准曲线,并计算出样品中莠去津的浓度。

1.2.5 精密度和准确度向土壤样品中添加0.3、1.0、3.0μg/kg3个浓度水平的莠去津标样,每个浓度做5次平行,同时做3个空白样。按照1.2.1的方法分别进行前处理,并用酶联免疫法和气相色谱-质谱法测定甜菜地土壤中莠去津的含量,计算回收率,变异系数(RSD%)。
2 结果与分析
2.1 莠去津的质谱图莠去津标准品一级质谱图见图2,分子量215,定量离子200。
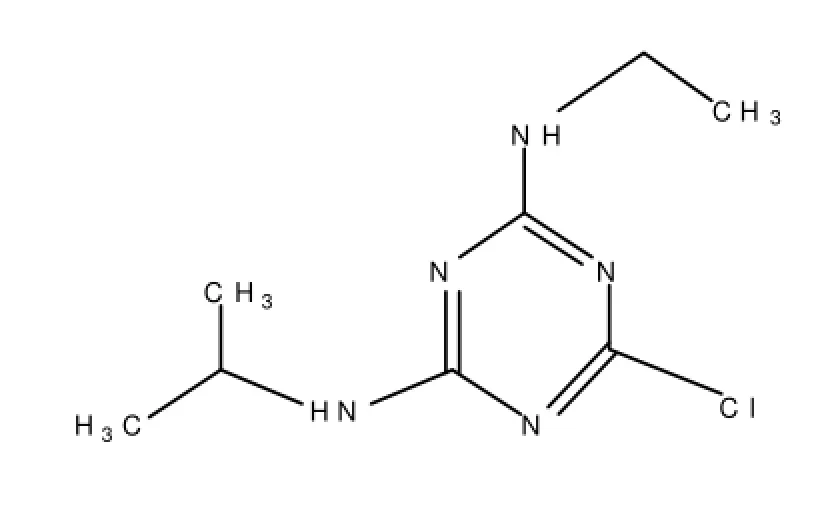
图1 莠去津的结构式
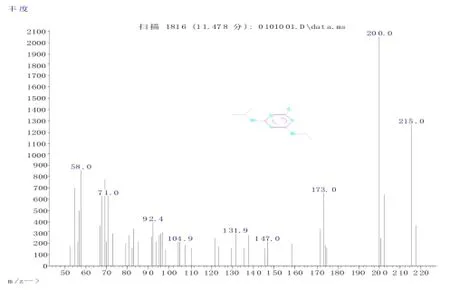
图2 莠去津的一级质谱图
2.2标准曲线
2.2.1 ELISA标准曲线按照1.2.3步骤,分别测定浓度为0、0.05、0.1、0.25、1.0、2.5、5.0μg/L莠去津标准液的吸光度,采用Excel建立标准曲线如图3
2.2.2 GC-MS标准曲线取0.1、0.2、0.5、1.0、3.0、5.0μg/L的莠去津标准液经GC-MS分析得出标准曲线如图4。
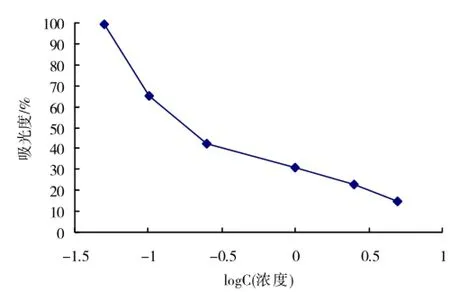
图3 ELISA标准曲线
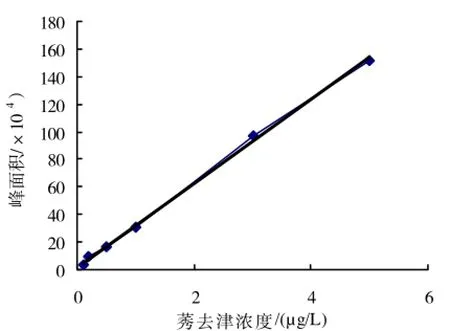
图4 GC-MS标准曲线
2.3精密度和准确度、检测限
实验的准确度以回收率表示,精密度以变异系数来表示,ELISA和GC-MS测定结果见表1。从表中可以看出,向土壤样品中分别添加0.3、1.0、3.0μg/kg浓度水平的莠去津标准品时,ELISA的平均回收率为92.2%~97.14%,变异系数为1.69%~4.11%;GC-MS的平均回收率为85.46%~87.68%,变异系数为2.93%~4.05%。GC-MS中以标准曲线中最低浓度标准溶液的浓度(0.1μg/L)定量色谱图的3倍信噪比计算检测限为0.03μg/kg。ELISA同时测定6个“0”标准液的吸光度,从标准曲线上查出对应于吸光度的各浓度,按照95置信度计算检测限为0.04μg/kg。
2.4酶联免疫法和GC-MS法检测阳性样品的确证试验对酶联免疫试剂盒筛选的3个阳性样品用GC-MS进行确证,测定结果与试剂和方法一致,结果满意,见表。
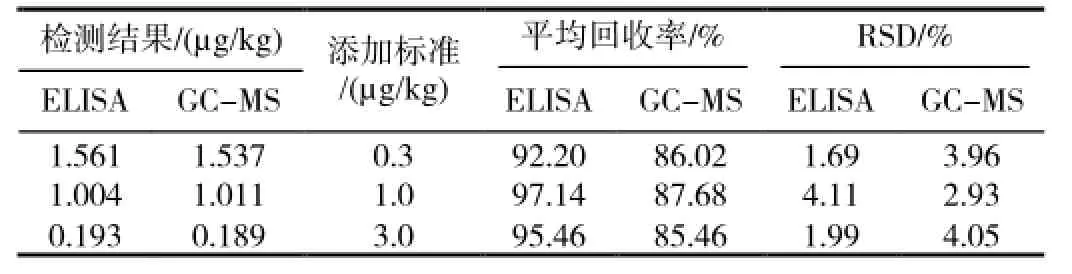
表1 ELISA与GC-MS法测定结果及加标回收率
3 结论
本实验采用酶联免疫法和气相色谱-质谱联用法测定土壤中莠去津的残留,进行加标回收率试验,0.3μg/kg加标水平的回收率分别为92.20%和86.02%,变异系数分别为1.69%和3.96%,前者适用于土壤中莠去津残留的筛选,后者适用于阳性样品的确证和精确定量。
[1]王焕民,张子明.新编农药手册[M].北京:农业出版社,1989.
[2]乔雄梧,马利平.土壤中残留的莠去津及其代谢产物的高效液相色谱和气-质谱联用分析[J].色谱,1995,13(3):170-173.
[3]任晋,蒋可,徐晓白.土壤中莠去津及其降解产物的提取及高效液相色谱-质谱分析[J].色谱,2004,22(2):147-150.
[4]李卫建,聂志强,蔡彦明,等.气相色谱法同时测定土壤中13种三嗪类除草剂残留量的方法研究[J].农业环境科学学报,2009,28(1):211-215.
[5]Lucio FCMelo,CarolHCollins,IsabelCSFJardim.High-performance liquid chromatographic determination ofpesticidesin tomatoesusing laboratory-madeNH2and C18solid-phaseextractionmaterials[J].JournalofChromatography A,2005,1073(1-2):75-81.
[6]邓安平,Franek Milan.酶联免疫吸附分析法测定水样中的阿特拉津[J].分析化学,1998,26(1):29-33.
[7]Irena Baranowska,Hanna Barchanska,Ramadan A.Abuknesha,Robert G.Price,Agata Stalmacha.ELISA and HPLCmethods foratrazineand simazine determination in trophic chainssamp les[J].Ecotoxicologyand EnvironmentalSafety,2008,70(2):341-348.
Determ ination of Residual Herbicide Atrazine in Soilby ELISA
HUXiao-hang1,2,3,WANG Xi-wei1,2,3,WU Yu-mei1,2,3,ZHOUQin1,2,3,XUQing-xuan1,2,3
(1.Key Laboratory ofSugarbeetGenetic Breeding,HeilongjiangUniversity,Harbin 150080,China; 2.Center for theControlofSugarbeetQuality,Ministry ofAgriculture,P.R.ChinaHarbin 150080,China;3.Institute forCrop Research,Heilongjiang University,Harbin 150080,China)
The residuesofherbicide Atrazinewere determined in the soil.The initialscreeningwas done by ELISA, and the positive sampleswere confirmed by GC-MS(gas chromatography-mass-spectrography),then to evaluate the recovery,accuracy and LOD(limitofdetection)of towmethods.0.3,1.0,3.0μg/kg Atrazine ofstandard substancewas added to samples of soil,mean recovery from the ELISAmethod was 92.2%-97.14%,relative standard deviation was 1.69%-4.11%,LOD was 0.04μg/kg;mean recovery from the GC-MSmethod was 85.46%-87.68%,relative standard deviation was 2.93%-4.05%,LOD was 0.03μg/kg.The determined result of the GC-MSmethod was basically consistentwith thatofELISAmethod.The resultsshowed that the ELISAmethod to determine Atrazineof soil is fast, accurateand repeatable.
soil;Atrazine;ELISA;GC-MS
S
A
1007-2624(2011)01-0028-03
2010-10-21
中央级公益性科研院所基本科研业务费专项基金资助项目(0032010056)。
胡晓航(1980-),女,助理研究员,主要从事甜菜及土壤品质及农药残留检测技术研究。E-mail:hxhlmz@163.com
吴玉梅,研究员,E-mail:zjzxwym@163.com

