Annexin A2及相关性疾病
张秀芝,肖 红
(河南职工医学院病理学教研室,郑州 451191)
在生命科学领域,新的思路、新的方法不断涌现,对于在生命过程中有着重要意义的蛋白的研究也备受青睐,膜联蛋白A 2(Annexin A2)是膜联蛋白(annexins)家族的一个重要成员,是钙离子依赖的磷脂结合蛋白。越来越多的证据表明,Annexin A2可以作为细胞表面多种物质的受体和一种细胞骨架相关蛋白,在细胞增殖、细胞分化、血管新生、胎儿免疫耐受、离子通道活化、细胞与细胞相互作用以及质膜的桥连方面等都起着非常重要的作用,在纤溶系统及凝血系统中也有重要作用。在多种肿瘤与非肿瘤性疾病中已发现有其表达和/或分布的异常。
1 Annexin A2的结构
Annexin A2是一种钙离子依赖的磷脂结合蛋白,属于annexins家族A亚家族的一个成员,有4个annexin同源性区域(结构见图1),广泛存在于多种种属的多种组织中。所有的annexins家族成员均有一个保守的C末端核心结构域和一个相对特异的氨基末端。Annexin A2的C末端存在钙离子、磷脂、纤维状肌动蛋白和肝素的结合位点,而其氨基末端存在着 P11的结合位点和调节性的磷酸化位点,体内外实验表明,其23位酪氨酸可被 SRC激酶磷酸化(并且在PDGF的刺激和胰岛素受体活化的情况下其磷酸化程度将升高);其 25位丝氨酸可被PKC(Protein Kinase C,中文:蛋白激酶C)磷酸化[1-3]。异构体 1有 352个氨基酸,异构体 2和 3具有相同的氨基酸序列(339个氨基酸),异构体 1与它们的区别在于翻译起始位点的不同,异构体 1的氨基末端比 2和 3多了 17个氨基酸。不过未见其功能不同的报道。
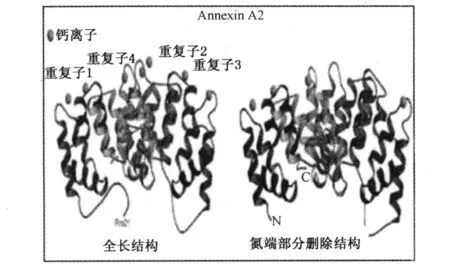
图1 Annexin A 2的丝带模型
2 Annexin A2主要存在形式
Annexin A 2(annexin A2 heterotetramer,膜联蛋白Ⅱ异四聚体)主要有3种存在形式:单体、杂合二聚体(与 3-磷酸甘油激酶结合)和杂合四聚体(两个Annexin A2亚单位与两个P11亚单位,以杂合四聚体的形式存在(AIIt)[3]。在不同的细胞和组织其单体与四聚体形式所占的比例有所不同如小肠上皮100%的以四聚体存在,在培养的成纤维细胞有50%以单体的形式存在[4-5]。Annexin A2单体存在于胞质,而杂合四聚体存在于质膜-肌动蛋白相互作用的界面处,其单体和四聚体的形式都可以与肌动蛋白结合,但四聚体可以使肌动蛋白聚集成束,动力学研究表明二者结合钙离子的能力有所不同,其功能可能与四聚体的形式有所不同
3 Annexin A2的生理功能
3.1 Annexin A2与细胞增殖和分化 Annexin A2通过诱导GM-CSF(粒-单核细胞集落刺激因子)和RANKL(核因子κB受体活化因子配基)的产生刺激软骨前体细胞的增生和分化;研究表明在多种白血病细胞系均存在Annexin A2的表达,随着这些细胞向成熟髓细胞的分化,Annexin A2的表达降低[6-7]。
3.2 Annexin A2与血管新生 在血管形成或新生的过程中涉及局部细胞外基质的降解,其中涉及多种酶的作用,如 基质金属蛋白酶、胶原酶、纤溶酶等。AIIt作为纤溶酶原激活剂和纤溶酶原的受体,可以促进纤溶酶的产生,从而加速局部基质的降解,有利于新生血管的芽生和血管外基质的重建。
3.3 Annexin A2与信号转导 Annexin A2具有多个磷酸化位点,是多种蛋白激酶如酪氨酸激酶Src、PDGFR和PKC的底物,在胰岛素信号转导的过程中,其Tyr(丝氨酸)磷酸化可能参与胰岛素受体的内化和分选机制[8]。研究表明Annexin A2 Tyr或Ser的磷酸化可以影响该蛋白对磷脂的结合: pp60src(指一个编码分子量为60 kDa磷蛋白质的病毒癌基因src,能使多种蛋白磷酸化。)对其Tyr磷酸化的结果将使Annexin A2在低浓度的钙离子情况下对磷脂的结合能力减弱PKC对其Ser的磷酸化将使其对磷脂囊泡的聚集能力受到抑制[9-10]。
3.4 Annexin A2与离子通道活化 AIIt四聚体是表皮钙离子通道瞬时受体电位香草酸亚型 5和亚型6(transient receptor potentialvanilloid receptor 5,6, TRPV5和TRPV6)在质膜通道功能的发挥所必需。TRPV5和TRPV6是迄今所知的TRP(瞬时受体势)家族中最重要的钙离子选择性通道,组成了多种上皮性细胞的钙离子流通道,是肾、近端小肠和胎盘上皮细胞活化的钙离子重吸收过程中的限速环节,对维持细胞内外钙离子的平衡起着重要作用,AIIt与TRPV5和TRPV6碳末端的保守性区域缬氨酸-丙氨酸-苏氨酸-苏氨酸-缬氨酸序列(Valine-Alanine-Threonine-Threonine-Valine,VATTV)为特异性结合,使贯穿膜的离子通道功能得到发挥,Annexin A2的表达下调或缺失可以阻止TRPV5和TRPV6介导的电流[11]。
3.5 Annexin A2与细胞骨架 AnnexinA2参与结合 4,5-双磷酸肌醇,在胞膜微区域的形成过程中起到一定的作用,实验表明其单体和四聚体形式对磷脂酰肌醇-4,5-二磷酸[Phosphatidylinositol 4,5-bisphosphate,PtdIns(4,5)P2]的结合具有中度的选择性,在此过程中 279位和 281位上保守的赖氨酸残基是必需的,这种选择性提示AIIt参与膜表面PtdIns(4,5)P2的成蔟聚集[12]。由于磷脂是胞膜的主要组成部分,其组成和分布对细胞正常生命活动的维持至关重要,AIIt可以在钙离子的调节下对磷脂进行结合和聚集;肌动蛋白是维持细胞形态的重要成分,而Annexin A 2以及AIIt可以纤维状肌动蛋白结合与其他细胞骨架成分共同维持细胞的形态,如桥粒连接蛋白(nucleoprotein,AHNAK)与四聚体相互作用共同介导调节皮质肌动蛋白细胞骨架的组装和细胞膜骨架的完整性,为细胞正常状态的维持提供基础[13]。
3.6 Annexin A2与纤溶系统和凝血系统 AIIt连接组织型纤溶酶原激活剂和纤溶酶原于细胞表面加速纤溶酶的产生并且使纤溶活性局限在特定区域,并使之避免被纤溶系统抑制剂的降解,使纤溶的效率大大增加;AIIt在凝血系统中的作用也不容忽视,有研究表明RNA干扰介导的Annexin A2/S100A 10的表达降低和竞争性肽段导致其复合状态的解离会造成 V-WF因子表达的明显降低[14-15]。
3.7 Annexin A2其他作用 Annexin A2的磷脂结合位点可以促进磷脂的聚集,在囊泡的聚集、融合以及钙依赖的胞吞和胞吐过程中扮演着重要角色,AIIt在细胞内循环内体的定位方面起作用,其中,两种亚基均为此活性所必需,二者的表达下调可以干扰对转铁蛋白受体和rab阳性的内体的分布,以及造成起形态学的改变,但转铁受体的重吸收和再循环的效率和动力学方面并没有明显改变,这种特异性可以通过Annexin A2的氨基末端和S100A10的重新表达而逆转[16].Annexin A2是调节单核细胞样细胞迁移能力的纤溶酶原的重要结合位点,其介导的单核/巨噬细胞的纤溶酶原和组织型纤溶酶原激活剂的聚集促进有利于纤溶酶的产生、基质重建和细胞的定向迁移[17]。
4 Annexin A2与多种疾病的关系
4.1 Annexin A2与肿瘤 在多种肿瘤性疾病中发现有Annexin A2的表达的改变,在一些肿瘤中如人类肝细胞癌、胰腺癌、高分级的胶质瘤、胃腺癌、急性早幼粒细胞白血病、原发性结肠癌和宫颈癌发现有Annexin A2的表达升高,细胞表面的Annexin A2作为多种物质的受体,肿瘤细胞表面Annexin A 2的表达升高,有利于纤溶酶原的活化,纤溶系统的活化可以增强癌细胞的转移潜能,也可能会导致一些出血性疾病,这在APL中得到了充分体现,在APL常伴有高纤溶特征,Annexin A2在APL细胞表面的高表达与其出血性并发症存在很大的联系[18-23]。有报道转移相关蛋白S100A4本身或者与Annexin A2组成的复合物可以加速t-PA介导的纤溶酶原激活(无论是在溶液状态下还是在内皮细胞表面),AIIt作为肿瘤细胞表面组织蛋白酶原的结合位点可以促进组织蛋白酶 B的产生,对于肿瘤细胞的浸润和转移具有重要意义。提示在Annexin A2表达升高的肿瘤,其转移浸润能力将会增强。另外在多种转化的细胞中也发现了Annexin A2的诱导性表达[24]。有研究表明Annexin A2为一钙离子依赖的核糖核酸(Ribonucleic Acid,RNA)结合蛋白,可以与核内癌基因C-myc的信使核糖核酸(messenger RNA,m-RNA)发生相互作用。由于C-myc作为一种癌基因,在多种肿瘤的发生中均起着重要作用,转染了Annexin A2基因的前列腺癌细胞(LNCAP细胞系)会导致C-myc蛋白的表达上调,提示其在肿瘤发生过程中具有一定的意义[25]。
AIIt与癌胚抗原细胞黏附分子(Carcinoembryonic Antigen Cell Adhesion Molecule,CEACAM)组成复合体,在细胞骨架的组装和组织特异性产物的分泌过程中二者其着相似的作用,这与细胞的分化状态密切相关,而分化程度的缺失或降低作为肿瘤细胞的一个重要特点,其在部分肿瘤细胞中的表达降低(如在前列腺癌和乳腺癌中发现Annexin A2和其轻链的表达下调),可能与肿瘤细胞低分化状态的维持有关[26-28]。
由于肿瘤的发生发展是一个多步骤、多阶段的过程,又存在分化程度和转移潜能的不同,其中参与其发生发展的多种因素中,对于不同类型的肿瘤同一种因素所起作用的程度或多或少存在差异,因此Annexin A2在不同肿瘤中所起的作用还有待于进一步研究。
4.2 Annexin A2与非肿瘤性疾病 研究表明:Annexin A2是1型人类免疫缺陷病毒的新的Gag结合蛋白,是HIV在单核细胞衍生的巨噬细胞中的正确组装所必需的,在人类免疫缺陷病毒(Human Immunodeficiency Virus,HIV)感染性疾病中具有一定的意义;Annexin A2的单核苷酸多态性与镰状细胞病的骨坏死有关;内皮细胞表面Annexin A 2的交叉结合和聚集成蔟可以促进抗磷脂抗体和磷脂的结合,从而促进内皮细胞的活化,这也是抗磷脂抗体综合征发作的新的机制,Annexin A 2的表达升高与弥散性血管内凝血有关;在小儿哮喘的的急性发作期, Annexin A2的表达明显升高,提示其可以其在哮喘发作过程中其着一定的作用[29-32]。Annexin A2因其磷脂结合特性,可介导质膜的凝集和融合,这种特性使得其可在巨细胞病毒和细胞膜之间起桥梁作用,可以增强巨细胞病毒对磷脂膜的结合和融合特性[33]。有研究报道在糖尿病的 RAT动脉内皮细胞在Annexin A2总量没有改变的情况下,细胞表面的Annexin A2增多,提示Annexin A2由胞内转位到胞膜的增加,鉴于其纤溶系统的重要作用,提示与糖尿病所伴随的血管并发症有关[34]。
5 展望
Annexin A2通过不同的途径参与细胞功能的多个方面,而近年的研究表明其在多种肿瘤以及许多非肿瘤性疾病中存在表达量或/和定位的改变,提示对其研究具有重要意义,鉴于在纤溶系统所占的重要地位及其与肿瘤的发生、发展与转移的关系,其在不同条件下功能和机制的进一步阐明将对一些血液系统疾病和肿瘤性疾病诊疗起到一定的推动作用, Annexin A2有望成为相关性疾病诊断或治疗的新的靶点。
[1] Gerke V,Moss SE.Annexins:from structure to functi-on[J]. Physiol Rev,2002,82(2):331-371.
[2] Filipenko N R,and Waisman D M.Annexins:Biological Importance and Annexin-related Pathologies[J].Landes Bioscience, Georgetown TX,2003:127-156.
[3] Waisman D M.Annexin II tetramer:structure and function[J]. Mol Cell Biochem,1995,149(1):301-322.
[4] Gerke V,and Weber K.Identity of p36K phosphorylated upon Rous sarcoma virus transformation with a protein from brush borders;calcium-dependent binding to nonerythroid spectrin and F-actin[J].EMBO J,1984,3(1):227-233.
[5] Zokas L,Glenney JR Jr.The calpactin lightchain is tightly linked to the cytoskeletal form of calpactin I:studies using monoc lonal antibodies to calpactin subunits[J].JCell Biol,1987,105(5): 2 111-2 121.
[6] Li F,Chung H,Reddy SV,et al.Annexin II stimulates RANKL expression through MAPK[J].JBone Miner Res,2005,20(7):1 161-1 167.
[7] W SGilmore S,Olwill H,McGlynn,et al.Annexin A2 expression during cellular differentiation inmyeloid cell lines[J].Biochemical Society Transactions,2004,32(6):1 122-1 123.
[8] Biener Y,Feinstein R,Mayak M,et al.Annexin II is a novel player in insulin signal transduction.Possible association between annexin II phosphorylation and insulin receptor internalization [J].JBiol Chem,1996,271(46):29 489-29 496.
[9] Powel M A,Glenney JR.Regulation of calpactin I phospholipid binding by calpactin I light-chain binding and phosphorylation by p60v-src[J].Biochem J,1987,247(2):321-328.
[10]Johnstone S A,Hubaishy I,and Waisman D M.Phosphorylation of annexin II tetramer by protein kinase C inhibits aggregation of lipid vesiclesby the protein[J].JBiol Chem,1992,267(36): 25 976-25 981.
[11]Van de Graaf SF,Hoenderop JG,Gkika D,et al.Functional expression of the epithelial Ca(2+)channels(TRPV 5 and TRPV6)requires association of the S100A 10-annexin 2 complex [J].EMBO J,2003,22(7):1 478-1 487.
[12]Gokhale NA,Abraham A,Digman MA,et al.Phosphoinositide Specificity of and Mechanism of Lipid Domain Formation by Annexin A 2-p11 Heterotetramer[J].JBiol Chem,2005,280(52): 42 831-42 840.
[13]Benaud C,Gentil BJ,Assard N,et al.AHNAK interaction with the annexin A 2/S100A 10complex regulates cellmembrane cytoarchitecture[J].JCell Biol,2004,164(1):133-144.
[14]Hajjar KA,Krishnan S.Annexin II:A mediator of the plasm in/ plasminogen activator system[J].TrendsCardiovasc Med,1999,9 (5):128-138.
[15]M Knop,E Aareskjold,G Bode,et al.Rab3D and annexin A2 play a role in regulated secretion ofvWF,butnot tPA,from endothelial cells EMBO J,2004,23(15):2 982-2 992.
[16]Zobiack N,Rescher U,Ludwig C,et al.The Annexin 2/S100A 10 Complex Controls the Distribution of Transferrin Receptor-containing Recycling Endosomes[J].Mol Biol Cell,2003,14(12): 4 896-4 908.
[17]Brownstein C,Deora A B,Jacovina A T,et al.Annexin IIMediates Plasm inogen-Dependent Matrix Invasion by Human Monocytes:Enhanced Expression by Macrophages[J].Blood,2004, 103(1):317-24.
[18]Frohlich M,Motte P,Galvin K,et al.Enhanced expression of the protein kinase substrate p36 in human hepatocellular carcinoma [J].Mol Cell Biol,1990,10(6):3 216-3 223.
[19]Vishwanatha JK,Chiang Y,Kumble KD,etal.Enhanced expression of annexin II in human pancreatic carcinoma cellsand primary pancreatic cancers[J].Carcinogenesis,1993,14(12): 2 575-2 579.
[20]Reeves SA,Chavez Kappel C,Davis R,et al.Developmental regulation ofannexin II(Lipocortin 2)in human brain and expression in high grade glioma[J].Cancer Res,1992,52(24):6 871-6 876.
[21]Emoto K,SawadaH,Yamada Y,etal.Annexin IIoverexpression is correlated with poor prognosis in human gastric carcinoma[J]. Anticancer Res,2001,21(2B):1 339-1 345.
[22]Menell JS,Cesarman GM,Jacovina AT,et al.Annexin II and bleeding in acute promyelocytic leukemia[J].N Engl J Med, 1999,340(13):994-1 004.
[23]Tomonaga T,Matsushita K,Yamaguchi S,et al.Identification of altered protein expression and posttranslational modifications in primary colorectal cancer by using agarose two-dimensional gel electrophoresis[J].Clin Cancer Res,2004,10(6):2 007-2 014.
[24]Ozaki T,Sakiyama S.Molecular c loning of rat calpactin I heavychain cDNA whose expression is induced in v-src-transformed rat culture cell lines[J].Oncogene,1993,8(6):1 707-1 710.
[25]Filipenko NR,MacLeod TJ,Yoon CS,etal.Annexin A 2 Isa Novel RNA-binding Protein[J].J Biol Chem,2004,279(10): 8 723-8 731.
[26]Kirshner J,Schumann D,Shively JE.CEACAM 1,a Cell-Cell Adhesion Molecule,Directly Associates with Annexin IIin a Threedimensional Model of Mammary Morphogenesis[J].JBiol Chem, 2003,278(50):50 338-50 345.
[27]Liu JW,Shen J J,Tanzillo Swarts A,et al.Annexin II expression is reduced or lost in prostate cancer cellsand its re-expression inhibits prostate cancer cell migration[J].Oncogene,2003,22 (10):1 475-1 485.
[28]Schwartz-Albiez R,Koretz K,Moller P,and W irl G.Differential expression of annexins I and II in normal and malignant human mammary epithelial cells[J].Differentiation,1993,52(3): 229-237.
[29]Ryzhova E V,Vos R M,Albright A V,et al.Annexin A 2:a novel human immunodeficiency virus type 1Gag binding protein involved in replication inmonocyte-derived macrophages[J].JVirol,2006,80(6):2 694-2 704.
[30]Baldwin C,Nolan V G,Wyszynski D F,et al.Association of klotho,bone morphogenic protein 6,and annexin A 2 polymorphisms with sickle cell osteonecrosis[J].Blood,2005,106(1): 372-375.
[31]Zhang J,and McCrae K R.Annexin A2 mediates endothelial cell activation by antiphospholipid/anti-beta2 glycoprotein I antibodies [J].Blood,2005,105(5):1 964-1 969.
[32]Katsunuma T,Kawahara H,Suda T,et al.Analysis of gene expressionsof T cells from children with acute exacerbationsof asthma.Int.Arch.Allergy Immunol,2004,134(1):29-33.
[33]Raynor C M,Wright JF,Waisman D M,et al.Annexin II enhances cytomegalovirus binding and fusion to phospholipid membranes[J].Biochemistry,1999,38(16):5 089-5 095.
[34]Lei H,Romeo G,Kazlauskas A.Heat Shock Protein 90 Dependent Translocation of Annexin II to the Surface of Endothelial Cells Modulates Plasm in Activity in the Diabetic Rat Aorta[J].Circ Res,2004,94(7):902-909.

