纳米脂质体槲皮素联合8-Br-cAMP对Rb44细胞凋亡的影响*
郭慧丽,张明昌,郑乃刚,吴景兰,王爱凤
1)华中科技大学同济医学院附属协和医院眼科武汉 430032 2)郑州大学分子细胞生物学研究中心 郑州 450001 3)河南省人民医院眼科郑州 450003
△女,1965年5月生,硕士,主任医师,研究方向:眼底病的基础与临床,E-mail:gse_2005@126.com
槲皮素为无毒性植物类黄酮的有效成分之一,可通过阻抑蛋白激酶C(PKC)信号途径发挥抗癌效应[1]。无毒性的8-Br-cAMP为cAMP类似物,通过与PKA受体Ⅱ型(PKARⅡ)结合,抑制癌细胞的增殖而促进其分化[2]。作者观察了纳米脂质体槲皮素(nLQ)和8-Br-cAMP(Br)诱导人视网膜母细胞瘤Rb44细胞凋亡的协同效应,并应用原位杂交检测抑癌基因p53和p21waf1 mRNA的表达,免疫细胞化学检测Bcl-2及Bax蛋白的表达和最终共同凋亡途径Caspase-3蛋白的表达,初步探讨其可能机制。
1 材料与方法
1.1 材料 Rb44细胞购自湖南长沙湘雅医学院细胞中心。槲皮素、80 nm孔径滤膜、Br、Triton-X100及细胞裂解液购自美国Sigma公司;胎牛血清购自天津TBD公司;蛋白酶K、NBT/BCIP、鲱鱼精DNA、末端脱氧核苷酸转移酶(TdT)、碱性磷酸酶标记的链霉亲和素(SA-AP)以及探针标记盒购自美国Promega公司;biotin-16-dUTP购自德国Rouche公司;免疫细胞化学反应中一抗购自美国Santa Cruz及Zymed公司;通用型SP试剂盒购自北京中杉金桥生物技术有限公司。
1.2 nLQ的制备 将槲皮素、胆固醇、卵磷脂、脑磷脂及聚乙二醇-4 000以质量比 6∶4∶9∶5∶1混匀,用V氯仿:VDMSO为 3∶1的溶剂完全溶解,真空旋转仪旋转蒸发4~8 h,PBS水化,将脂质体槲皮素置于超声破碎仪中反复多次破碎,制备的脂质体槲皮素通过80 nm滤膜后获得nLQ。
1.3 细胞培养与分组 将Rb44细胞置于加有体积分数10%胎牛血清的RPMI 1640液中,在36.5℃体积分数5%CO2培养箱(Sanyo,日本)内培养。Rb44细胞分为4组:nLQ组给予终浓度为40μmol/ L nLQ;Br组给予终浓度为2×10-5mol/L 8-BrcAMP,联合用药组给予同上浓度的nLQ和Br,对照组不给药。
1.4 各组细胞凋亡检测 采用TUNEL法。40 g/L多聚甲醛固定各组细胞标本,以冷风吹透,体积分数0.3%Triton-X100/PBS透化后,5 g/L蛋白酶K 37℃消化标本10min,40 g/L多聚甲醛后固定5 min。各标本加15μL末端脱氧核苷酸转移酶(TdT)缓冲液,4℃过夜。pH7.5的Tris-Cl缓冲液1∶500稀释碱性磷酸酶标记的SA-AP,37℃孵育20 min,NBT/ BCIP 37℃孵育30 min,显色。同时设以PBS代替TdT酶孵育液的阴性对照。选取细胞数目较多的视野,连续计数 200个细胞,计算细胞凋亡率。
1.5 各组细胞p53和P21 waf1m RNA的检测40 g/L多聚甲醛固定的各组细胞标本以冷风吹透,体积分数0.3%Triton-X100/PBS透化后,经5 g/L蛋白酶K 37℃消化10min,40 g/L多聚甲醛后固定5 min,2×SSC洗涤。经2.3 g/L三乙醇胺和0.1 mol/L醋酸酐处理10 min后,加不含探针而含鲱鱼精DNA的杂交液预杂交,42℃3 h,生物素标记的p53 cDNA探针或p21waf1 cDNA探针工作浓度为1∶100,42℃下杂交过夜。杂交后以0.1×SSC洗4次,每次15min。10 g/L乙酰化BSA封闭37℃10 min,加1∶1 000稀释的SA-AP 37℃孵育20 min,再先后以Tris-Cl、pH 7.5和pH 9.5的缓冲液洗标本,用NBT/BCIP底物显示蓝紫色杂交信号,同时设不加探针的阴性对照。应用图像扫描仪(中国山富)扫描图像获灰度均值。
1.6 各组细胞Bcl-2、Bax及Caspase-3蛋白的检测40 g/L多聚甲醛固定各组细胞标本,以体积分数0.3%Triton-X100/PBS和正常血清封闭处理后,应用Bcl-2、Bax及Caspase-3的一抗,其中Caspase-3为兔的多抗以外,其他均为鼠的单抗。各抗的工作浓度均为1∶100。加通用型SP试剂孵育,DAB显色。同时设以PBS代替一抗的阴性对照。以胞质棕色着色为阳性细胞。应用图像扫描仪(中国山富)扫描图像获灰度均值。
1.7 统计学处理 采用SPSS 12.0进行分析。对4组细胞凋亡率、p53和p21waf1 mRNA的表达及Bcl-2、Bax及Caspase-3蛋白的表达行2×2析因设计的方差分析,检验水准α=0.05。
2 结果
2.1 4组细胞凋亡率的比较 结果见表1。

表1 4组细胞凋亡率的比较(n=5) %
2.2 4组细胞p53和p21waf1m RNA表达的比较
结果见表 2、3。
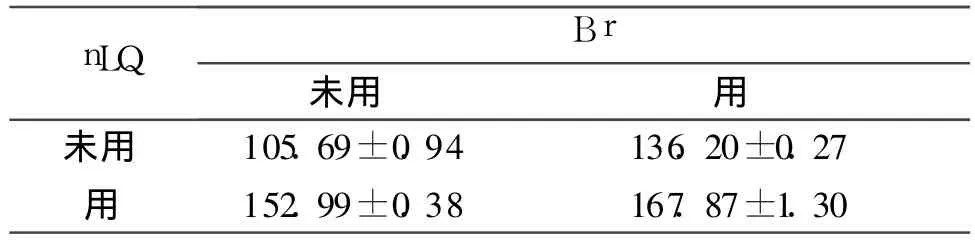
表2 4组细胞p53mRNA表达的比较(n=6)
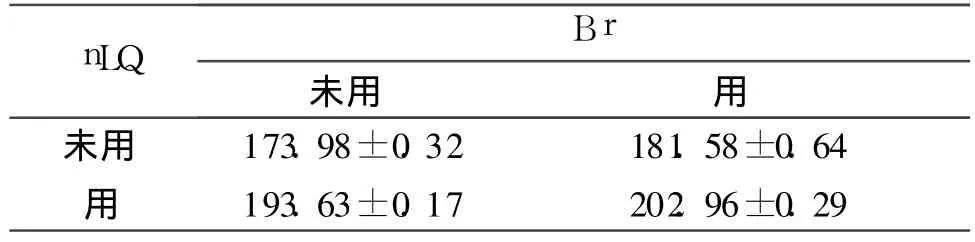
表3 4组细胞p21w af1m RNA表达的比较(n=6)
2.3 4组细胞Bax、Bcl-2及Caspase-3蛋白表达的比较 结果见表4~6。
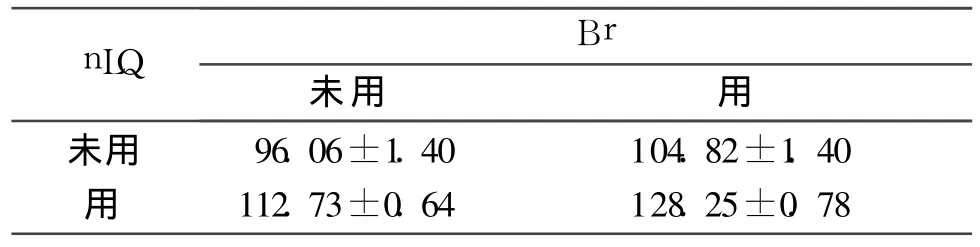
表4 4组细胞Bax蛋白表达的比较(n=6)
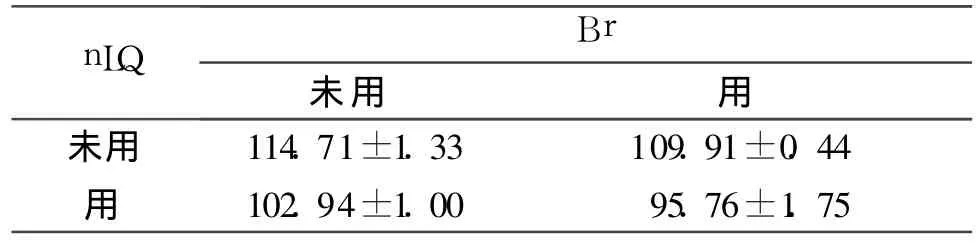
表5 4组细胞Bcl-2蛋白表达的比较(n=6)
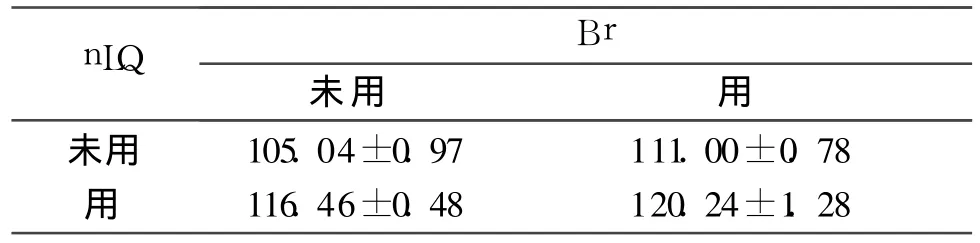
表6 4组细胞Caspase-3蛋白表达的比较(n=6)
3 讨论
凋亡为细胞的主动性自杀过程。细胞凋亡主要有3条途径:①通过 p53等抑癌基因的激活抑制细胞周期的进展并激活其下游凋亡相关基因的表达。②通过线粒体途径上调前凋亡蛋白 Bax,下调抗凋亡蛋白Bcl-2等的表达。③通过死亡受体如Fas-L的 Fas受体等[3]。前凋亡细胞通过蛋白裂解功能的Caspase的级联反应,最后通过共同的Caspase-3途径导致凋亡。Vargas等[4]报道在槲皮素抗黑色素瘤细胞增殖中 p53起中心作用。槲皮素可通过启动p53,抑制NF-κB,阻抑细胞周期进展和以线粒体为中介而诱导人宫颈癌 HeLa细胞凋亡[5]。Chou等[6]报道槲皮素诱导乳癌 MCF-7细胞凋亡是通过线粒体途径及激活Caspase的级联反应而实现的。
该研究结果表明不但Br或nLQ可通过上调p53和p21waf1基因的表达,下调Bcl-2蛋白的表达,上调Bax和Caspase-3蛋白的表达,提高凋亡率;而且nLQ及Br的联合应用呈现协同效应。这与应用非脂质体槲皮素和Br诱导人食管癌细胞凋亡的效应相符[7-8],提示nLQ和 Br可能各通过抑制不同的主要信号转导途径而呈现互补的凋亡诱导效应。
[1]Zhang XM,Huang SP,Xu Q.Quercetin inhibits the invasion ofmurinemelanoma B16-BL6 cells by decreasing pro-MMP9 via the PKC pathway[J].Cancer Chemother Pharmacol,2004,53(1):82
[2]Cheadle C,Nesterova M,Watkins T,et al.Regulatory subunits of PKA define an axis of cellular p roliferation differentiation in ovarian cancer cells[J].BMCMed Genomics,2008,1:43
[3]Gagiannis S,Mu ller M,Uhlemann S,et al.Parathyroid hormone-related protein confers chemoresistance by b locking apoptosis signaling via death receptors and m itochond ria[J].Int JCancer,2009,125(7):1551
[4]Vargas AJ,Sittadjody S,Thangasamy T,et al.Exploiting tyrosinase expression and activity in melanocytic tumors: quercetin and the central role of p53[J].Integr Cancer T-her,2010[Epub ahead of print]
[5]Vidya Priyadarsini R,Senthil Murugan R,Maitreyi S,et al.The flavonoid quercetin induces cell cycle arrest and m itochondria-mediated apoptosis in human cervical cancer (HeLa)cells through p53 induction and NF-kB inhibition [J].Eur JPharmacol,2010,649(1/3):84
[6]Chou CC,Yang JS,Lu HF,et al.Quercetin-mediated cell cycle arrest and apoptosis involving activation of a caspase cascade through them itochondrial pathway in human breast cancer MCF-7 cells[J].Arch Pharm Res, 2010,33(8):1181
[7]Wang HM,Zheng NG,Wu JL,etal.Dualeffects of 8-BrcAMP on differentiation and apoptosis of human esophageal cancer cell line Eca-109[J].World JGastroenterol,2005, 11(41):6538
[8]宫璀璀,王文丽,吴景兰,等.8-Br-cAMP和槲皮素单独和联合应用对Eca-109细胞凋亡和Bcl-2、Bax、XRCC 1等凋亡相关蛋白的作用[J].郑州大学学报:医学版, 2003,38(5):698

