氯化和UVC灭活铜绿微囊藻的机理*
欧桦瑟 高乃云 郭建伟 梅红 李甜 董磊
(1.同济大学环境科学与工程学院∥污染控制与资源化研究国家重点实验室,上海200092; 2.上海大学环境与化学工程学院,上海200444)
近年来水体富营养化问题日益严重,江河湖泊以及近海均有水华爆发并对人类的正常生活、生产建设和社会活动产生了重大影响,甚至造成了巨大的经济和社会损失,因而引起了人们的广泛关注[1-2].铜绿微囊藻作为常见淡水藻,是我国滇池和太湖等湖泊的主要危害型藻种,其过量繁殖会产生多种危害,包括产生剧毒微囊藻毒素(MCs)和嗅味物质,同时藻细胞分泌物和残体形成藻源溶解性有机物(AOM),它是天然有机物(NOM)的重要组成,其中含有多种消毒副产物(DBPs)的前体物[3],会对饮用水安全构成重大威胁.
采用荧光光谱技术研究NOM是近年来的研究热点.荧光光谱技术具有选择性好,灵敏度高(10-9数量级),且不破坏样品结构的优点,适用于研究生化水质样品的化学和物理性质[4].目前常用的荧光光谱技术有荧光激发光谱、荧光发射光谱、同步荧光光谱以及荧光光谱矩阵(EEM).EEM已被广泛用于海洋和环境方面的水质调查和检测中,国内外学者和研究人员用其对腐殖质、蛋白质、氨基酸等溶解性有机物(DOM)成分进行了研究[5],同时将其应用在膜处理方面;近年来亦有研究人员在含藻水的水质跟踪调查中采用EEM.藻类属于微生物,对藻类的研究还需结合一定的生化指标和检测技术.本研究采用EEM技术,结合常见生化指标,包括总蛋白含量、藻蓝蛋白含量、叶绿素a含量、藻毒素(MC-LR)含量以及溶解性有机碳(DOC)含量(均指质量浓度),对氯化(即投加NaClO)和短波紫外线照射(UVC)的灭活铜绿微囊藻(Microcystis aeruginosa)过程进行对比,深入探讨其反应机理,以期为实际除藻过程中的水质检测和生化分析提供有效的指导和理论参考.
1 材料和方法
1.1 藻种的培养
铜绿微囊藻藻种(Microcystis aeruginosa,FACHB-912)购自中国科学院武汉水生生物研究所,采用BG11培养基进行培养.铜绿微囊藻母液在恒温培养箱中于(25±1)℃下进行培养,培养箱内光照度为1500 lx,光暗周期为12h∶12h.试验时,取一定量处于对数期的藻母液用灭菌BG11培养基稀释到所需浓度,从而得到实验用液.
1.2 实验试剂
采用36.5%的NaClO溶液(分析纯,由国药集团化学试剂有限公司生产),于实验前30 min配制并使用便携式检测仪按照国标方法进行质量浓度检测.用KH2PO4-NaOH缓冲溶液对反应溶液的pH值进行调节.试验用水均采用Milli-Q超纯水,纯水机由美国Millipore公司生产.
1.3 实验方法
采用同一培养阶段的铜绿微囊藻进行反应,实验前用显微镜镜检测定单位体积内藻细胞个数并调节pH值到6.8,以藻密度为4.6×107个/mL的藻悬浊液进行反应.分别采用氯化和UVC照射两种方法对其进行处理,其中,UVC单位照射剂量为23W/m2UVC照射装置如图1所示.NaClO溶液初始质量浓度为3mg/L(以Cl2计).在特定时间取样(取样容器中预加Na2SO3溶液,用于终止反应),取样后立即离心10min(5000 r/min),上清液用GF/F滤纸(由英国Whatman公司生产)过滤,得含有胞外溶解性有机物(EDOM)的溶液;过滤后将滤纸捣碎,与离心管沉积物混合并用超纯水定容;采用连续冻融法(重复3次),通过镜检确保藻细胞破裂达到90%以上,然后用GF/F滤纸过滤,即得胞内溶解性有机物(IDOM)溶液.
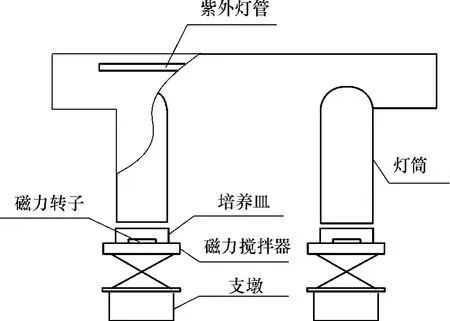
图1 准平行UVC照射装置示意图Fig.1 Schematic diagram of collimated UVC irradiation device
1.4 分析方法
EEM采用日本Hitachi公司生产的 F-4500型荧光光谱分析仪进行测定.激发光源为150 W的氙弧灯,光电倍增管(PMT)电压为700 V;激发带通为5 nm,发射带通为 10 nm;激发波长λex=215~450nm,发射波长λem=280~550 nm;扫描速度为1200nm/min;扫描光谱进行仪器自动校正.使用Matlab软件进行EEM数据处理.采用e2695-2489高效液相色谱系统(美国Waters公司),配合岛津公司的VP-ODS色谱柱(250.0 mm×4.6 mm)测定MC-LR含量;流动相为体积比为6∶4的甲醇/超纯水混合溶液,其中甲醇为HPLC纯,德国Merck公司生产,超纯水中预先添加0.05%(体积分数)的三氟乙酸;流动相流速为1mL/min,柱温为40℃.
DOC含量采用TOC-VCPH分析仪(日本Shimazu公司)进行检测;总蛋白含量采用考马斯亮蓝法测定;藻蓝蛋白含量采用OTSUKI所述方法进行检测[6];叶绿素a含量采用文献[7]中所述方法进行提取和检测;pH值采用PHS-3C型pH计测定.
2 结果和讨论
2.1 铜绿微囊藻的常规参数和EEM特性
对数生长期的铜绿微囊藻的各项水质和生命指标见表1.图2(a)和2(b)分别为对数生长期铜绿微囊藻的胞外和胞内溶解性有机物的EEM特征.
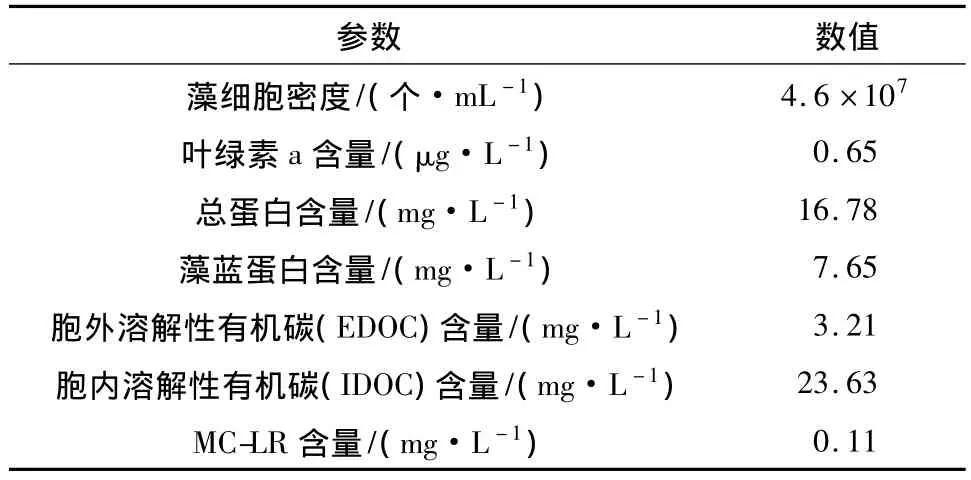
表1 铜绿微囊藻的特征参数Table 1 Characteristic parameters of Microcystis aeruginosa
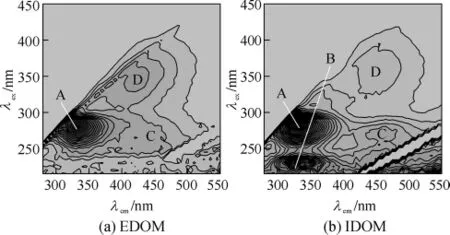
图2 对数生长期铜绿微囊藻的EDOM与IDOM的EEM特征Fig.2 EEM properties of extracellular and intracellular dissolved organic matters of Microcystis aeruginosa in logarithmic growing period
由图2中可知:EDOM只有一个比较明显的荧光峰(峰A,位于λex=280 nm、λem=331 nm处),属于类蛋白质物质的峰;在λex>250 nm,λem>350 nm的区域内有一片强度低、宽阔的峰带(峰C和D),属于类腐殖质物质的峰.位于峰A的荧光有机物主要为微生物溶解性有机物,可能是由一些带有荧光基团(色氨酸、苯丙氨酸、酪氨酸)的氨基酸、多肽和蛋白质所组成的;根据文献[8],峰C和D所代表的物质是由藻体分泌物以及死亡藻类细胞残留物所构成的,包括类富里酸和类腐殖酸等,成分复杂;较低的响应值说明处于对数生长期的藻类悬浊液中,藻类活性高,细菌数量少且细菌降解活动不明显.
与EDOM不同,IDOM具有4个较明显的荧光峰,分别是两个类蛋白质物质的峰A和B(峰A位于λex=280 nm、λem=331 nm处,峰 B位于λex= 230nm、λem=330 nm处)以及两个类腐殖质物质的峰C和D(峰C位于λex=273nm、λem=450nm处,峰D位于λex=354 nm、λem=447 nm处).其中,峰A和B面积广,强度大,对应于多种荧光物质,微生物产生的溶解性有机物、芳香族蛋白质以及酚类物质在峰A位置均有响应[5],而类酪氨酸和类色氨酸芳香族物质在峰B位置有响应.峰A和B表征了正常的蓝藻细胞中所含的多种荧光物质,主要有:蛋白质(酶、藻蓝蛋白)、多肽(藻毒素)、氨基酸、DNA以及叶绿素a(叶绿素a属于疏水物质,提取的IDOM中含量极少).峰C和D主要为类富里酸和类腐殖酸物质的峰,它们可能来源于死亡的藻细胞.
2.2 氯化和UVC处理铜绿微囊藻的机理分析
2.2.1 UVC反应过程中的多参数特性分析
UVC属于短波紫外光,190~280 nm波长范围的紫外光都属于UVC,本实验采用波长为254nm的紫外光照射灭藻.UVC照射引起的胞内外溶解性有机物的EEM特征变化见图3,每个EEM谱图反映了该时间点的荧光物质特性.图4为UVC反应过程中EEM各个特征峰的峰值(FI)变化,其中t表示时间.由图3、4可知,EDOM的主要特征峰为峰A、C和D,其中,峰A的荧光强度随着时间延长逐渐减弱,而峰C和D的则先增强后减弱;FI可以提供定量分析,原样的峰A的FI为142 AU,反应20 min后减少为53 AU,60 min后基本检测不出;原样的峰C和D的FI在20~40 min产生突跃,FI分别从33 AU和23 AU增加到200 AU和140 AU,之后又有所降低.IDOM的EEM谱图则包括4个峰:峰A、B、C和D,其中,峰A和B的响应值在0~60 min均降低,FI分别从545 AU和293 AU逐渐降低到30 AU和20 AU;而峰C和D的FI则随时间的延长先增后减,曲线拐点出现在20 min时,和EDOM的峰C和D的FI突跃过程同步.
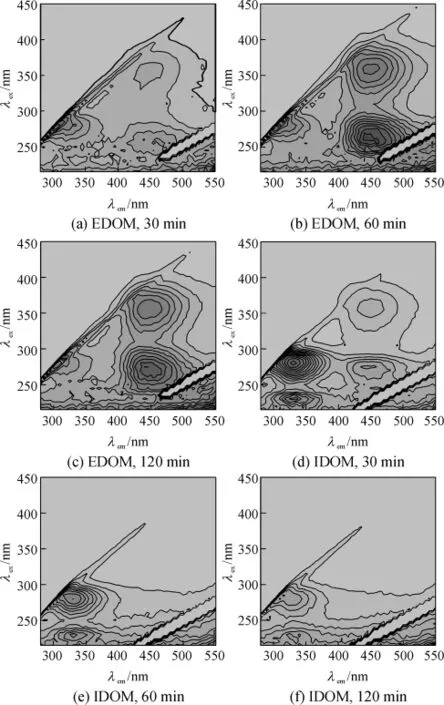
图3 UVC反应过程中铜绿微囊藻的EDOM和IDOM的EEM特征变化Fig.3 EEM properties of extracellular and intracellular dissolved organic matters of Microcystis aeruginosa under UVC treatment
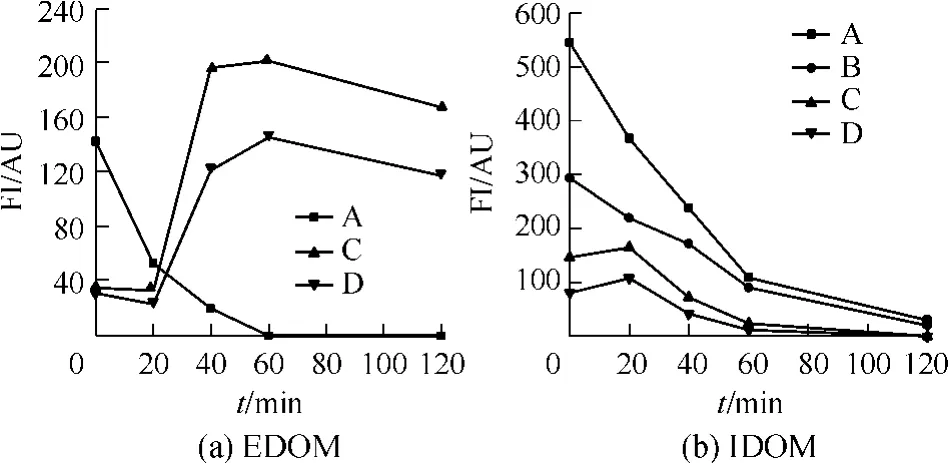
图4 UVC反应过程中EDOM和IDOM的FI变化Fig.4 Variation of FI of extracellular and intracellular dissolved organic matters under UVC treatment
UVC照射引起的铜绿微囊藻的生化指标和DOC含量的变化见表2.四种物质对UVC具有不同的耐受性,降解速度为:MC-LR>藻蓝蛋白>总蛋白>叶绿素a.DOC含量的变化则具有一定的互补性,但总和并非恒定值,即UVC降解过程中有一定的矿化作用.
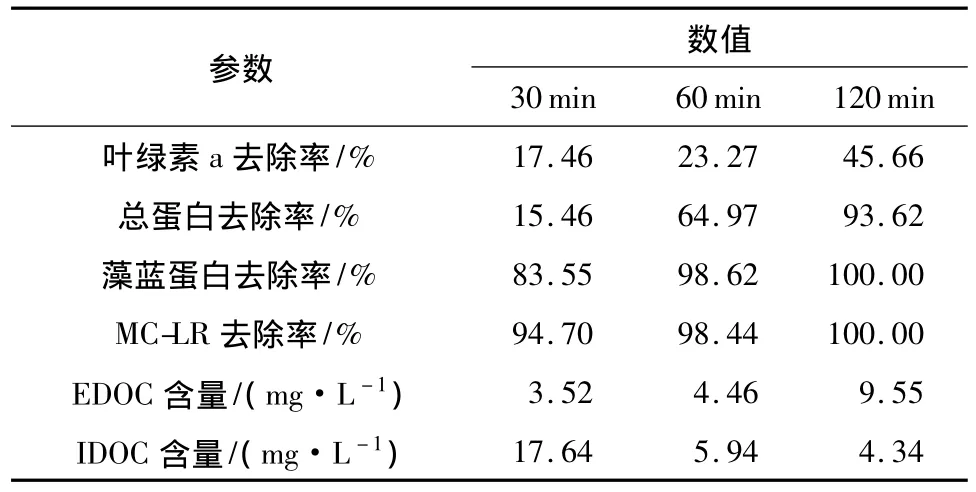
表2 UVC反应过程中生化指标和DOC含量的变化Table 2 Variations of biochemical parameters and DOC content under UVC treatment
EEM、生化指标以及DOC含量的变化对解释UVC的灭藻机理具有重要意义.在本实验中,UVC主要通过光降解和高级氧化进行灭藻.UVC具有强透射性,高强度UVC能引发细胞内蛋白质、多肽、氨基酸等的光降解;同时,UVC能在细胞内和细胞外同时引发强氧化性物质的生成,如OH·、H2O2等,对藻细胞具有强烈的刺激和氧化作用.
反应前期(0~30 min),藻细胞在UV照射下仍保持完整的细胞形态,但此时其胞内外生命物质已开始降解.最明显的为胞内的MC-LR及藻蓝蛋白,UVC照射下两者在 30 min时的去除率分别为94.70%和83.55%.MC-LR属于多肽,藻蓝蛋白是蓝藻主要的捕光色素,分布于类囊体表面,在UV波段有较强的吸收,研究已证实MC-LR和藻蓝蛋白对UVC具有高度的敏感性,在UVC照射下MC-LR能快速降解[9].此外,蓝藻光系统Ⅱ(PSⅡ)的D1蛋白对UVC极为敏感,大量研究表明UVC照射会导致Dl蛋白的光降解,使PSⅡ功能下降.藻细胞自身的过氧化防御体系也依赖多种酶类的作用,在UVC透射时亦受到破坏.以上多种反应将藻细胞内部的生命活性物质氧化为类腐殖质物质,促成前期IDOM的峰A、B向峰C、D的转化(见图3),并引起反应中期(30~60 min)藻细胞的大量死亡、破裂和IDOM的释放,以及 IDOM类蛋白物质的骤减和EDOM类腐殖质物质的突增(见图3(b)和3(e)).30min时总蛋白去除率为15.46%,而60 min时为64.97%,在60 min时藻细胞群体已经死亡一半以上,到120min时可认为全部死亡.
值得注意的是,胞内叶绿素a对UVC的敏感度较低,说明UVC对活体叶绿素a的降解效果并不明显,120min时只达到45.66%的去除率,这可能和细胞内多种保护体系以及叶绿素a自身的光敏性有关;而藻蓝蛋白在30 min即被降解83.55%,说明UVC在铜绿微囊藻灭活过程中的决定性因子应为藻蓝蛋白而不是叶绿素a,采用叶绿素a作为灭活率指标并不适用于高强度的UV灭藻.
2.2.2 氯化反应过程中的多参数特性分析
氯化反应过程中有效物质为HClO,灭活过程中EDOM和IDOM的EEM谱图见图5,FI变化如图6所示.EDOM的EEM变化过程有3个特征峰,分别为峰A、C和D,其中,峰A的强度减弱了14%,说明HClO对藻悬浊液的胞外溶解性类蛋白质物质的降解效果不明显;而峰C和D的则有较大增加,响应值分别从35AU和30AU增加到860AU和501AU;突跃位于20min前后,说明此时藻细胞大规模破裂和释放,随后峰C和D的FI一直增加,说明水中的游离态HClO继续反应,生成大量类腐殖质物质.IDOM的EEM特性变化则分成两种趋势,类蛋白质物质峰A和B的荧光强度均随着反应减弱,其FI在0~25 min内分别从560 AU和300 AU降低到56AU和49AU;而峰 C和 D的则先升后降,0~25min内分别从150 AU和90 AU上升到870 AU和430AU.反应60 min后IDOM的类蛋白质物质明显减少,被降解并形成EDOM的腐殖质物质,随着反应不断增加且有明显的残留.
生化指标以及DOC含量的变化见表3.降解速率为:藻蓝蛋白>总蛋白>MC-LR>叶绿素a,说明氯化灭藻机理与UVC的明显不同.氯化处理时,藻蓝蛋白和总蛋白在30min的去除率分别为96.44%和60.36%,而30min之后EDOC含量突然增加,因此认为30 min之前主要为胞内降解.这和HClO具有细胞壁/膜穿透性密切相关,反应前期(0~30min),HClO和藻细胞接触后穿透进入细胞,对细胞内部结构和活性物质进行氧化和降解,而这期间藻细胞的完整性仍然维持,但其内部结构和蛋白质等物质却逐渐被渗入的HClO破坏,宏观上表现为IDOM的类蛋白质含量(峰A和B)的减少和类腐殖质含量(峰C和D)的增加.反应中期(30~60min),藻细胞解体并破裂死亡,表现为IDOM的类腐殖质荧光物质含量的骤降和EDOM的相应成分含量的突跃;EEM谱图显示在30min时细胞内荧光有机物已经被破坏殆尽,总蛋白去除率为60.36%,可以认为在该时间藻细胞群体已消亡.
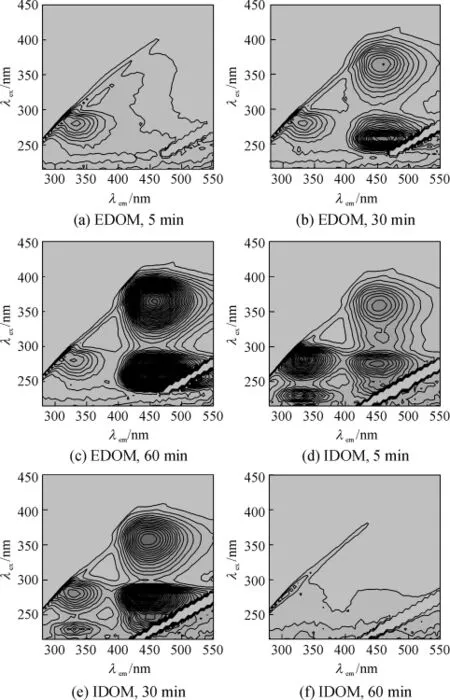
图5 氯化反应过程中铜绿微囊藻的EDOM和IDOM的EEM特征变化Fig.5 EEM properties of extracellular and intracellular dissolved organic matters of Microcystis aeruginosa under chlorination treatment
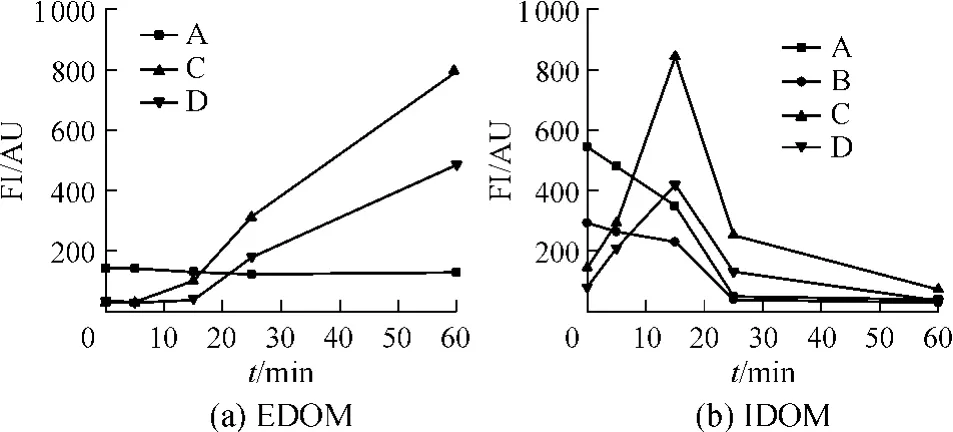
图6 氯化反应过程中EDOM和IDOM的FI变化Fig.6 Variation of FI of extracellular and intracellular dissolved organic matters under chlorination treatment
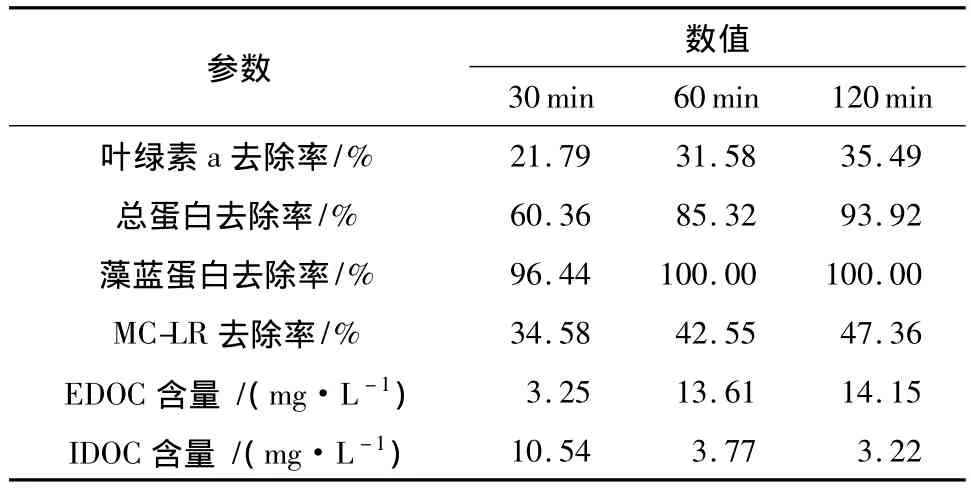
表3 氯化反应过程中生化指标和DOC含量的变化Table 3 Variations of biochemical parameters and DOC content under chlorination treatment
值得注意的是,氯化对活体MC-LR的降解效果有限,投加3 mg/L的Cl2,120 min后MC-LR降解率仅为47.36%.有学者证明纯水中MC-LR在氯化作用下降解速率较快[10];而另有研究表明,NOM会产生竞争效应,对MC-LR的降解有阻碍作用[11].本实验灭藻过程中亦有大量NOM产生,因此对MC-LR的降解效果不佳.另外,氯化对藻类有机物的降解并不彻底,产生的NOM仍具有较大的芳香性和荧光性,是典型的消毒副产物前体物,这对后继水处理过程的安全性会造成一定影响.因此,采用氯化方法作为含藻水的前处理具有一定风险.
3 结论
(1)EEM能较好地表征水中和细胞内所含的荧光性物质,结合生化指标能较全面地描述氯化和UVC的灭藻过程.
(2)氯化和UVC对铜绿微囊藻的灭活及对相关有机物的降解机理不同.UVC的灭活机理主要包括光降解和高级氧化,UVC能有效灭藻,降解胞内外荧光有机物,消除藻蓝蛋白和MC-LR,对这两者的降解既能有效杀灭藻细胞,防止其继续繁殖增长,又能在短时间内对其所在水体进行无害化处理,但需时较长(120min),能耗较高.氯化主要依靠HClO穿透进入藻细胞内部进行化学破坏和降解.低浓度氯化处理灭藻时间短,灭活效果好,但会产生较多的类腐殖质物质,同时对MC-LR的去除效果不佳,说明氯化作为含有铜绿微囊藻的水源水的预处理工艺可能具有一定的风险.
后继研究中,可以就UVC以及氯化处理进行经济与风险评估以及对比,从而寻找最优化和最有效的处理铜绿微囊藻的方法.
[1] Qiao R P,Li N,Qi X H,et al.Degradation of microcystin-RR by UV radiation in the presence of hydrogen peroxide[J].Toxicon,2005,45(6):745-752.
[2] Rodriguez E,Onstad G D,Kull T P J,et al.Oxidative elimination of cyanotoxins:comparison of ozone,chlorine,chlorine dioxide and permanganate[J].Water Research,2007,41(15):3381-3393.
[3] Plummer J D,Edzwald J K.Effect of ozone on algae as precursors for trihalomethane and haloacetic acid production[J].Environmental Science&Technology,2001,35 (18):3661-3668.
[4] Peuravuori J,Koivikko R,Pihlaja K.Characterization differentiation and classification of aquatic humic matter separated with different sorbents:synchronous scanning fluorescence spectroscopy[J].Water Research,2002,36(18):4552-4562.
[5] Baker A.Fluorescence properties of some farm wastes:implications for water quality monitoring[J].Water Research,2002,36(1):189-195.
[6] Otsuki A,Omi T,Hashimoto S,et al.HPLC fluorometricdetermination of natural phytoplankton phycocyanin and its usefulness as cyanobacterial biomass in highly eutrophic shallow lake[J].Water Air and Soil Pollution,1994, 76(3/4):383-396.
[7] 魏复盛.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002.
[8] Rochelle-Newall E J,Fisher T R.Production of chromophoric dissolved organic matter fluorescence in marine and estuarine environments:an investigation into the role of phytoplankton[J].Marine Chemistry,2002,77(1):7-21.
[9] Sinha R P,Kumar H D,Kumar A,et al.Effects of UV-B irradiation on growth,survival,pigmentation and nitrogenmetabolism enzymes in cyanobacteria[J].Acta Protozoologica,1995,34(3):187-192.
[10] Huang T L,Zhao J W,Chai B B.Mechanism studies on chlorine and potassium permanganate degradation of microcystin-LR in water using high-performance liquid chromatography tandem mass spectrometry[J].Water Science and Technology,2008,58(5):1079-1084.
[11] Acero J L,Rodriguez E,Majado M E,et al.Oxidation of microcystin-LR with chlorine and permanganate during drinking water treatment[J].Journal of Water Supply Research and Technology-Aqua,2008,57(6):371-380.

