血液与唾液中葛根素HPLC测定方法的建立
李秋红,郭 泉,徐轶尔,姜 薇
(黑龙江中医药大学药学院,哈尔滨150040)
葛根素(puerarin)是中药葛根的主要有效成分之一,葛根素注射液又是临床上应用较为广泛的一种剂型,具有扩张冠状动脉及脑血管、降低心肌耗氧量、改善微循环的作用,临床多用于治疗心血管疾病[1-2].随着葛根素注射液应用范围的扩大和使用人群的增加,不良反应报告日趋增多[3-4],研究其体内作用规律尤为重要,而对体液中葛根素质量浓度测定又是最为有效的方法.关于葛根素血液样品测定方法和药动学研究国内已有报道[5-10],而唾液中葛根素测定方法尚未报道,唾液作为非创伤性采集的体液样品,其中的药物质量浓度能直接反映血中具有药理活性的游离型药物水平,所以本研究旨在建立同时适用于血液和唾液中葛根素的HPLC分析方法,为进一步利用唾液开展临床药动学研究和唾液治疗药物监测提供灵敏、简便、可靠的检测手段.
1 实验材料
1.1 药品与试剂
葛根素对照品(中国药品生物制品检定所,批号: 110805-200306);葛根素注射液(宝鸡金森制药有限公司,批号:20061202);大豆苷元对照品(中国药品生物制品检定所,批号:110805-200306);超纯水;其他均为市售色谱纯、分析纯试剂.
1.2 仪器
LC-2010高效液相色谱仪(日本岛津);KL512型氮吹仪(北京成萌伟业有限公司);XW-80A旋涡混合器(上海精科实业有限公司);TDL-60B低速台式离心机(上海安亭科学仪器厂);SK8200H超声波清洗器(北京康林科技有限公司);TGL16M高速冷冻离心机(长沙英泰仪器有限公司).
1.3 实验动物
本研究选用清洁级Wistar系雄性大鼠(黑龙江中医药大学实验动物中心,SYXK(黑)2008-001),12~14周龄,体重370~420 g,各项生理生化指标稳定.
2 方法与结果
2.1 标准溶液配制
精密称取葛根素和大豆苷元标准品,分别用甲醇溶解,配制1.0 mg/mL标准储备液,需要时用甲醇为溶剂逐级稀释,得到所需质量浓度的应用液,于-20℃保存待用.
2.2 色谱条件
色谱柱:ODS C18柱(150 mm×4.6 mm,大连依立特公司);流动相:乙腈–含0.8%冰醋酸的水溶液(22∶78,V/V);流速:0.8 mL/min;柱温:30℃;检测波长:250 nm.
2.3 样品处理方法
精密移取100 μL血浆及唾液样品置于试管中,加入适量的内标大豆苷元,并加入甲醇1 mL,漩涡混合1 min后,离心(3 000 r/min)5 min,取上清液0.7 mL,50℃氮气吹干,200 μL流动相溶解,供HPLC分析.
2.4 标准曲线制备
精密加入葛根素标准溶液于100 μL空白血浆和唾液中,配制质量浓度分别为5.0、10.0、50.0、100.0、200.0、350.0 μg/mL和0.1、0.25、0.5、1.0、2.5、5.0 μg/mL的血浆及唾液标准系列溶液,按“2.3样品处理方法”操作,在HPLC测定条件下,分别测定葛根素及大豆苷元峰面积,对葛根素与大豆苷元峰面积的比值(y)和葛根素质量浓度(x)作线性回归,得到葛根素血浆、唾液标准曲线方程分别为y=0.013 6x-0.012 2,r=0.999 4;y=0.429 8x+0.154 1,r=0.999 2,最低定量限分别为5.0、0.1 μg/mL,葛根素的血浆和唾液样品在5.0~350.0 μg/mL,0.1~5.0 μg/mL质量浓度范围内线性关系良好.
2.5 专属性考察
在本方法色谱条件下,按2.3项下处理得到的空白血浆、唾液图谱在葛根素峰及内标峰处无杂峰干扰,如图1、2所示.
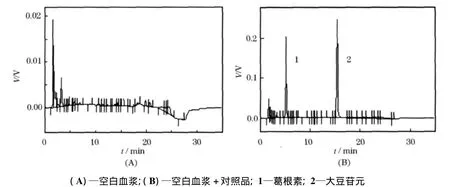
图1 葛根素血浆样品色谱图
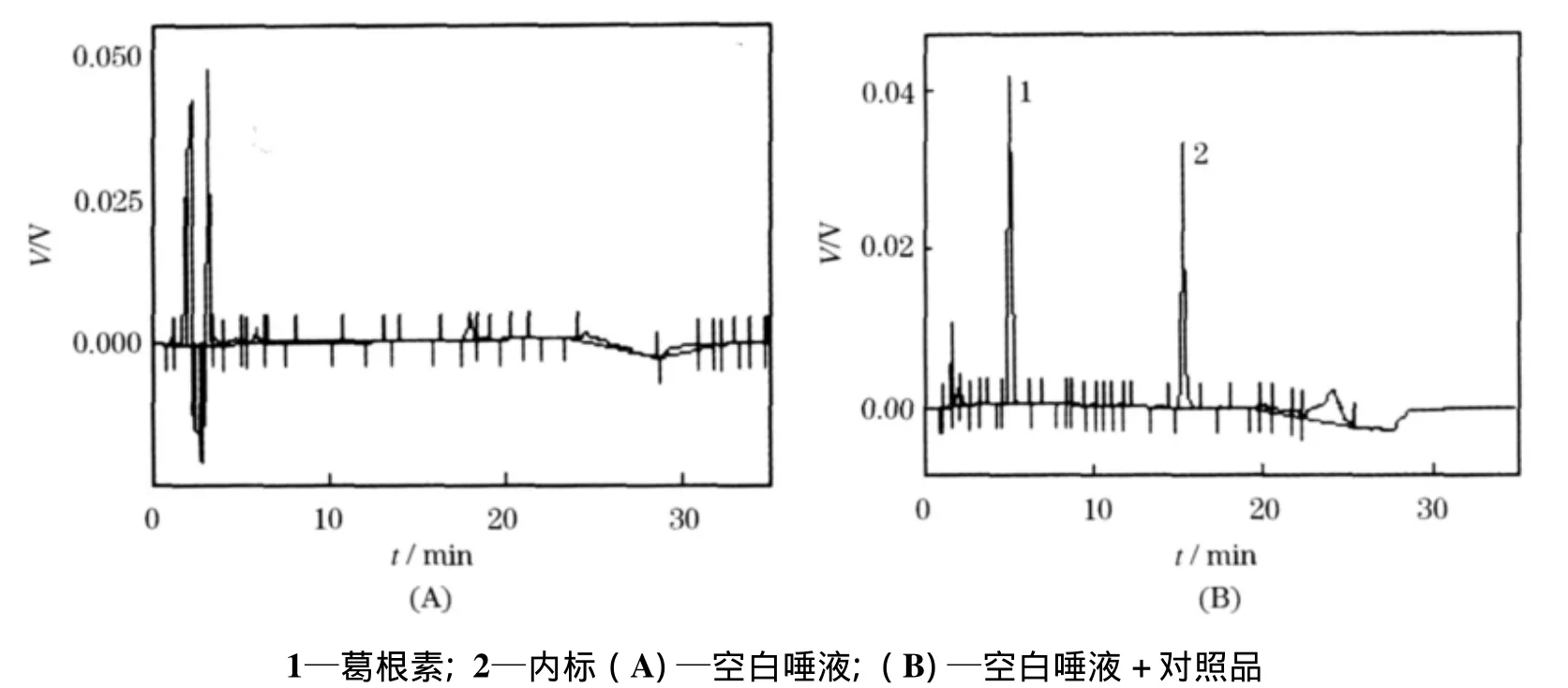
图2 葛根素唾液样品色谱图
2.6 精密度与回收率考察
分别精密移取一定体积的葛根素标准溶液于100 μL空白血浆和唾液中,配成高、中、低三个质量浓度的血浆、唾液标准样品(血浆质量浓度为350.0、100.0、5.0 μg/mL,唾液质量浓度为5.0、1. 0、0.1 μg/mL),按2.3项下方法处理,进样分析,同一质量浓度样品一天内测定5份,连续测定5 d,计算血浆与唾液中葛根素的日内、日间精密度以及方法回收率,结果见表1,2.

表1 血浆中葛根素日内和日间精密度及方法回收率(n=5,x±S)
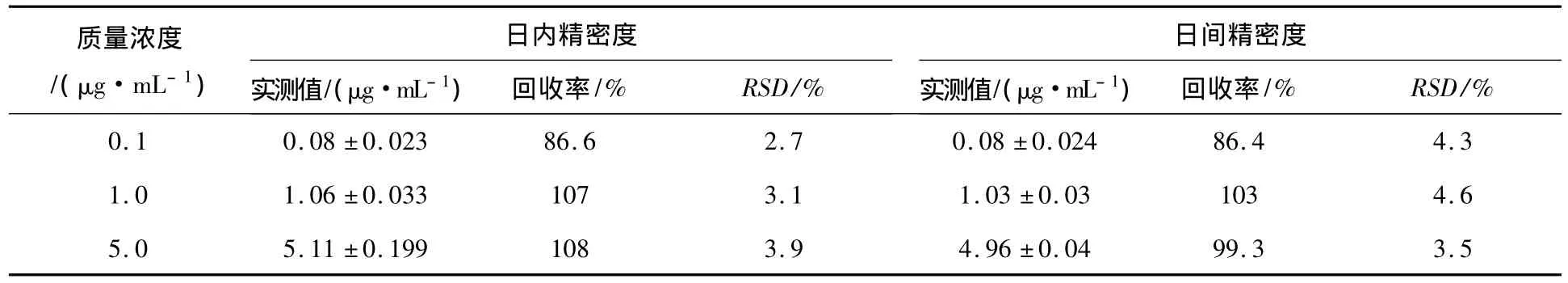
表2 唾液中葛根素日内和日间精密度及方法回收率(n=5,x±S)
2.7 稳定性考察
取高、中、低3个质量浓度的标准样品,进行血浆和唾液样品复溶后放置和反复冻融稳定性的考察.
1)样品经处理后,甲醇复溶放置,每6 h测定一次,结果表明样品用甲醇复溶后室温避光保存36 h稳定,RSD均小于6%,可满足样品在长时间(36 h)内测定的需要.
2)样品于在-20℃冷冻保存后反复融化、冷冻,周期为7 d,每次测定其中有效成分质量浓度,测定结果表明一个月内样品冻融稳定性良好(RSD<5%).
3 讨论
本方法在建立过程中,尝试甲醇-水多种配比系统作为流动相,通过等度洗脱,梯度洗脱对葛根素和大豆苷元的出峰时间、峰面积、峰形等进行考察,均不理想.改为乙腈-水系统作为流动相后发现,葛根素、大豆苷元与杂质峰分离较好.但峰形有拖尾现象,考虑流动相的pH值对色谱峰的峰形有影响,考察了水中加入不同强度酸溶液(醋酸、磷酸、盐酸)对峰形的影响,发现水中醋酸比例为0.8%或磷酸比例0.6%时,色谱峰形较好,拖尾现象消失,峰形尖锐且对称.从保护分离柱角度考虑,本方法选用了酸强度较低的乙腈-0.8%醋酸缓冲液(22∶78,V/V)系统为最终的流动相.
对血浆与唾液样品预处理采用蛋白沉淀的提取处理方法,实验中考察了乙酸乙酯、甲醇、乙醇、乙腈、高氯酸、氯仿六种蛋白沉淀剂的沉淀效果,发现用乙酸乙酯、乙腈、高氯酸、氯仿为提取溶剂时,色谱图杂峰多、回收率低、峰形不尖锐,不适于生物样品中含微量葛根素的提取,而用甲醇、乙醇为提取溶剂时,对比发现用乙醇提取时峰面积明显减小,考虑是葛根素在乙醇中溶解度低造成的,最终确定以甲醇为蛋白沉淀提取剂进行血浆及唾液样品的处理.
建立的反相高效液相色谱法分离测定血浆和唾液中的微量葛根素尚未见文献报道.该方法针对唾液中葛根素的含量极低的特点,其灵敏度可满足对葛根素唾液药动学进行研究的检测方法要求,血浆与唾液中最低定量限分别为5.0、0.1 μg/mL,并同时适于血浆和唾液中葛根素的分析,操作简便,不受内源性物质干扰,专属性强,精密度、回收率、稳定性均符合生物样品分析方法指导原则的要求.葛根素在血浆与唾液中不转化为大豆苷元,用大豆苷元作内标不干扰葛根素的定量.
该方法不仅是葛根素在唾液样品中检测方法的首次建立,还首创了同时适用于血液和唾液样品中葛根素微量生物样品中极低含量的测定方法,为葛根素临床药动学研究和唾液治疗药物监测提供方法学基础.
[1] 肖培根,李大鹏,杨世林.新编中药志[M].北京:化学工业出版社,2002.144.
[2] 邓培媛,李群娜,朱玉珍,等.葛根素注射剂不良反应及其影响因素分析[J].药物流行病学杂志,2005,14(1):14-15.
[3] 许庭郁,杜汴兴.169例葛根素注射液不良反应分析[J].实用药物与临床,2007,10(4):230-231.
[4] 张 峻.190例葛根素注射液不良反应分析[J].广州医药,2003,34(5):55-56.
[5] 王艳红,陈晓辉,毕开顺,等.大鼠血浆中葛根素的HPLC-荧光法测定及其药动学[J].中国医药工业杂志,2007,38 (11):784-786.
[6] 李 捷,罗建云,刘晓峰,等.大鼠血浆中葛根素含量的RPHPLC测定方法[J].武警医院学报,2007,16(2):149-151.
[7] 向大雄,张 杰,李焕德,等.HPLC法测定犬血浆中葛根素含量[J].药物分析杂志,2004,24(6):599-601.
[8] 金昔陆,朱秀媛.葛根素在大鼠家兔犬中的药物动力学[J].中国药理学报,1992,13(3):284.
[9] 张志荣,游学均,何 勤.HPLC法测定血浆中葛根素[J].中国药学杂志,1997,32(2):104.
[10] 赵 瑛,周 游,殷惠军,等.葛根素对脂肪细胞糖脂代谢作用研究[J].哈尔滨商业大学学报:自然科学版,2006,22 (4):5-7.

