外源激素和种苗大小对当归成药期生理变化的影响
鱼亚琼,邱黛玉,蔺海明,李应东
(1.甘肃农业大学,甘肃 兰州 730070;2.甘肃省中医学院,甘肃 兰州 730030)
当归(Angelica sinensis Oliv.Diels)为伞型科当归属多年生草本药用植物,以干燥根入药,味甘、辛,性温,具有补血活血、调经止痛、润燥滑肠等功效[1]。尤其近年来随着中药产业的发展,当归已广泛运用于美容保健剂、饮料、调味品等制造业的生产中,对当归的需求量越来越大。但是,目前在当归人工栽培中,产量低而不稳,尤其是20%以上的早期抽薹率一直是严重制约当归产量和品质提高的瓶颈,给生产上带来巨大的损失[2-3]。从植物发育生物学来看,植物成花抽薹是一个非常复杂的过程,其中生理指标含量的变化与植物的成花抽薹存在着非常密切的关系[4]。汪炳良对萝卜春化作用及其与DNA甲基化的关系进行了研究,发现萝卜叶片中的可溶性糖含量,随着花芽分化进行,呈现先升高后降低规律性变化[5]。刘庆华等研究发现,不同抽薹习性的大白菜品种在抽薹开花过程中体内,可溶性蛋白含量存在一定的差异[6]。Zeevaart和Pharis等研究发现植物激素在需低温春化植物花芽分化和抽薹过程中起着重要的调节作用[7-8]。因此,本研究,拟通过外源激素处理和种苗大小差异,对当归成药期茎叶和根部生理指标(可溶性糖、可溶性蛋白、游离氨基酸)的变化动态进行研究,以期为有效控制当归早抽薹和促进优质高产栽培,提供营养控制的理论依据。
1 材料与方法
1.1 试验区概况
试验于2009年4~10月在甘肃省岷县中药材示范园进行。该区属高寒阴湿二阴区,海拔2 350 m,年平均气温5.3℃,≥10℃的有效积温1 750℃,无霜期120 d,多年平均降水量500~600 mm,年日照时数2 000 h。热量较差,雨量充足,春季回暖迟,秋季降温快。土壤肥力均匀,地势平坦,土层深度90~120 cm;前茬作物为马铃薯。
1.2 试验材料
试验用种苗来自岷县茶埠乡,选择均匀一致、植株健壮、芦头完好、叉根较少、无病虫害、无机械损伤的健康种苗。
1.3 试验设计
试验设种苗(大、中、小苗)、激素类型[GA3(赤霉素)、NAA(萘乙酸)、CTK(细胞分裂素)]、激素浓度(0、50、100mg/L)3个因素,各3个水平,采用L9(34)正交试验表安排试验(表1)。每处理重复3次,共27个小区,小区面积15m2(3m×5m)。每小区移栽9行,按“品”字形挖穴,穴间距26 cm,采用双苗移栽。栽植密度24万株/hm2,折合360株/小区。小区间距50 cm,四周设1m保护行。移栽前按施N 72 kg/hm2、P2O5216 kg/hm2,量作基肥,一次施入。所有种苗均按处理要求进行蘸根处理,浸根时间10 min。移栽时覆盖黑色地膜以提高地温,其它田间管理措施同大田。6月上旬开始每隔7 d随机取样3株,冰盒带回,地上和地下部分分别剪碎混匀备用。

表1 试验因素、水平设计表
1.4 测定方法
鲜样冰箱保存(4℃),用于可溶性糖含量、游离氨基酸和蛋白质含量测定。可溶性糖含量用硫酸蒽酮法测定;游离氨基酸含量用茚三酮法测定[9];蛋白质含量用考马斯亮蓝G-250法测定[10]。
2 结果与分析
2.1 可溶性糖含量变化动态
可溶性糖含量的变化是植物体内碳水化合物代谢的重要标志,既可反映碳水化合物的合成情况,也可说明碳水化合物在植物体内的运输情况,同时,可溶性糖含量的变化,还可反映出环境对植物生长发育造成的影响。试验结果表明:在当归成药期,激素类型和种苗大小对当归茎叶部分可溶性糖含量变化影响较大,而对根部可溶性糖含量变化影响较小。当归茎叶部分可溶性糖含量总体呈“缓增-剧增-降低”的变化趋势。6月2日到16日茎叶部分可溶性糖含量变化趋势平缓,随后,各处理含量急剧上升,至6月30日达到最大值,6月30日到7月7日呈现下降趋势;而A3B1C3处理(大苗、GA3100mg/L)变化趋势与其他处理不同,6月2日到6月23日变化幅度相对其他处理较大,较6月2日增加0.020mg/g,其可溶性糖含量在6月23日后下降,这是由于早期抽薹对可溶性糖的大量需求所致。根部可溶性糖变化趋势和茎叶总体变化趋势相同,也呈现“缓增-剧增-降低”的变化。A3B1C3处理(大苗、GA3100 mg/L)在6月23日上升到最大值为0.046mg/g。其中,A1B2C2处理(小苗、NAA 50 mg/L)和 A2B2C3处理(中苗、NAA 100 mg/L)茎叶和根部可溶性糖含量在6月2日到30日低于未用外源激素处理的小苗和中苗,且在6月30日后下降幅度较小,说明NAA处理的小苗和中苗不利于可溶性糖含量的积累(表2)。
2.2 可溶性蛋白质含量变化动态
可溶性蛋白质有着很强的持水力,对植物起着有效的保护作用,与植物的抗逆性相关。在当归成药期,当归茎叶部分可溶性蛋白含量变化趋势尤为明显,总体呈“升-降-升”趋势。在6月9日前各处理茎叶部分可溶性蛋白含量均呈增加趋势,随后,各处理可溶性蛋白含量均呈先降后升,6月30日达到最小值。其中,种苗大小中,以中苗的茎叶可溶性蛋白质含量最高,大苗次之,小苗最小;激素类型中NAA处理的小苗和中苗茎叶内可溶性蛋白含量高于未用外源激素处理的小苗和中苗,GA3处理可降低中苗和大苗茎叶内可溶性蛋白含量,而CTK处理影响作用不明显。根部可溶性蛋白含量除A1B1C1处理(小苗、GA30mg/L)在6月2日到9日呈下降,其他处理可溶性蛋白含量变化和茎叶变化相同,总体呈“升-降-升”(表 3)。

表3 不同外源激素和种苗大小对当归植株可溶性蛋白质含量变化动态的影响 (mg/g)
2.3 游离氨基酸含量变化动态
茎叶部分游离氨基酸含量在当归成药期呈“M”变化,且种苗大小中始终以中苗游离氨基酸含量最高。6月2日到9日,茎叶部分游离氨基酸含量变化呈上升趋势,尤以A2B2C3处理(中苗、NAA 100 mg/L)上升幅度最快,且在9日达到最大值0.22 mg/g;到6月16日,除A1B1C1(小苗、GA30 mg/L)茎叶部分游离氨基酸含量继续上升,其余各处理含量均大幅度降低;随后,各处理茎叶部分游离氨基酸含量呈现先升后降的变化趋势。根部游离氨基酸含量变化曲线呈双峰型,在6月2日到16日呈先升后降趋势,尤以A2B2C3处理(中苗、NAA 100 mg/L)变化幅度最大,较6月2日增加0.382mg/g;6月16日后,外源激素和种苗大小处理的根部游离氨基酸含量再次呈现先升后降的变化趋势,且变化范围比较集中,于6月23日达到第二次峰值。其中,A2B2C3处理(中苗、NAA 100 mg/L)游离氨基酸含量最高,为 0.446 mg/g(表 4)。
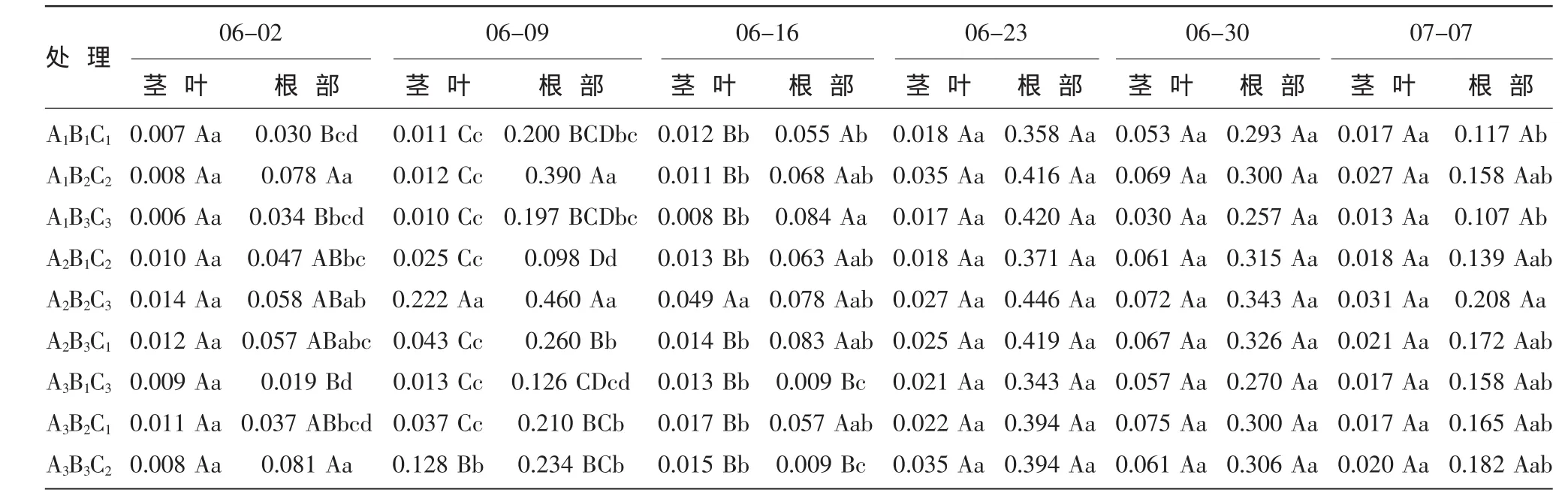
表4 不同外源激素和种苗大小对当归植株游离氨基酸含量变化动态的影响 (mg/g)
3 结论与讨论
碳水化合物是植物成花生理信号的重要物质,它不仅提供能量,活跃成花生理代谢,而且,直接参与成花过程的生理代谢反应[11]。在抽薹始期(生殖器官的发育期),需要较多的碳水化合物提供能量。显然,可溶性糖含量高则易于花茎的发育,因而较容易抽薹[12-15]。外源激素和种苗大小处理的当归茎叶和根部可溶性糖含量呈“缓增-剧增-降低”变化趋势,但根部含量无明显变化规律。6月16日到30日,茎叶和根部可溶性糖含量均有不同程度增加,而100 mg/L GA3处理的大苗从6月23日开始茎叶部分可溶性糖含量降低,这是由于在一定范围内,a-淀粉酶与GA3的浓度成正比,GA3诱导a-淀粉酶的合成,使淀粉分解后产生大量的糖类,为早期抽薹的发生奠定了物质基础[13]。其茎叶和根部可溶性糖含量在6月30日之后呈现下降趋势,这是由于当归早期抽薹对可溶性糖的大量需求所致。
蛋白质是重要的结构物质,也是成花的重要物质基础[14],因此,花芽分化过程中需要大量的蛋白质和氨基酸。外源激素处理的当归茎叶和根部可溶性蛋白含量总体变化呈“升-降-升”趋势,茎叶变化趋势相对较明显,且6月16日后NAA处理含量高于其他处理,说明NAA可促进可溶性蛋白质的积累,有利于降低C/N比,与其早期较低抽薹率相对应。
外源激素和种苗大小处理的当归茎叶部分游离氨基酸含量变化趋势呈“M”形;根部游离氨基酸含量变化曲线呈双峰型。在当归成药前期,变化趋势明显,尤以100mg/LNAA处理的中苗茎叶内游离氨基酸含量升高最为明显且达最大值,与其前期相对较低的抽薹率相符合,但在当归成药中后期,各处理茎叶和根部游离氨基酸含量变化范围较集中。说明NAA促进当归茎叶内游离氨基酸的积累,有利于降低C/N比,进而降低早期抽薹率。
[1] 中华人民共和国药典委员会.中华人民共和国药典(2005年版一部)[M].北京:化学工业出版社,2005.89.
[2] 李少锋,孙朝辉.当归高产高效栽培技术[J].云南农业,2005,(4):10.
[3] 武延安,刘效瑞,曹占凤,等.日光温室冬季育苗抑制当归早期抽薹的效应研究[J].中国中药杂志,2005,35(3):283.
[4] 胡 瑶.植物生长调节剂对芥菜的抽薹效应研究[D].重庆:西南大学,2008.
[5] 汪炳良.萝卜春化作用及其与DNA甲基化的关系[D].杭州:浙江大学,2004.
[6] 刘庆华,巫东堂,李改珍,等.大白菜抽薹的影响因素研究进展[J].山西农业科学,2009,37(2):82-84.
[7] Zeevaart JA D,Creelman R A.Metabolism and physiology of abseis acid[J].Annu Revplant Physiol Mol Boil.1988,39:439-413.[8] Pharis R P,King RW.Gibberellins and reproductive development in seed plants[J].Ann Rev Plant Physiol.1985,36:517-568.
[9] 邹 琦.植物生理生化试验指导 [M].北京:中国农业出版社,1995.129-130.
[10]郝再斌.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004.
[11]蔡仕珍,潘远智,陈其兵,等.低温胁迫对花叶细辛生理生化及生长的影响[J].草业学报,2010,19(1):95-102.
[12]汪炳良,邓俭英.萝卜花芽分化过程中茎尖和叶片碳水化合物含量的变化[J].园艺学报,2004,3(2):375-377.
[13]高小俊,吴兴恩,程永生,等.短截对芒果再次花芽分化的影响[J].湖南农业科学,2010,(8):47-49.
[14]张慧蓉,张建伟,龚义勤,等.萝卜花芽分化的形态学研究[J].广东农业科学,2010,37(6):8-9.
[15]谢利娟,麦瑞娟,孙 敏.影响植物花芽分化的内部因素研究进展[J].安徽农业科学,2009,37(30):14585-14631.
[16]张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003,192-194.
[17]郭金丽,张玉兰.苹果梨花芽分化期蛋白质、淀粉代谢的研究[J].内蒙古农牧学院学报,1999,20(2):80-82.
[18]秦建彬,林丹青.不同上山时间对大花蕙兰花芽分化的影响[J].广东农业科学,2009,(8):91-92.

