綦江县2008—2009年药品不良反应报告分析
(重庆市食品药品监督管理局綦江县分局,重庆 綦江 401420)
药品不良反应报告和监测工作是食品药品监管工作的重要内容之一,是确保公众用药安全的重要措施。为全面了解綦江县药品不良反应(简称ADR)发生的规律和特点,笔者对2008—2009年全县上报的ADR报告进行分析、总结,为药品安全监管和临床合理用药提供参考。
1 资料和方法
以重庆市药品不良反应网络管理平台2008年1月1日至2009年12月31日接收时间为准,对綦江县药品不良反应报表进行检索、统计、归类。采用回顾性研究方法,按报告单位、病例资料、涉及的药物情况等进行汇总分析。
2 结果与分析
2.1 报告单位情况
綦江县2008—2009年共有51家单位上报药品不良反应报告711例,其中40家医疗机构上报605例(85.09%),11家药品经营企业上报106例(14.91%),详见表1。监测数据表明,全县药品不良反应监测网络已趋成熟,已覆盖全县20个街镇,年平均报告数量达到每百万人口374例(全县人口95万);但全县药品不良反应监测工作发展不平衡,一是严重的与新的ADR比例较低(仅为14.63%),二是县级医院和药品经营企业报告ADR的总数与比例较低。
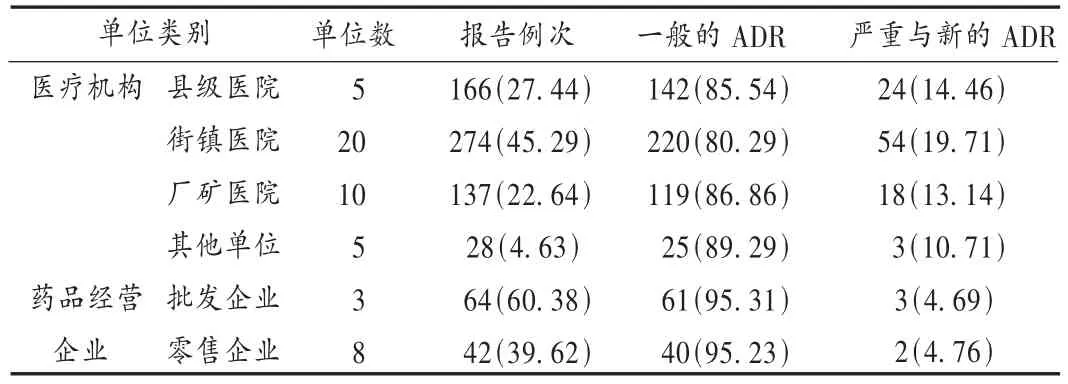
表1 綦江县2008—2009年基层单位药品不良反应报告情况统计表[例(%)]
2.2 病例情况
患者情况:711例ADR中,患者男353例(49.65%),女358例(50.35%),女性略多于男性。从年龄分布看,ADR发生率基本上是随年龄增大而升高,符合人体机能的自然规律(见表2)。其中≥60岁的患者ADR最多,这可能与老年人各系统的生理机能活动衰退及对药物的代谢、排泄功能降低有关。因此,临床用药应考虑年龄因素,加强对老年人、孕妇等特殊人群用药的监测。此外,30~49岁人群的ADR发生率也较高,这可能与自购药品服用且用药时间无规律、剂量不稳定有关,应加强对此类人群的用药指导。
累及系统或器官:711例ADR中,皮肤及其附件损害、消化系统损害、全身性损害居前3位,共占报告总数的77.89%。其中皮肤及其附件损害320例(32.16%),临床表现以斑丘疹、瘙痒、红斑疹、急性荨麻疹、皮疹等变态反应为主;消化系统损害219例(22.01%),临床表现以恶心呕吐、腹痛腹泻为主;全身性损害 236 例(23.72%),主要表现为高热、过敏性休克、过敏性反应、寒战等。上述以过敏性休克最严重,其他多为感官感知的ADR,如消化系统不适、皮肤变态反应。
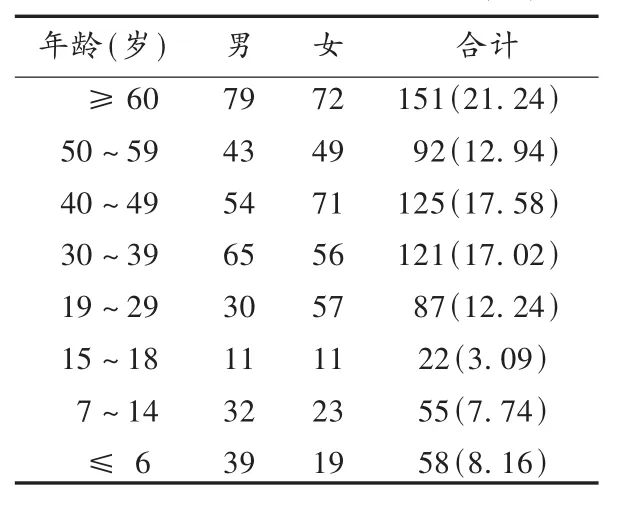
表2 ADR患者年龄分布[例(%)]
2.3 涉及药物情况
药物种类[1]:按照中成药类与非中成药类(包括化学药、生物制品)分类,根据药理作用进行分类统计,共涉及229种药品。其中,非中成药类最多,为605例(85.09%),严重与新的 ADR 85 例(14.05%),涉及 58 类 199 种药品;中成药类 106例(占 14.91%),严重与新的 ADR 19例(17.92%),涉及30种药品。虽然中成药类ADR报告数低于非中成药类药品,但其严重与新的ADR比例却高于非中成药类药品,这可能与中药注射剂使用频次较多有关。
药物剂型和用药途径:根据中国药典附录制剂通则进行归类、统计,711例ADR涉及12种剂型、11类用药途径。其中注射剂(包括粉针剂)居首位,为543例(76.37%),其用药途径分布为静脉滴注 487 例 (89.69%)、皮下注射 34 例 (6.26%)、肌肉注射 12 例(2.21%)、静脉注射8例(1.47%)、局部注射及关节内用药各1例(0.18%)。注射给药直接经过血液循环,产生作用快而更易发生ADR,尤其在输液过程中的发生率最高。口服(包括含服)给药共159 例(22.36%),剂型包括片剂(包括分散片)118 例(74.21%)、胶囊剂 30例(18.87%)、口服溶液剂 7例(4.40%)、颗粒剂 2例(1.26%)、混悬剂及丸剂各1例(0.63%)。其他还有局部外用给药6 例(0.84%),剂型包括橡胶膏剂 4 例(66.67%)、酊剂、气雾剂各 1例(1.67%);眼内用药(滴眼剂)1例(0.14%);阴道用药(栓剂)2例(0.28%)。片剂与胶囊剂因服用及携带方便,成为较多患者的首选剂型,使得ADR发生率居前。
抗感染类药物:根据2005年版《中华人民共和国药典·临床用药须知》分类方法,将非中成药中的抗微生物类药物及品种按药理作用归为抗感染类药物进行统计,ADR最多的为抗感染类药物,共377例,占非中成药的62.31%,涉及13类60种药品。其中列前3位的药品为头孢曲松钠、左氧氟沙星、头孢哌酮钠舒巴坦钠(见表3)。这可能与报告来源大多数为医疗机构,这些药品临床应用广泛、使用时间长、合并用药等有密切关系,因此临床使用抗感染类药物时应严格遵守《抗菌药物临床应用指导原则》,合理用药。
中药注射剂:106例中成药ADR中,中药注射剂最多,为85例(80.18%),其中列前3位的药品是双黄连注射液、香丹注射液、清开灵注射液(见表4)。中药注射剂ADR发生率较高,可能与患者和基层医务人员误认为中药副作用小,合并用药、盲目选用等有关[2]。因此,医疗卫生单位应按照国家卫生部《中药注射剂临床使用基本原则》、国家中医药管理局《中成药临床应用指导原则》使用中药制剂,严格掌握适应证,加强临床用药观察和监测。
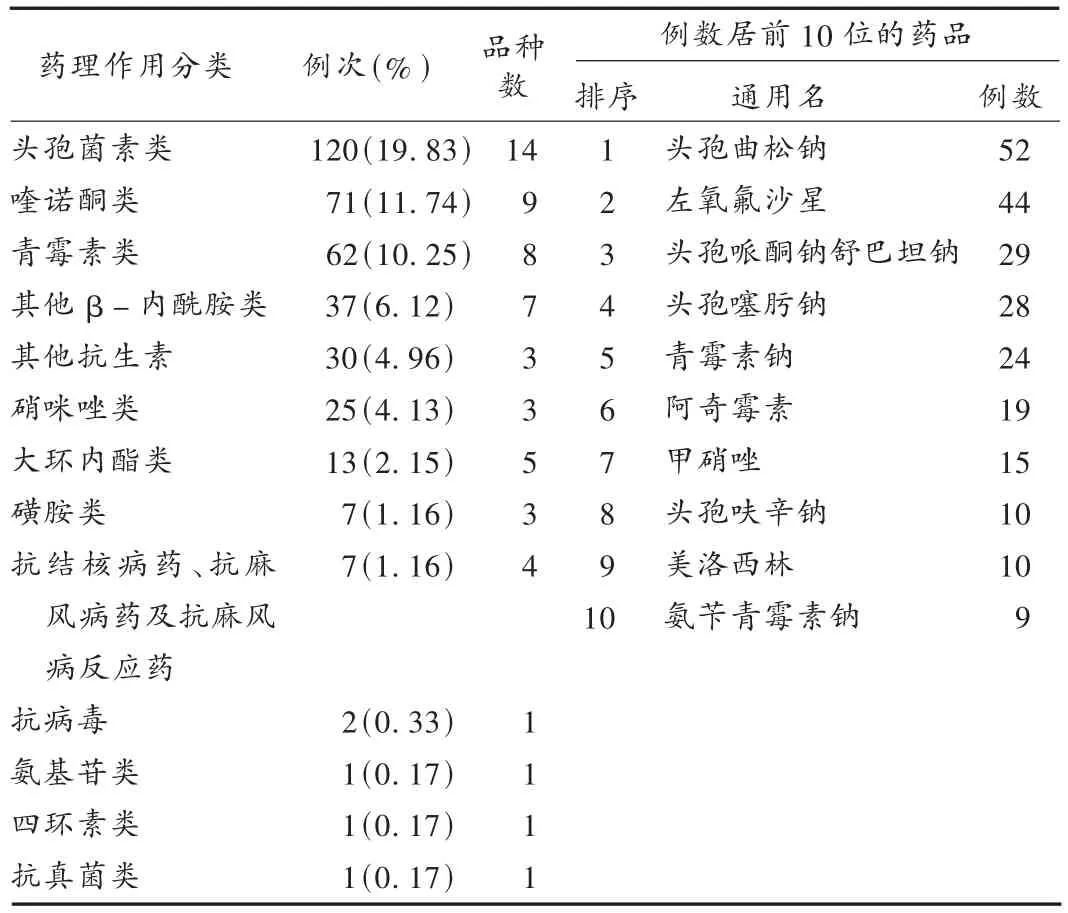
表3 抗感染类药物统计表
2.4 严重与新的ADR报告情况
711例ADR中,严重与新的ADR 104例(14.63%);发生ADR最多的是≥60岁的人群,共32例,占严重与新的ADR报告的30.77%;涉及最多的用药途径为静脉滴注和静脉注射,达87例(83.65%);列前10位的药品为抗感染类药物6种、中成药3种、维生素1种,均为注射剂(见表5)。由此进一步说明,抗感染类药物和中药注射剂在应用中发生的ADR数量多、程度严重,临床必须严密观察、加强监测报告。

表4 不良反应涉及的中药注射剂品种及主要临床表现

表5 严重与新的ADR报告例次列前10位的药品
2.5 《2009年版国家基本药物目录》涉及品种
根据《2009年版国家基本药物目录》统计,711例ADR涉及国家基本药物72种319例(44.86%),其中涉及化学药与生物制品60 种 281 例(88.09%),中成药 12 种 38 例(11.91%),见表 6。基本药物是国家专为医疗机构遴选的相对安全的常用药品,从我县ADR报告涉及的药物品种与比例来看,在临床使用中也应对其密切关注,加强监测。
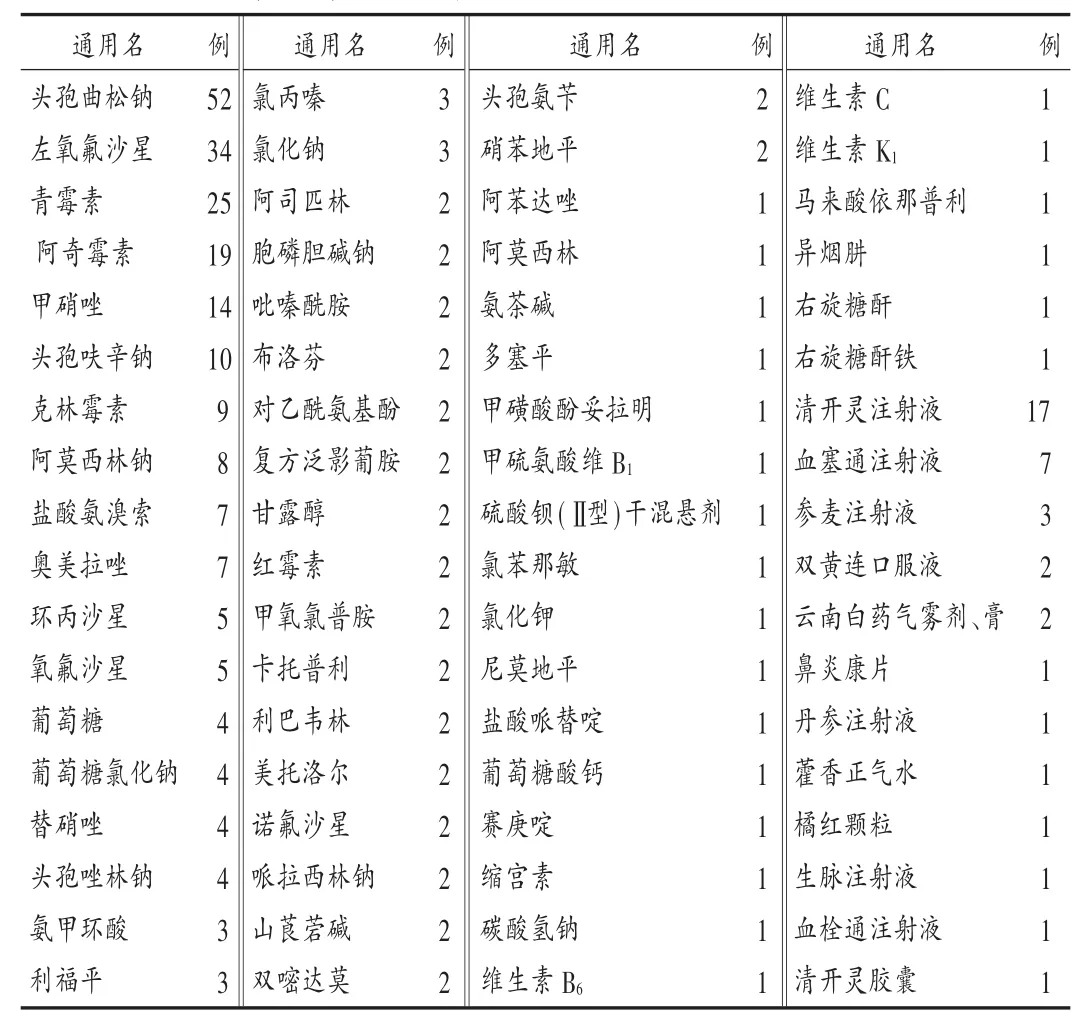
表6 涉及《2009年版国家基本药物目录》的品种统计
2.6 《国家药品不良反应信息通报》涉及品种
根据34期《国家药品不良反应信息通报》统计,711例ADR中,有18种(155例)药品为国家信息通报的品种,主要临床症状与通报的基本相同(见表7)。这说明药品安全监测工作除了要重视ADR报告与监测数据的收集,更要注重监测数据的运用[3]。基层用药单位应高度重视国家对ADR反应报告与监测情况的通报和信息反馈,不断掌握药品可能存在的各种ADR,审慎用药,采取有效措施减少和防止ADR的重复发生。
3 思考与建议
目前基层监测单位对药品不良反应监测工作仍然重视不够,表现在对监测工作被动应付、ADR报告数量与用药情况不符、新的与严重的ADR病例较少、ADR报告填报不规范和不完整等方面。为此,应进一步加大宣传培训力度,把药品安全监测与医疗机构的临床药学、经营企业药品经营质量管理(GSP)认证等药品质量管理工作相结合,引导各单位对药品安全监测工作由被动应付转变为主动发现、主动报告,不断提高药品安全监测工作质量。
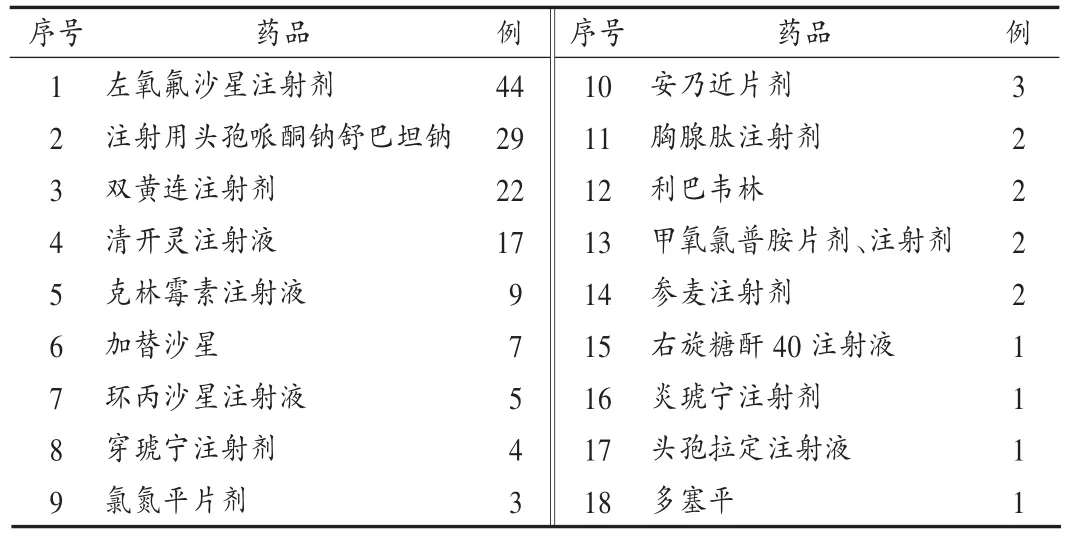
表7 涉及《国家药品不良反应信息通报》的品种统计
根据国家食品药品监督管理局《关于加强基本药物质量监督管理的规定》,对国家基本药物ADR的监测要实行全覆盖。随着基本药物在基层医疗卫生单位的广泛使用,对其ADR的监测成为药品安全监测工作的重要内容。从我县ADR报告涉及基本药物的比例高达44.86%来看,基本药物的ADR不容忽视。为此,应进一步加强对基本药物ADR的监测,及时分析评价基本药物ADR病例报告,及时预警,以保证国家基本药物政策的顺利实施。
ADR既不是医疗事故,也不是药品质量问题,但一旦发生了严重的ADR,个别基层政府、医疗卫生单位及经营企业为了控制事态、缩小影响,往往不按程序报告而采取经济赔偿等息事宁人的方式解决,使得一些新的和严重的ADR被漏报瞒报,从而导致ADR重复发生。建议国家制定因药品安全事件导致的人身伤害救助法规,建立相应的赔偿机制,使药品生产、经营企业和医疗卫生单位在ADR事件中真正免责,使药品安全事件受害人及时得到救助,以促进我国药品安全监测工作的健康发展。
[1]陈新谦,金有豫,汤 光.新编药物学[M].第15版.北京:人民卫生出版社,2003:2.
[2]周超凡.中药注射剂不良反应的警示[J].中国药物警戒,2005,4(2):65-68.
[3]陈易新,田春华.从药品不良反应信息通报品种看药品风险管理[J].中国药物警戒,2007,4(5):257-260.

