金黄色葡萄球菌 isdB基因克隆、表达及其抗原性鉴定
崔 莉,朱战波,朱洪伟,崔玉东,朴范泽
(1黑龙江八一农垦大学动物科技学院,黑龙江大庆,163319;2广东温氏食品集团有限公司江苏分公司;3黑龙江八一农垦大学生命科技学院)
金黄色葡萄球菌是奶牛乳房炎的重要致病菌之一,也是人类医源感染的常见病原菌,多为耐甲氧西林金黄色葡萄球菌。传统的抗生素疗法引起了金黄色葡萄球菌对多种抗生素的拮抗[1],已不能有效治疗由金黄色葡萄球菌引起的感染,尤其发现有些分离株甚至对新型的抗生素也产生了耐药性[2],所以人们把研究的重点转向疫苗方面。随着分子生物学的发展,基因工程疫苗的研究展示出良好的发展前景。国外一些学者对筛选疫苗靶向的方法进行了深入的研究,Yukiko等[3]用反向遗传学方法在 8株金黄色葡萄球菌的染色体组序列中检测出 19种保守性表面蛋白,同时鉴定出 4种产生高度保护性免疫的蛋白:IsdA,IsdB,SdrD和 SdrE。用这 4种表面蛋白免疫小鼠,与其它 15种抗原相比,产生了最高的保护水平,这项鉴定在筛选疫苗候选抗原的研究中具有重要意义。
金黄色葡萄球菌生长需要铁作为营养物质,感染时它可以与宿主血红素相互作用而摄取铁。金黄色葡萄球菌铁调控表面决定子(Isd)是与铁吸收相关的一个重要成分[4],该系统能结合机体的血红蛋白,并使血红蛋白通过细胞壁和细胞膜,在细胞质内蓄积,一旦进入细胞,血红素的咔啉环会被酶降解掉,形成能被细菌用作营养来源的自由铁[5]。在 Isd基因座中,IsdB是唯一的完全暴露在细胞壁表面的蛋白,对金黄色葡萄球菌铁的摄取具有重要作用。试验证明,金黄色葡萄球菌是通过 IsdB捕获血红蛋白,在 IsdB失活、而IsdA和IsdH没有失活的突变株中,细菌细胞壁结合到的血红蛋白就会减少,同时也就削弱了金黄色葡萄球菌利用血红蛋白作为铁来源的能力[6]。Kuklin等[7]根据 IsdB在不同的金黄色葡萄球菌临床株中均具有保守性这一特点,将该蛋白制成疫苗免疫小鼠,结果获得了高度的免疫,且在猕猴中也呈现出抗体效价的高水平增长。因此,利用 IsdB的铁结合机制来发展抗金黄色葡萄球菌疫苗具有广阔的前景。笔者通过对编码金黄色葡萄球菌 IsdB蛋白的基因进行克隆,构建原核表达载体,并在大肠杆菌中进行表达,旨在为进一步研究其在奶牛乳房炎免疫预防中的作用及新型 DNA疫苗奠定分子理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株及载体 奶牛乳房炎致病菌金黄色葡萄球菌 BMSA/855/23-1株,表达载体 pQE-30和受体菌 E.coli XL1-Blue均为本实验室保存;pMD18-T Vector System购自大连宝生物工程有限公司。
1.1.2 酶和试剂 LA Taq DNA聚合酶及核酸分子质量标准购自大连宝生物工程有限公司,限制性内切酶和 T4 DNA连接酶以及低分子量蛋白质标准均购自加拿大 MBI公司;DNA片段快速胶回收试剂盒购自北京博大泰克生物基因技术有限责任公司;鼠金黄色葡萄球菌多克隆抗体由本实验室保存;辣根过氧化物酶标记羊抗鼠 IgG抗体购自 NEB公司;其它试剂为 Sigma公司产品。
1.1.3 引物 根据 GenBank中(登录号:BA000033)金黄色葡萄球菌的 isdB基因序列设计一对 PCR扩增特异性引物,在上游引物的 5′端加上一个 Bam HI酶切位点(见下划线)和 3个保护性碱基 CGG,下游引物的 5′端加上一个 Sal I酶切位点和 2个保护性碱基 GC,即上游引物为 5′-CGGGGATCCATGAACAAACAGCAAAAAGA-3′,下游引物为 5′-GCGTCGACTTAGTTTTTACGTTTTCTAG-3′。引物由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 金黄色葡萄球菌 DNA的提取 将金黄色葡萄球菌用液体培养基过夜培养后,离心,沉淀用葡萄球菌溶菌酶和蛋白酶 K处理,然后用酚、氯仿抽提提取金黄色葡萄球菌 DNA,方法详见文献[8]。
1.2.2 PCR扩增、克隆及序列分析 用 LA Taq DNA聚合酶进行 PCR扩增,反应条件:95℃预变性 3 min后,94℃变性 1.5min,60℃退火 1min,72℃延伸 2 min,进行 30个循环,最后 72℃延伸 10min。PCR产物经琼脂糖凝胶电泳后,用DNA胶回收试剂盒回收目的片段。16℃过夜连接pMD18-T载体,次日转化到 XL1-Blue感受态细胞并涂布于含有终质量浓度 50 mg/L氨苄青霉素的 LB琼脂平板上,置 37℃培养。随机挑选几个菌落,用碱裂解法粗提质粒,并对其进行 PCR和 Bam HI,Sal I双酶切鉴定,筛选出的阳性菌送至上海生工生物工程技术服务有限公司进行序列测定,预计 IsdB片段大小约为1 938 bp,pMD18-T载体大小约为 2 692 bp,测序后对测序结果用 DNAStar软件进行序列分析。
1.2.3 重组蛋白原核表达载体的构建 上述阳性质粒命名为 pMD18-T-isdB,将该克隆质粒和 pQE-30表达载体质粒分别用Bam HI和 Sal I双酶切,pQE-30表达载体片段大小约为 3 439 bp,回收目的基因片段和线状表达载体。用 T4连接酶在 22℃条件下对目的基因片段和线状表达载体进行过夜连接,按 1.2.2的方法转化和鉴定阳性克隆,并将阳性菌命名为 pQE-30-isdB。
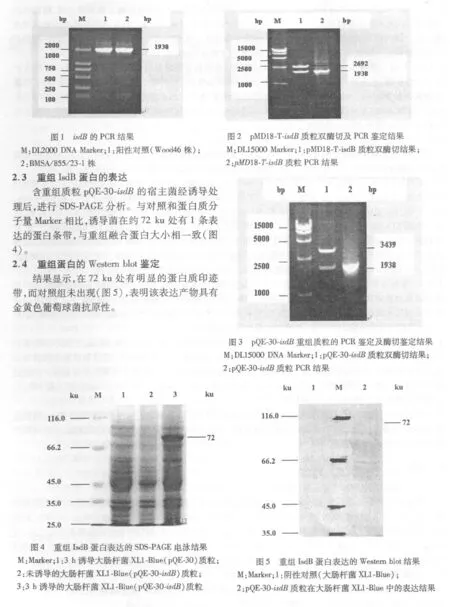
1.2.4 重组蛋白的诱导表达 将重组菌 pQE-30-isdB及空载体 pQE-30在含有 50mg/L氨苄青霉素的LB液体培养基中培养到 A600值达到 0.6时,加入 IPTG至终浓度为 1mmol/L,进行目的蛋白的诱导表达。分别取诱导前和诱导后 3 h的重组菌,诱导后 3 h的空载体 1mL菌液,4℃离心收集菌体。沉淀菌体中加入 1×SDS上样缓冲液 100μL,混匀后,沸水加热 5min,10 000 g离心 10min后,取上清 10μL,按参考文献[8]的方法进行 SDS-PAGE分析。
1.2.5 estern blot分析 按照参考文献[8]的方法以 BIO-RAD系统电转移至 PVDF转移膜上,用脱脂乳封闭后,依次加入鼠金黄色葡萄球菌多克隆抗体,辣根过氧化物酶标记羊抗鼠 IgG抗体,最后在联苯胺(DAB)溶液中显色,观察结果。
2 结 果
2.1 isdB基因扩增、TA克隆及其序列分析
PCR扩增产物经琼脂糖凝胶电泳分析,结果显示,获得了全长约为 1 938 bp的条带,与预期扩增产物大小一致(图 1)。对pMD18-T-isdB质粒进行PCR鉴定,结果扩增出与预计目的片段大小1 938 bp相符的条带,将 PCR鉴定为阳性的质粒用 Bam HI和 Sal I双酶切鉴定,酶切产物经琼脂糖凝胶电泳后,获得预期大小的 2个目的基因片段(2 692 bp和 1 938 bp)(图 2)。测序后,NCBIBlast分析显示,该 DNA片段大小为 1 938 bp,与 GenBank中金黄色葡萄球菌株 MW 2的 isdB碱基序列的同源性为 98.6%。
2.2 重组蛋白原核表达载体的鉴定
对 pQE-30-isdB质粒进行 PCR鉴定,经琼脂糖凝胶电泳分析,PCR鉴定结果为阳性,将该质粒用Bam HI和 Sal I双酶切得到 2个预期大小的片段(3 439 bp和 1 938 bp)(图 3)。
3 讨 论
金黄色葡萄球菌通过 IsdB蛋白介导铁从宿主血红蛋白转移到细菌内,表现了 IsdB蛋白的一个重要的毒力作用。缺乏这种蛋白,金黄色葡萄球菌产生的毒力却会减少,该细菌在宿主组织中将无法正常复制和永久定居。有研究表明[6],当 IsdB与 AAHS(amorphous aluminum hydroxyphosphate sulfate)佐剂结合作为疫苗时,具有高度的免疫原性,产生的特异性抗体对鼠模型中不同分离株的金黄色葡萄球菌感染具有稳定及显著的保护作用。因此,IsdB是一个良好的疫苗侯选抗原。
本次研究应用基因工程方法成功地克隆了金黄色葡萄球菌包含了信号肽序列的全长 isdB基因,与报道的 isdB全长基因序列比较,其核苷酸和氨基酸序列同源性都为 98.6%,同源性很高,存在的少量差异基因可能是菌株的特异性所致。由于大肠杆菌是当前应用较广泛的原核表达体系,具有培养方法简单、快速、经济等优点,所以在本次研究中选择大肠杆菌来表达isdB基因。pQE-30载体能够编码 6个组氨酸残基,外源基因经多克隆位点插入后,可与 IsdB一起融合表达,这样有利于提高表达产物的稳定性,且融合蛋白经 Western blot试验,发现能和金黄色葡萄球菌的阳性血清发生反应,说明该目的蛋白具有金黄色葡萄球菌的抗原性,可作为亚单位疫苗的候选蛋白。
近年来,在奶牛乳房炎疫苗研究过程中,金黄色葡萄球菌基因工程疫苗已成为了国内外研究的热点,如金黄色葡萄球菌的凝集因子 A,纤连蛋白结合蛋白,胶原结合蛋白,溶血毒素及肠毒素等均已被用作免疫抗原。isdB基因的克隆和 IsdB蛋白的成功获得为今后进一步研究 IsdB亚单位疫苗的免疫效力及金黄色葡萄球菌致病机制提供了有力的工具和研究基础,高度保守且免疫原性较强的 IsdB蛋白抗原可能作为基因工程疫苗的良好靶向,对临床防治由金黄色葡萄球菌引起的感染将具有重要的意义。
[1] NICKERSON S C,OWEN W E,BODDIE R L.Mastitis in dairy Helfers:initial studies on prevalence and control[J].J Dairy Sci,1995,78(7):1 607-1 618.
[2] ANDEREGG,T R,SADER H S,FRITSCHE TR,et al.Trends in linezolid susceptibility patterns:report from the 2002-2003 worldwide Zyvox Annual App raisal of Potency and Spectrum(ZAAPS)Program[J].Int JAntimicrob Agents,2005,26(1):13-21.
[3] YUKIKO K,STRANGER-Jones,TAEOK Bae,et al.Vaccine assembly from surface proteins of Staphylococcus aureus[J].Proc Natl Acad Sci USA,2006,103(45):16 942-16 947.
[4] MAZMANIAN SK,SKAAR E P,GASPAR A H,et al.Passage of heme-iron across the envelopeof Staphylococcus aureus[J].Science,2003,299(5 608):906-909.
[5] SKAAR E P,SCHNEEW INDO.Iron-regulated surface determinants(Isd)of Staphylococcus aureus:stealing iron from heme[J].Microbes Infect,2004,6(4):390-397.
[6] KUKLIN N A,CLARK D J,SECORE S,et al.A novel Staphylococcus aureus vaccine:iron surface determ inant B induces rapid antibody responses in rhesusmacaques and specific increased survival in amurine S.aureus sepsis model[J].Infect Immun,2006,74(4):2 215-2 223.
[7] TORRESV J,PISHCHANYG,HUMAYUN M,etal.Staphylococcus aureus IsdB is a hemoglobin receptor required for heme iron utilization[J].JBacteriol,2006,188(24):8 421-8 429.
[8] 萨姆布鲁克·J,弗里奇·E·F,曼尼阿蒂斯·T.分子克隆实验指南[M].金冬雁,黎孟枫,译.第 2版.北京:科学出版社,1999.
(责任编辑:朱宝昌)
- 河北科技师范学院学报的其它文章
- 肺外感染的非结核分枝杆菌
- 利用 16S-23S rDNA间隔区快速鉴定猪链球菌和马链球菌兽疫亚种

