Vero及Vero-dst细胞对犬瘟热病毒敏感性比较
任 超,霍桂桃,陈益山,陈 丽,张兰兰,李 佳,陈 武,赵德明
(1.北京农学院,兽医学院(中医药)北京市重点实验室,北京 102206;2.中国农业大学动物医学院,北京 102206)
犬瘟热是由犬瘟热病毒(canine distemper virus,CDV)引发的一种急性、高度接触性致死性传染病。可感染犬科、鼬科、浣熊科、大熊猫科、猫科(猫除外)等多种动物。对我国养犬业、经济动物养殖业、动物园观赏动物和野生动物及实验动物等危害极大。近几年来,在患Paget’s疾病的病人组织中也检出了CDV的核酸[1]。另据Yoshikawa[2]报道猴子对本病也有一定的易感性,提示CDV还存在潜在易感宿主。
CDV病毒的分离培养对诊断和研究该病至关重要。但是由于CDV对外界环境的抵抗力很弱,易被光和热灭活,加之病料采集的部位、时间、样品处理、发病动物的抗体水平等因素致使体外分离培养CDV十分困难,但分离病毒所用细胞的敏感和有效性是成功分离CDV的最关键环节。
本实验选用Vero及Vero-dst两种细胞,接种CDV标准毒株Snyder Hill和临床阳性犬的组织,观察细胞病变(Cyto pathetic effect,CPE)、检测病毒滴度TCID50,并通过RT-PCR法进行比较,观察两种细胞对CDV的敏感性,为CDV的分离鉴定、增殖培养及进一步的深入研究提供依据。
1 材料和方法
1.1 材料
1.1.1 细胞与病毒:细胞系:Vero及Vero-dst(Vero.DogSLAMtag)细胞,中国农业大学病理实验馈赠。犬瘟热病毒Snyder Hill株(ATCC,VR-1587)。犬瘟热病毒野毒株:临床CDV检测阳性犬,于濒死期实施安乐死,无菌采取其肺、肝、脾、肾组织。
1.1.2 主要试剂与药品:DMEM干粉(高糖):美国Gibico公司(批号1290007);D-Hank’s干粉:美国Sigma公司(批号1136551);胎牛血清(FBS):奥地利PAA公司(批号A04105-1121);胰蛋白酶:美国Gibico公司(批号2750018)。
1.2 方法
1.2.1 细胞培养:培养液为含有90%DMEM,10%FBS的完全培养液,待细胞长至70%~80%的融合状态可接种病毒。将细胞传至第三代,接种病毒。
1.2.2 接种病毒
1.2.2.1 CDV标准株:病毒的复苏:犬瘟病毒Snyder Hill株(Titer:10(4.75)TCID50/0.2mL)置于37℃水浴中迅速解冻,使用维持培养液(98%DMEM为+2%FBS)根据其原始滴度将病毒原液分别按10-3、10-4、10-5进行稀释。按病毒接种的常规方法进行[3]。
1.2.2.2 野毒株:取病料小块组织,按1∶5的比例加入PBS(pH 7.3),同时加入双抗(1000IU/mL青链霉素溶液)充分研磨成匀浆。4℃冰箱内感作2~4h或过夜后5000r/min离心10min,取上清。按上述接毒方法接入状态良好的细胞上,观察CPE。
1.2.3 收毒:反复冻融的方法,即将细胞培养瓶放入-20℃冰箱冻后,直接取出,待其融化为冰水混合物时,使劲摇晃瓶子,让细胞破裂释放出病毒颗粒,反复冻融4次后,将液体移入离心管,2000r/min离心10min,以此除去细胞碎片,离心后收集上清液,即达到收毒目的。
1.2.4 盲传:盲传采用两种方法,一为传统接毒方法,即未出现CPE的细胞仍进行收毒,收集的上清再继续接种下一代细胞。以此盲传5代。仍不见CPE者视为阴性。同时又尝试了另外一种接毒方式,即传代的同时进行接毒,且消化细胞后不弃掉胰酶。
1.2.5 分子生物学方法技术检测感染细胞中的病毒核酸
1.2.5.1 引物的设计与合成:根据Genbank上发表的CDV全序列,在保守区设计了一对引物,扩增片段为178bp。上游引物(P1):5′-GCCAGACCTGAG GAGTTATTGA-3′,下游引物(P2):5′-CTGCGTT ACAGACTTGATTTGC-3′。同时,设计了Vero细胞的GAPDH,扩增片段192bp。上游引物(P1):5′-TCAACAGCGACACCCACTC-3′,下游引物(P2):5′-CTTCCTCTTGTGCTCTTGCT-3′。以上引物均由上海生工北京合成部合成。
1.2.5.2 RNA的提取:Trizol法。
1.2.5.3 RT-PCR扩增:提取总RNA后立即反转录获得cDNA,采用全式金反转录试剂盒TransScriptⅡFirst-Strand cDNA Synthesis SuperMix。后将cDNA进行PCR扩增,条件为94℃5min,94℃30s,53℃30s,72℃30s,30cycles,72℃10min,退火温度为53℃。
1.2.5.4 PCR扩增产物的鉴定:琼脂糖电泳鉴定PCR产物。
1.2.6 病毒滴度(TCID50)的测定:用96孔细胞培养板进行毒价测定。将在不同细胞上接种CDV后收获的病毒液分别做10-1~10-10倍梯度稀释,每个稀释度接种8个孔,每孔加入不同稀释度的病毒液100μL。37℃,CO2培养箱培养1h,1h后弃去吸附的病毒液,换为维持液继续培养,逐日观察记录CPE中状况。根据Reed-Munch法计算。
2 结果
2.1 CDV标准株Snyder Hill株在两种细胞中的培养情况(表1及彩插1图1)
Vero-dst cells:第一代即出现CPE,表现为出现合胞体、空泡且细胞变圆、脱落。同时于接毒后6h、12h、18h、24h、36h、48h监测CPE情况,病变约在培养12h后出现,且在24h后病变率为100%。而后继续培养发现细胞全部脱落死亡。
Vero cells:第一代未出现CPE,进行盲传。盲传10代始终未出现CPE,视为阴性。
2.2 野毒在两种细胞中的培养情况(表1及彩插1图1)
Vero-dst cells:第一代即出现CPE,表现为出现合胞体、空泡且细胞变圆、脱落。同时于接毒后6h、12h、18h、24h、36h、48h观察CPE情况,病变约在培养12h后出现,且在24h后病变率为100%。而后继续培养发现细胞全部脱落死亡。
Vero cells:首代未出现CPE,进行盲传。盲传10代始终未出现CPE,视为阴性。
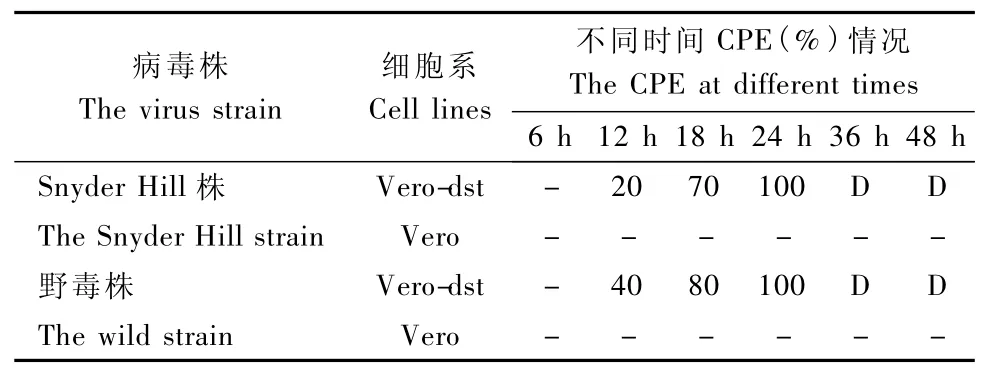
表1 Snyder Hill株与野毒株在Vero-dst及Vero细胞中CPE情况Tab.1 The CPE of Vero-dst cells and Vero cells after infection of CDV
2.3 RT-PCR
CDV标准株及野毒株的Vero-dst细胞培养物中扩增出了CDV基因片段(178bp),而Vero细胞培养物中未扩增出相应基因片段(图2)。
2.4 Snyder Hill株与野毒株病毒毒力测定
经过毒力测定,CDV标准株Snyder Hill株经培养后TCID50为10-4.25/0.2mL;野毒株为10-4.95/0.2mL,由此可见,野毒株毒力比标准株较强。
3 讨论
目前,分离CDV用的组织细胞主要有原代细胞及传代细胞系两大类。原代培养细胞有犬或貂的肺和腹腔巨噬细胞、肾细胞、胚胎细胞、外周血淋巴细胞、T淋巴细胞、犬脑细胞(DB)、犊牛的肾细胞和T淋巴细胞、牛胚胎肺细胞和鸡胚成纤维细胞(CEF),其中CEF应用最多。其中最有效的方法是用幼犬或雪貂的肺巨噬细胞进行培养。但由于原代细胞制备过程繁琐且很容易污染,故分离CDV多用传代细胞。分离CDV所使用的传代细胞系有犬肾细胞系(MDCK)、猫胚胎细胞系(FE)、猫肾细胞系(CRFK)、乳仓鼠胎肾细胞系(BHK-21)、非洲绿猴肾细胞系(Vero)及其克隆株(Vero E6)、BGMK细胞系、绒猴B淋巴细胞系(B95a)、人子宫颈癌细胞系(Hela)、人喉头癌细胞系(HEP-2)、CV-1(Tc7 clone)细胞系、Bsc-1细胞系、兔肾细胞系(RK13)、BD细胞系等。近年来,用Vero细胞分离培养CDV被认为是首选细胞[5]。而据Seki等[6]的研究显示,vero细胞在分离犬瘟热野毒株时并未表现出细胞适性,即未见CPE。另有报道称用vero细胞分离CDV时需要多次盲传并添加胰酶,才有可能出现CPE,这样就给CDV的研究带来不便。在国外某些实验室,他们使用来源于狨猴淋巴细胞的B95a细胞系来分离CDV,实验结果表明此细胞无论在敏感性还是CPE类型上都优于其他细胞,而且分离到的CDV野毒保留了其对宿主动物的致病性。但B95a细胞做为一种被EB病毒转化的细胞系,在操作过程中会释放EB病毒,这就涉及了生物安全的问题,因此该类细胞系难以得到推广应用。
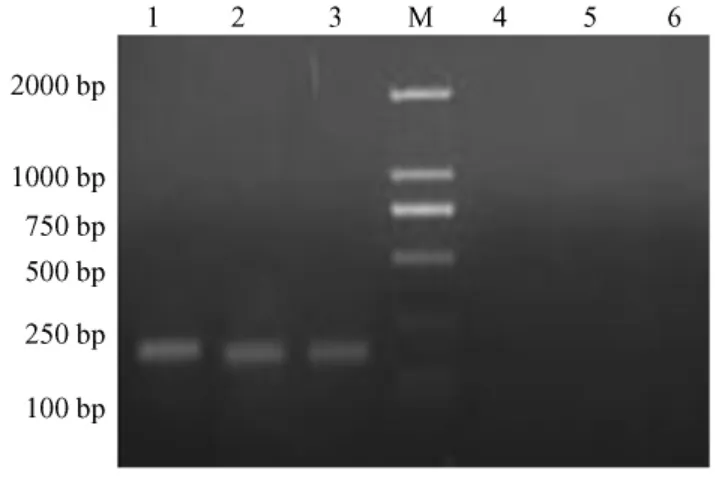
图2 RT-PCR扩增结果Fig.2 The result s of RT-PCR amplification
因此,如何选用敏感细胞是首要的问题。病毒感染细胞的第一步即病毒与细胞膜表面的受体结合,病毒通过细胞表面识别此类病毒的受体粘附于细胞继而侵入细胞,与细胞表面相应受体的结合是病毒感染复制过程中的始动环节,是决定病毒的宿主特异性、组织嗜性及致病性的主要因素之一,即受体决定病毒的细胞嗜性[7]。近年来,信号淋巴激活分子(SLAM,CD150)研究很多,其被认为是麻疹病毒感染细胞时宿主动物识别的细胞受体。有报道称,SLAM(CD150)是CDV等麻疹病毒的受体[8,9],SLAM(CD150)表达于未成熟的胸腺细胞、激活的T和B细胞及巨噬细胞和树突状细胞表面[10]。而CDV通过识别SLAM(CD150)而进入细胞内复制。而Seki等人[6]的研究也表明应用能够稳定表达犬SLAM的Vero-dst细胞系较Vero或B95a细胞系能快速且敏感地分离出CDV野毒株,因此该细胞系可以用来体外研究CDV野毒株的生物学特性。Wenzilow等[11]的实验通过检测足垫、淋巴结、肺及脑组织,发现患有犬瘟热的病犬各组织中SLAM受体的表达量远高于正常犬,且差异十分显著。同时还发现,在试验感染的犬中,各组织SLAM表达量在感染初期急剧上调。这种受体表达的上调导致了CDV感染更多的敏感细胞,进而使病毒大量增殖,最终引起组织损伤。由此可见,在进行CDV分离或是培养增殖的过程中,SLAM受体无疑起到了至关重要的作用。
通过本实验也可以看出,稳定表达犬SLAM的Vero-dst细胞对于CDV十分敏感,且出现CPE的时间短。而未表达SLAM的Vero细胞始终未见敏感性,这与国外的相关研究一致。
纵观国内许多研究,均提到使用vero细胞可从病料中成功分离到CDV[12-14],而本研究曾多次反复尝试,均未成功分离,故从本实验中可以看到,目前本实验室所使用的vero细胞在CDV的分离培养中并未表现良好的适应性。由此可见对于病毒体外研究,敏感细胞不可或缺。对于CDV的研究,能够稳定表达犬SLAM受体的细胞系的建立解决了这个问题。从实验结果中可以看出,无论是对分离的CDV野毒株还是增殖培养的CDV标准株,Vero-dst细胞较Vero细胞均表现处理良好的细胞嗜性。对此,国内报道说法不一,且未见将Vero-dst细胞与Vero细胞进行系统比较。
本实验通过Vero及Vero-dst两种细胞对CDV敏感性对比,提示稳定表达犬SLAM的Vero-dst细胞对于CDV较敏感,且CPE出现所需时间短,是分离CDV较为理想的细胞系。
[1]Mee AP,Dixon JA,Hoyland JA,et al.Detection of canine distemper virus in 100%of Paget’s disease samples by in situreverse transcriptase-polymerase chain reaction[J].Bone 1998,23(2):171-175.
[2]Yoshikawa Y,Ochikubo F,Matsubara Y.Natural infection with canine distemper virus in a Japanese monkey(Macaca fuscata)[J].Vet.Microbiol,1989:20:193-205.
[3]傅继华.病毒学实用实验技术技术[M].山东:山东科学技术出版社,2001:45-50.
[4]殷震,刘景华.动物病毒学(第2版)[M].,北京:科学出版社,1997:756-760.
[5]Wright NG,Conwell HJC.Canine distemper:current concept in laboratory and clinical diagnosis[J].Vet Rec,1974,94:86-92.
[6]Seki F,Ono N,Yamaguchi R.Efficient isolation of wild strains of canine distemper virus in vero cells expressing canine SLAM(CD150)and their adaptability to Marmoset B95a cells[J].Virology,2003,77(18):9943-9950.
[7]郭爱珍,陆承平.病毒的细胞膜受体[J].中国病毒学,1997,12(4):295-301.
[8]Hironobu T,Yusuke Y.The morbillivirusreceptorSLAM(CD150)[J].Microbiol Immunol,2002,46(3):135-142.
[9]von Messling V,Svitek N,CattaneoR.Receptor(SLAM[CD150])recognition and the V protein sustain swift lymphocyte-based invasion of Mucosal tissue and lymphatic organs by a morbillivirus[J].J.Virol,2006,80(12):6084-6092.
[10]赵建军,张海玲,高晗.狐、貉和水貂犬瘟热病毒受体SLAM的基因克隆及其真核表达[J].兽类学报.2010,30(1):79-86.
[11]Wenzlow N,Plattet P,Wittek R,et al.Immunohistochemical demonstration of the putative canine distemper virus receptor CD150 in dogs with and without distemper[J].Vet Pathol,2007,44:943-948.
[12]张洪英,司徽,高艳.犬瘟热病毒强毒株的分离与鉴定[J].中国预防兽医学报.2007,29,8:579-583.
[13]肖定福,张汇东,温海.犬瘟热病毒的分离鉴定[J].中国兽医杂志.2007,43(1):38-42.
[14]闫喜军,柴秀丽,罗国良.貉犬瘟热病的分离与鉴定[J].特产研究.2006,4:1-3.

