同种异体大鼠骨髓间充质干细胞移植对放射性空肠损伤的修复作用
宋祥福,孙冰雪,张静春,龚守良
(1.吉林大学公共卫生学院卫生部放射生物学重点实验室,长春 130021;2.吉林大学生命科学院药物制剂,长春 130021;3.吉林大学中日联谊医院检验科,长春 130033)
腹部接受一定剂量射线照射后,小肠因其黏膜上皮生长代谢活跃,对电离辐射最为敏感,而成为受损伤的主要器官。放射性肠损伤疾病在治疗中存在着很大的困难,目前多以对症治疗为主。MSCs具有强大的增殖能力和多向分化潜能,免疫原性弱,易从骨髓中分离、纯化及体外扩增等特点,因此是异体组织修复的理想的种子细胞。创伤可以刺激MSCs迁移至受损器官或组织,并有助于受损组织修复和重建[1]。为此,本研究拟通过体外培养扩增大鼠MSCs后注入放射性空肠损伤模型大鼠,观察其移植后对空肠组织修复情况,为其临床应用奠定基础。
1 材料和方法
1.1 试剂与仪器
DMEM培养基(Gibco公司)、胎牛 血清(Hyclone公司)、胰蛋白酶(Gibco公司)和4,6-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)(Sigma公司)。倒置显微镜(日本Olympus)、冰冻切片机(德国莱卡)、激光共聚焦显微镜(日本Olympus)。
1.2 MSCs分离、纯化与体外培养与标记
选用5d大鼠乳鼠(8.0~10.0g),颈椎脱臼法处死,75%酒精浸泡5min,无菌条件下快速分离股骨和肱骨,剪除骨两端,用5.0mL L-DMEM培养基,反复冲洗骨髓腔内骨髓于培养皿内,经反复吹打制成单细胞悬液,加入L-DMEM培养液(含15%胎牛血清、100U/mL青霉素、100μg/mL链霉素)以1.0×105/mL接种于50mL培养瓶中,37℃5%CO2饱和湿度孵箱培养,3d后第一次半量换液,以后换液依具体情况而定,细胞接近90%融合时,按1.5×104/mL传代。倒置显微镜逐日观察,直至贴壁细胞融合铺满瓶底,重复以上操作,反复传代扩增。参照文献[2]的方法选取第三代MSCs于注入前1d进行标记的MSCs DAPI标记,并应用流式细胞术检测细胞表型,应用成骨细胞诱导液和脂肪样细胞诱导液诱导MSCs定向分化,鉴定其分化能力。
1.3 放射性肠损伤动物模型制作
选用成年Wistar雌性大鼠40只,清洁级,合格证号SCXK(吉)2003-0007体重240~260g。动物称重后10%水合氯醛麻醉(3.5mL/kg),仰卧在特制的固定盒中,以贵阳医疗仪器厂生产的X.S.S.Z 250型深部X线机给予全腹部照射,大鼠腹部给予1cm的组织补偿,从剑突到耻骨联合,照射面积8.5cm×8.5cm,源皮距60cm,单次照射剂量5Gy,每隔72h照射1次,共5次。
1.4 动物分组及处理
将辐射大鼠随机分为MSCs治疗组(12只)和模型组(12只)和DAP标记组(4只),另设正常对照组(12只)。取4只模型大鼠,于第3次照后静脉注射DAPI标记的MSC,分别在照射后2和7d取空肠,共聚焦显微镜观察富集情况,每个时间点2只。MSCs治疗组大鼠分别于第3、4、5次照射后,当日尾静脉注射同种异体间充质干细胞1mL,浓度1×106细胞/mL。正常对照组和辐射组不做其他处理,于最后一次注射MSCs后7d和30d处死各组动物,病理学观察空肠组织结构。
2 结果
2.1 大鼠骨髓MSCs的分离培养
培养1d后,大部分细胞呈圆形贴壁,2d可见有少数细胞开始伸出突起,呈梭形和多形性,3d后,许多细胞呈梭形贴壁,部分细胞可见脂肪滴样空泡,待换液后细胞生长速度加快,潜伏期约为6~24h,对数生长期约为2~5d,接种后6~7d进入平台期。细胞到第3代时,细胞长梭形,折光性强,细胞边界清楚,细胞排列有一定的方向性,呈放射状、或旋涡样排列。经流式细胞仪检测MSCs表面不表达CD34,成骨样细胞诱导体系诱导后,碱性磷酸酶染色深染,脂肪诱导体系后,细胞内可见脂滴(图1,见彩插3)。体外DAPI标记的MSC胞核呈明亮蓝色荧光。
2.2 MSCs在大鼠空肠组织内的富集
激光共聚焦显微镜观察发现MSCs注入2d切片背景出现荧光;7d时切片小血管壁呈现较强荧光(图2,见彩插3)。
2.3 各组大鼠空肠组织学观察
正常大鼠空肠黏膜结构清楚,隐窝深遂,腺体丰富;模型组7d黏膜上皮细胞坏死脱落,隐窝几乎完全破坏,治疗组7d黏膜坏死组织较少,黏膜增厚;30d模型组小肠出现间质纤维增多;30d治疗组核分裂相增加,黏膜增厚,绒毛逐步再生,较模型组增加明显。间质纤维增多减少,隐窝结构基本清楚(图3)。
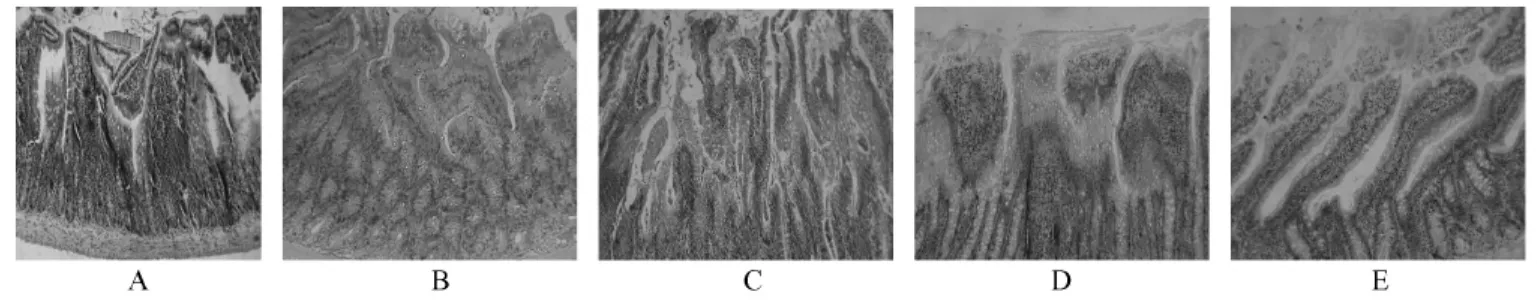
A:正常组;B:模型组7d;C:MSCs治疗组7d;D:模型组30d;E:MSCs治疗组30d图3 普通光学显微镜下各组小鼠空肠组织学形态A:Normal group;B:Irradiation group,7d;C:MSCs group,7d;D:Irradiation group,30d;E:MSCs group,30dFig.3 Histological appearance of the jejunal tissue.HE staining
3 讨论
肠黏膜受损后肠道干细胞可沿着隐窝绒毛轴分化为成熟细胞,取代受损脱落和凋亡的细胞,参与肠道损伤的修复[3]。据此推测,在肠道发生急慢性损伤时,调整小肠干细胞的再生或外源性输入干细胞可能成为一种新型的治疗方法,有望加速黏膜上皮修复和胃肠功能的恢复。
MSCs是一种成体多能干细胞,具有巨大增殖潜能,能向多种类型的细胞分化。王蓓等[4]用肠壁固有层和黏膜下层的结缔组织成功诱导MSCs分化成为上皮细胞,并具有肠上皮细胞的表型。Jiang等[5]发现,在体外诱导条件下,小鼠MSCs能横向分化成胃肠道上皮细胞。既然骨髓间充质干细胞在体外可以在诱导因子的作用下向肠上皮细胞转化。那么,也有理由认为,骨髓间充质干细胞进入体内后,也可以在适当的体内诱导环境中,根据生命体的需要向其急需的有再生需求的肠上皮细胞转化,并增殖分化替代损伤或坏死的细胞,使得受损组织得以恢复。骨髓来源的MSC能够在移植后准确定位于损伤部位,促进损伤部位的愈合[6]。研究者将同种异体骨髓间充质干细胞移植在肠缺血-再灌注损伤的动物模型中,发现骨髓间充质干细胞可在受体肠道内定植,并可加速肠道损伤的恢复[7]。曹晓沧等[8]将人脐带间充质干细胞移植对小鼠辐射性肠道损伤模型体内5周后,发现移植细胞分布于肠黏膜淋巴组织内和腺上皮细胞间,小鼠的一般状况和肠道病理学表现明显改善。本研究结果与上述报道一致,把DAPI标记的MSCs移植入放射性空肠损伤的大鼠体内2d后,切片可见蓝色荧光,7d时小血管壁呈现较强荧光,说明移植的MSCs通过血液循环迁移至受损的肠组织并参与再生修复,并且病理可见MSCs输入后7d黏膜坏死组织较少,黏膜增厚,30d核分裂相增加,间质纤维增多减少,隐窝结构基本清楚,说明MSCs被趋化到受损伤的空肠组织,参与了肠道黏膜的修复过程。
有研究表明:移植的MSCs通过血液循环迁移至受损组织,能够减轻炎症对肠组织的损伤[9],并且在损伤的局部MSCs能够促进新生血管的生成,从而促进组织细胞的增殖[10]。也有研究者认为MSCs细胞也通过自分化、旁分泌和启动内源性修复机制参与再生修复[11]。关于MSCs的对损伤组织的修复机制仍需进一步的研究。
[1]Badiavas EV,Abedi M,Butmarc J,et al.Participation of bone marrow derived cells in cutaneous wound healing[J].Cell Physiol,2003,196(2):245-250.
[2]朱勇,陈良万,林若柏,等.SD大鼠骨髓间充质干细胞体外培养、表型鉴定及标记[J].吉林大学学报:医学版,2009,35(2):326-331.
[3]Anisa S,Deborah CR.Intestinal stem cells and epithelialmesenchymal interactions in the crypt and stem cell niche[J].Transl Res,2010,156(3):180-187.
[4]王蓓,汪维伟.胎儿肠壁结缔组织对骨髓间充质干细胞的分化诱导[J].重庆医科大学,2006,34-35.
[5]Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adult marrow[J].Nature,2002,418(6893):41-49.
[6]Wu Y,Chen L,Scott PG,et al.Mesenchymal stem cells enhance wound healing through differentiation and angiogenesis[J].Stem Cells,2007,25(10):2648-2659.
[7]高广周,李大伟,李欣,等.同种异体大鼠骨髓间充质干细胞移植在肠缺血-再灌注损伤肠道中的定植及其分化效应[J].中国组织工程研究与临床康复,2010,14(23):4262-4267.
[8]曹晓沧,王邦茂,赵辉,等.脐带间充质干细胞移植对肠辐射损伤模型鼠治疗作用的实验研究[J].中国辐射卫生,2010,19(3):257-262.
[9]Victoni T,Coelho FR,Soares AL,et al.Local and remote tissue injury upon intestinal ischemia and reperfusion depends on the TLR/MyD88 signaling pathway[J].Med Microbiol Immunol,2010,199(1):35-42.
[10]Alison MR,Lovell MJ,Direkze NC,et al.Stem cell plasticity and tumor formation[J].Eur J Cancer,2006,42(9):1247-1256.
[11]薛小军,涂小煌,等.间充质干细胞对肠屏障的保护作用[J].中国现代普通外科进展,2010,13(2):138-142.

