MicroRNA-153对靶基因下游信号分子GSK-3β表达水平及细胞抗损伤能力的影响
梁春联,朱 华,黄 澜,许艳峰,邓 巍,马春梅,刘 颖,秦 川
(卫生部人类疾病比较医学重点实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
MicroRNA(miRNA)是一类长约22个核苷酸的内源性小分子单链RNA,通过抑制转录后mRNA的翻译或降解而调控蛋白表达。脑组织中富含miRNA,因此,其在神经系统发育及疾病中发挥着重要作用。经鉴定,Mir-153是人和小鼠脑组织特异性表达的7种miRNA之一[1]。文献报道,mir-153可调控a-synuclein的表达从而在帕金森病的发病机制中起到一定的作用[2]。本课题前期研究结果表明,mir-153可在体内外调控阿尔茨海默病(Alzheimer’s disease,AD)主要致病基因APP(Amyloid protein precursor,APP)及APLP2(Amyloid precursor-like protein 2,APLP2)的表达。APP和APLP2同属于一类高度保守的跨膜糖蛋白家族,且APP和APLP2经蛋白酶水解后均可生成位于胞内的小分子肽段(intracellular domains,ICDs),大量研究表明,除Aβ肽外,ICDs在AD的发病机制中也起着重要作用,然而其具体的作用途径尚有待进一步阐明。文献报道,ICDs可活化糖原合酶激酶3β(glycogen synthase kinase 3β,GSK-3β)等基因的表达,而GSK-3β则是磷酸化TAU蛋白的主要激酶之一,因此,GSK-3β将淀粉样蛋白沉积和TAU蛋白磷酸化这两个AD主要的病理特征紧密联系在一起[3]。然而,关于ICDs的转录活化作用尚存有争议。此外,多方研究显示ICDs还可降低细胞抗应激的能力、促进其凋亡水平的增加。鉴于我们前期的研究结果,mir-153可抑制APP和APLP2的蛋白表达,从而降低其胞内水解片段ICDs的水平。因此,我们推测mir-153也会影响下游信号分子GSK-3β的转录活性及细胞凋亡水平。为了对上述推论进行验证,本文对高表达mir-153时GSK-3β的蛋白水平及细胞抗氧化应激和毒性刺激的能力进行了检测,以期进一步探讨mir-153在AD发病中的作用机制。
1 材料和方法
1.1 实验动物
将鼠mir-153表达载体(OriGene)注入C57BL/6J小鼠受精卵细胞内,构建mir-153转基因小鼠,转基因由巨细胞病毒启动子启动表达。PCR鼠尾鉴定成功转入外源基因的阳性小鼠,再经real-time PCR筛选高表达mir-153的阳性小鼠作为实验动物。动物合格证号:ILAS-PL-2010-003。
1.2 mir-153稳转细胞系的构建
SH-SY5Y细胞培养于加有10%热灭活胎牛血清和100U/mL青链霉素的DMEM培养液(Gibco)中,使用Lipofectamine 2000(Invitrogen)将mir-153表达载体或阴性对照质粒转入细胞内,转染后48h将细胞按一定比例稀释后传到10cm皿中培养,并加入3μg/mL的blasticidin进行筛选。经3~4周的抗性筛选后挑取带GFP的阳性单克隆进行扩大培养,real-time PCR筛选高表达mir-153的单克隆细胞系。
1.3 Western-blot
提取稳转细胞系及转基因小鼠脑总蛋白,将40μg蛋白经12%的SDS-PAGE胶分离后转移至NC膜上,在含5%牛奶的TBST中室温封闭1h,经鼠抗tau单克隆抗体(sc-166060,Santa Cruz),鼠抗gsk-3β单克隆抗体(sc-53931,Santa Cruz),兔抗p-tau多克隆抗体(ab4864,Abcam),兔抗p-gsk-3β多克隆抗体(ab-75745,Abcam)4℃过夜杂交,TBST洗膜后,与HRP标记的羊抗兔IgG进行杂交,室温孵育1h,TBST洗膜后进行化学发光反应,同时检测甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的表达作为内参。
1.4 Aβ42和H2O2的制备及分组
如文献所述,用六氟异丙醇(hexafluoroisopropanol,HFIP,Sigma)溶解冻干粉状的Aβ42肽(Sigma),将HFIP彻底挥发后制成Aβ肽膜,再用无水的二甲基亚砜(DMSO,Sigma)溶解肽膜制成5mmol/L的肽/DMSO溶液,用无酚红的F12培养液(Gibco)将其稀释至100μmol/L,4°C孵育24h后即得Aβ42寡聚体,试验前用不含血清的培养液将其稀释至使用浓度。将30%的H2O2溶液(北京化工厂)先用无菌的去离子水配成储存液,然后再用不含血清的培养液将其稀释至终浓度[4]。
分组:(1)对照处理组:将mir-153稳转细胞、阴性质粒稳转细胞分别经稀释用的无血清培养液作用12~24h;(2)Aβ42处理组:mir-153稳转细胞、阴性质粒稳转细胞分别经10μmol/LAβ42作用12~24h;(3)H2O2处理组:mir-153稳转细胞、阴性质粒稳转细胞分别经200μmol/L H2O2作用12~24h。
1.5 细胞增殖水平的检测
以1.5×104/孔的密度将细胞接种于96孔板中,培养过夜后,加入Aβ42或H2O2,每组设3复孔,同时设空白孔,即不含细胞的无血清培养液孔。作用12h后,使用细胞增殖检测试剂盒(G3582,Promega)于酶标仪上测定490nm吸光度(A)值。按公式:细胞存活率=(mir-153或阴性质粒稳转细胞处理组A值-空白孔A值)÷(mir-153或阴性质粒稳转细胞对照处理组A值-空白孔A值),计算各组细胞存活率。
1.6 细胞凋亡水平的检测
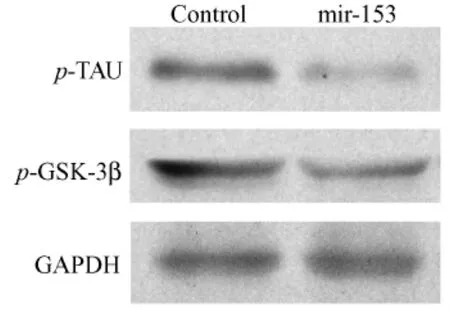
图1 稳转细胞系内p-tau及p-gsk-3β蛋白的表达Fig.1 The expression of p-tau and p-gsk-3β protein in stably transfected cells
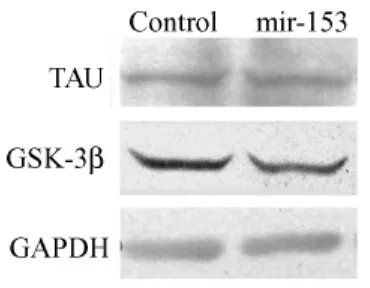
图2 稳转细胞系内tau及gsk-3β总蛋白的表达Fig.2 The expression of tau and gsk-3β total protein in stably transfected cells.
如上所述,将细胞接种于96孔培养板中,经Aβ42和H2O2作用24h后,收集细胞调整浓度,取1×105个细胞分别加入5μL annexinV及5μL 7-AAD(PE annexin V apoptosis detection kit.Biosciences),室温避光孵育15min后加入binding buffer,立即上流式细胞仪分析。
1.7 统计分析
数据经SPSS软件处理,t检验进行统计学分析,结果以±s表示,以P<0.05定义为差异有显著性。
2 结果
2.1 Western blot检测稳转细胞系及转基因小鼠体内tau及gsk-3β的表达
提取稳定转染mir-153表达载体及阴性对照质粒的SY5Y细胞总蛋白,经12%SDS胶分离之后检测磷酸化tau蛋白、磷酸化gsk-3β以及其总蛋白的表达。结果显示(图1,2),以转染阴性对照质粒的稳转细胞作为对照,稳定转染mir-153表达载体的细胞中磷酸化gsk-3β及其总蛋白的表达水平均降低。同时,磷酸化tau蛋白的表达水平也显著降低而其总蛋白的表达无明显变化。提取mir-153转基因小鼠脑蛋白,同样经Western-blot检测上述蛋白的表达。结果显示(图3,4,5),与稳转细胞结果相一致,转基因小鼠脑内gsk-3β及其总蛋白的表达水平较同窝阴性鼠均降低,而磷酸化tau蛋白及其总蛋白的表达则无明显变化。
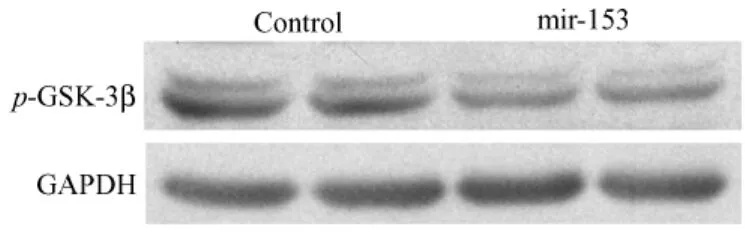
图3 Mir-153转基因鼠体内p-gsk-3β蛋白的表达Fig.3 The expression of p-gsk-3β protein in mir-153 transgenic mice
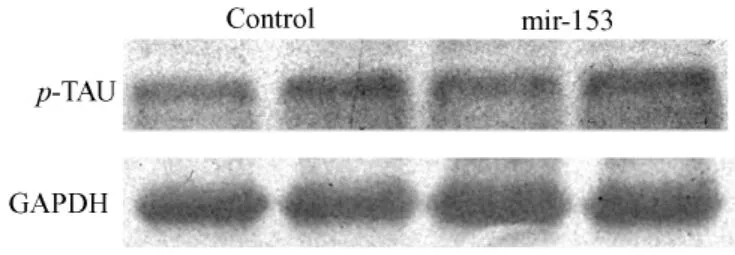
图4 Mir-153转基因鼠体内p-tau蛋白的表达Fig.4 The expression of p-tau protein in mir-153 transgenic mice
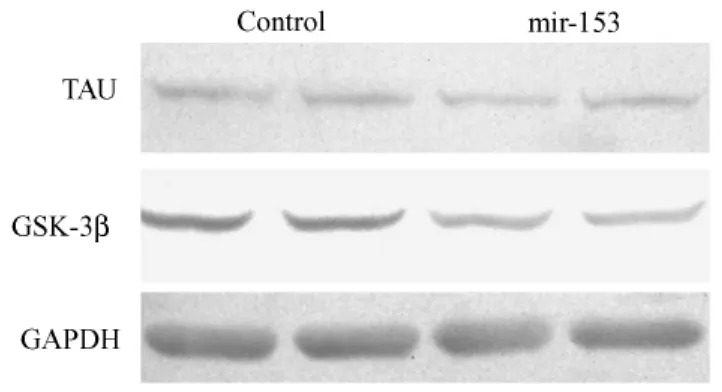
图5 Mir-153转基因鼠体内tau及gsk-3β总蛋白的表达Fig.5 The expression of tau and gsk-3β total protein in mir-153 transgenic mice
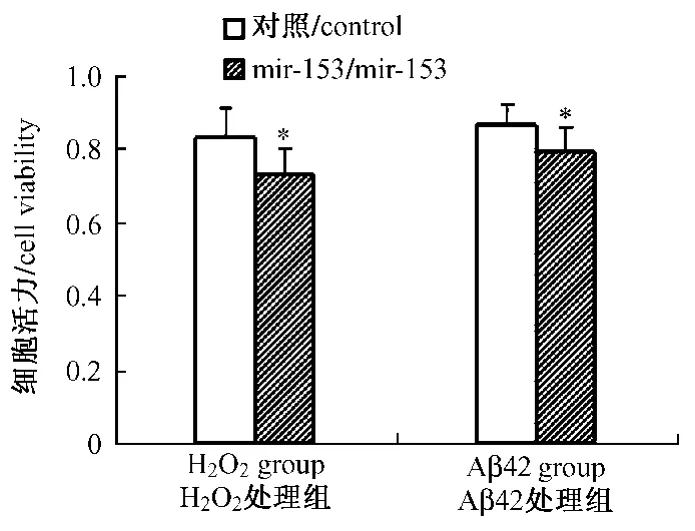
图6 Aβ42和H2O2处理后细胞活力的检测。*P<0.05Fig.6 The assay of cell viability after Aβ42和H2O2treatment.*P<0.05
2.2 Aβ42和H2O2处理后细胞增殖水平的检测
将稳定转染mir-153表达载体或阴性对照质粒的SY5Y细胞分别经Aβ42和H2O2处理12h后,MTS法分析细胞增殖活力水平的变化,每次各处理组重复3复孔,试验重复3次,t检验进行统计学分析。结果显示(图6),mir-153稳转细胞系经Aβ42和H2O2处理后,其增殖活性均较经同样处理的阴性质粒稳转细胞系显著降低(P<0.05)。
2.3 Aβ42和H2O2处理后细胞凋亡水平的检测
将稳定转染mir-153表达载体或阴性对照质粒的SY5Y细胞分别经Aβ42和H2O2处理24h后,流式细胞仪检测凋亡细胞数量的变化,每次各处理组重复2个样本,试验重复2次,经统计分析后结果显示(图7),mir-153稳转细胞系与阴性质粒稳转细胞系的对照处理组间凋亡细胞数无明显差异,表明这两种稳转细胞系的凋亡水平相同。而mir-153稳转细胞系经Aβ42或H2O2处理后,其凋亡细胞数较经同样处理的阴性质粒稳转细胞系显著增加,(分别为P<0.05,P<0.01)。
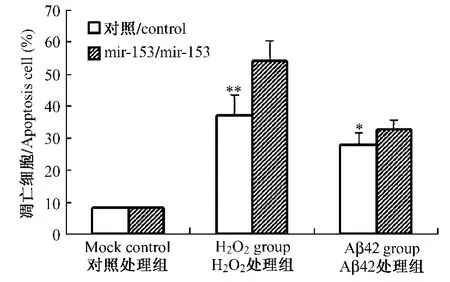
图7 Aβ42和H2O2处理后细胞凋亡水平的检测。*P<0.05,**P<0.01Fig.7 The assay of apoptosis cell after Aβ42和H2O2treatment.*P<0.05,**P<0.01
3 讨论
APP是Aβ肽的前体蛋白,其表达水平的增加可直接导致Aβ肽生成增多从而成为AD的主要致病基因。而其它多方研究证明APLP2在AD的发病机制中也起着重要作用[5]。作为同一家族的成员,APP和APLP2的蛋白结构域和氨基酸序列高度相似(71%),尤其是ICD编码区相似度更高[6]。然而,APLP2无Aβ结构域,因此Aβ肽仅由APP生成。但APP和APLP2均可经内分泌酶水解生成大小为5KD的胞内生物活性肽ICDs。经多方报道,ICDs在AD发生的早期事件中起着重要作用,如:活化GSK-3β等基因的转录;调节细胞凋亡水平及使细胞骨架结构发生改变等[7]。其中,最受研究人员关注的是ICDs的基因转录活性,但同时也是争议的焦点。究其原因主要源于对不同细胞系及动物模型的研究导致了试验结果间的差异性。
Tau蛋白异常磷酸化导致神经纤维缠结形成是AD的主要病理特征之一,可磷酸化Tau蛋白的激酶主要包括有GSK-3β、Cdk5、ERK等。而鉴于文献报道,ICDs可活化GSK-3β的表达,结合本课题前期研究结果—mir-153可下调APP及APLP2的蛋白表达继而使细胞内ICDs水平降低,因此,本文主要通过稳转细胞系及转基因小鼠模型来探讨在高表达mir-153时GSK-3β及Tau蛋白水平的变化[5,8]。结果显示,在mir-153稳转细胞系中,磷酸化GSK-3β、GSK-3β总蛋白及磷酸化Tau蛋白的水平显著降低,而Tau总蛋白则无明显变化。第216位酪氨酸的磷酸化是GSK-3β的活化形式,磷酸化的GSK-3β及其总蛋白的降低表明在体外细胞系中,mir-153表达水平增加可导致其靶基因水解产物ICDs含量的减少、基因转录活性的降低从而使GSK-3β总蛋白及其激酶活性下降、Tau蛋白磷酸化水平降低,但却不影响Tau总蛋白的表达。为进一步验证上述结论,我们构建了mir-153转基因小鼠,并对其脑内这两种蛋白的表达进行了检测。结果显示,GSK-3β的表达与细胞试验相一致,所不同的是在转基因鼠脑内磷酸化Tau及其总蛋白的表达均无明显变化,分析原因可能归结于:机体内存在有复杂的调控机制及代偿机制;除GSK-3β外,尚有其它多种激酶可催化Tau蛋白的磷酸化。
为进一步验证mir-153靶基因下游信号分子的作用,将mir-153稳转细胞分别经Aβ42和H2O2处理后,检测其抗应激损伤的能力。结果显示,应激状态下高表达mir-153可使细胞增殖能力降低、凋亡水平增加。这与预期结果ICDs减少、细胞存活率提高相悖,然而,因一种miRNA可同时调控多种靶蛋白的表达,除APP、APLP2外,研究表明[9]mir-153尚可调控Bcl-2及Mcl-1的表达。此外,文献报道的ICDs的促凋亡作用多鉴于对高表达ICDs片段(而非其前体蛋白)的鼠和细胞的研究,而除致病作用外,在健康个体中,APP、APLP2蛋白本身尚具有其它一些正常生理功能,如促进神经细胞的粘附、分化等,尤其值得注意的是APP水解后除可生成具有神经毒性作用的Aβ42外,尚可生成具有神经营养作用的sAPP-α,因此,不能单纯的将APP定义为有害基因[10]。
综上所述,mir-153可通过对靶蛋白APP及APLP2的调控而影响其下游信号分子GSK-3β的活性,虽然mir-153转基因鼠脑内磷酸化TAU和总蛋白均不变,但除促进TAU磷酸化的激酶活性外,GSK-3β尚在其它一些细胞生物事件中发挥着作用,如:细胞周期的进程、细胞存活、细胞骨架的维持等[11,12]。且已经证实[5],AD患者脑内GSK-3β的表达增加。此外,因mir-153尚可调控抗凋亡基因的表达等因素,mir-153水平增加可降低细胞抗损伤的能力。然而,这些不同靶蛋白间的协调作用尚有待进一步的研究。
[1]Lorenzo FS,Sarah F,Ian PR et al.Expression profiling of mammalian microRNAs uncovers a subset of brain-expressed microRNAs with possible roles in murine and human neuronal differentiation[J].Genome Biology 2004,5(3):R13.1-13.11.
[2]Doxakis E.Post-transcriptionalregulation of alpha-synuclein expression by mir-7 and mir-153[J].J Biol Chem.2010,285(17):12726-12734.
[3]Chang K A,Kim H S,Ha T Y et al.Phosphorylation of amyloid precursor protein(APP)atThr668 regulates the nuclear translocation of the APP intracellulardomain and induces neurodegeneration[J].Mol Cell Biol.2006,26(11),4327-4338.
[4]Stine WB Jr,Dahlgren KN,KrafftGA etal.In vitro characterization of conditions for amyloid-β peptide oligomerization and fibrillogenesis[J].J Biol Chem.2003,278(13):11612-11622.
[5]Xu Y,Kim HS,Joo Y,et al.Intracellular domains of amyloid precursor-like protein 2 interact with CP2 transcription factor in the nucleus and induce glycogen synthase kinase-3b expression[J].Cell Death Differ.2007,14(1):79-91.
[6]Takahashi-Fujigasaki J,Breidert T,Fujigasaki H et al.Amyloid precursor-like protein 2 cleavage contributes to neuronal intranuclear inclusions and cytotoxicity in spinocerebellar ataxia-7(SCA7)[J].Neurobiol Dis.2011,41(1):33-42.
[7]Müller T,MeyerHE,Egensperger Retal.Theamyloid precursor protein intracellular domain(AICD)as modulator of gene expression,apoptosis,and cytoskeletal dynamics—Relevance for Alzheimer’s disease[J].Prog Neurobiol.2008,85(4):393-406.
[8]Terwel D,Muyllaert D,Dewachter I er al.Amyloid activates GSK-3β to aggravate neuronal tauopathy in bigenic mice[J].Am J Pathol.2008,172(3):786-798.
[9]Xu J,LiaoX,WongC etal.DownregulationsofB-cell lymphoma 2 and myeloid cell leukemia sequence 1 by microRNA 153 induce apoptosis in a glioblastoma cell line DBTRG-05MG[J].Int J Cancer.2010,126(4):1029-1035.
[10]Giliberto L,Zhou D,Weldon R et al.Evidence that the amyloid beta precursorprotein-intracellulardomain lowersthestress threshold of neurons and has a"regulated"transcriptional role[J].Mol Neurodegener.2008,2:3-12.
[11]Grimes CA,Jope RS.The multifaceted roles of glycogen synthase kinase 3 in cellular signaling[J].Prog Neurobiol 2001;65:391-426.
[12]Kaytor MD,Orr HT.The GSK 3 beta signaling cascade and neurodegenerative disease[J].Curr Opin Neurobiol 2002;12:275-278.

