I型子宫内膜癌组织中 HIF-1α、Snail与E-cadherin的表达及临床意义
冯振中 陈嘉薇 甘怀勇 郭冰沁 蔡兆根
(蚌埠医学院第一附属医院病理科,蚌埠医学院病理学教研室,安徽233030;1上海交通大学附属第一人民医院病理科,上海200080)
缺氧诱导因子-1α (hypoxia inducible factor -1α,HIF-1α)是缺氧状态下广泛存在于哺乳动物和人体内的一种转录因子,过度表达与肿瘤的细胞增殖、侵袭和转移等多种恶性生物学行为密切相关[1]。上皮-间质转化(epithelial-mesenchymal transition,EMT)是指在特定生理和病理条件下,具有极性的上皮细胞转化为具有间质特性的细胞并获得侵袭、迁移能力的过程。EMT不仅存在于胚胎发育、器官形成中,也是肿瘤细胞原位浸润和远处转移的起始环节和关键步骤。锌指蛋白转录因子Snail能够直接抑制上皮钙黏附素(E-cadherin)的表达,这是EMT过程中重要的分子事件[2,3]。迄今为止,EMT与肿瘤缺氧微环境的关系少见报道,本研究采用免疫组化方法,结合组织芯片技术,检测124例I型子宫内膜癌、28例不典型内膜增生和35例正常内膜组织中 HIF-1α、Snail和E-cadherin的表达,以探讨HIF-1α/Snail/E-cadherin途径对子宫内膜癌组织浸润和转移的作用和意义。
材料和方法
1.研 究对象
收集上海交通大学附属上海市第一人民医院病理科2005年1月至2009年9月手术切除并经病理诊断证实的I型子宫内膜癌,共124例,患者术前均未接受放疗、化疗,具有完整临床资料。年龄27-81岁,平均年龄57岁。根据2000年FIGO标准,临床分期为101例I-II期,23例III-IV期。根据2003年WHO标准,病理分级为高分化57例,中分化41例,低分化26例。肌层浸润>50%者40例,≤50%者84例。有淋巴结转者31例,无转移者93例。子宫内膜不典型增生28例(单纯性不典型增生3例,复杂性不典型增生25例);正常子宫内膜35例(增生期16例,分泌期19例),分别取自妇科活检和子宫平滑肌瘤的内膜组织。
2.方 法和试剂
兔抗人多克隆HIF-1α抗体(Abcam公司,工作浓度1:75),兔抗人多克隆Snail抗体(Abcam公司,工作浓度1:200),鼠抗人单克隆 E-cadherin抗体(工作浓度1:120)、Ultra-Sensitive试剂盒和 DAB显色液(均购自福州迈新生物技术有限公司)。
3.构 建组织芯片
选择所需病例存档蜡块,根据HE切片仔细进行形态学观察,确定具有代表性的病变部位并标记,由上海芯超生物有限公司技术支持。
4.免 疫组织化学染色
采用SP两步免疫组化染色法,实验步骤严格按照说明书进行。PBS代替一抗为阴性对照,已知阳性切片为阳性对照。
5.结 果判定
HIF-1α和Snail蛋白主要定位于细胞核,部分伴有胞质着色,以子宫内膜腺上皮细胞内出现定位明确、染色明显的样本为阳性,判定标准[4,5]:①阳性细胞率:≤5%为0,6-25%为1分,26-50%为2分,51-75%为3分,>75%为4分;②染色强度:无色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。两者乘积<2分为阴性,≥2分为阳性表达。
E-cadherin蛋白主要定位于细胞膜,染色分级标准[5]:以正常内膜组织E-cadherin表达为阳性对照,肿瘤细胞无染色或阳性细胞率≤10%为0分,低度染色且阳性细胞数≥10%为1分,中度染色且阳性细胞数≥10%为2分,癌细胞染色和正常组织相同者为高度染色,且阳性细胞数≥10%为3分。为方便数据统计,0分、1分和2分者均定为E-cadherin表达降低(reduced expression),3 分者定为 E-cadherin表达正常(preserved expression)。
6.统 计学分析
采用SPSS 13.0统计软件。计数资料率的比较采用卡方检验或Fisher精确检验,相关关系采用Spearman等级相关分析,检验水准取双侧α=0.05。
结 果
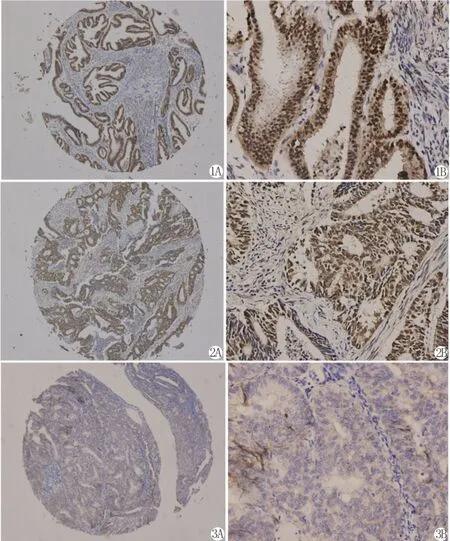
1.HIF-1α、Snail和E-cadherin在不同内膜组织中的表达 HIF-1α、Snail和 E-cadherin在I型子宫内膜癌中的表达率分别为61.3% (76/124)、46.8%(58/124)、36.3%(45/124),与不典型增生和正常内膜组织相比,改变有显著统计学意义(P<0.01)(图1-3,表1)。

表1 HIF-1α、Snail和E-cadherin在不同内膜组织中的表达Table 1 Expression of HIF-1α,Snail and E-cadherin in distinct tissue types
2.HIF-1α、Snail和E-cadherin的表达与I型子宫内膜癌临床病理因素的关系
I型子宫内膜癌中HIF-1α表达与病理分级、肿瘤肌层浸润和淋巴结转移明显相关(P<0.05),但与其他临床病理指标无明显关系。Snail阳性表达与手术病理分期和淋巴结转移明显相关(P<0.05)。E-cadherin蛋白与肌层浸润和淋巴结转移明显相关(P<0.01)(表2)。
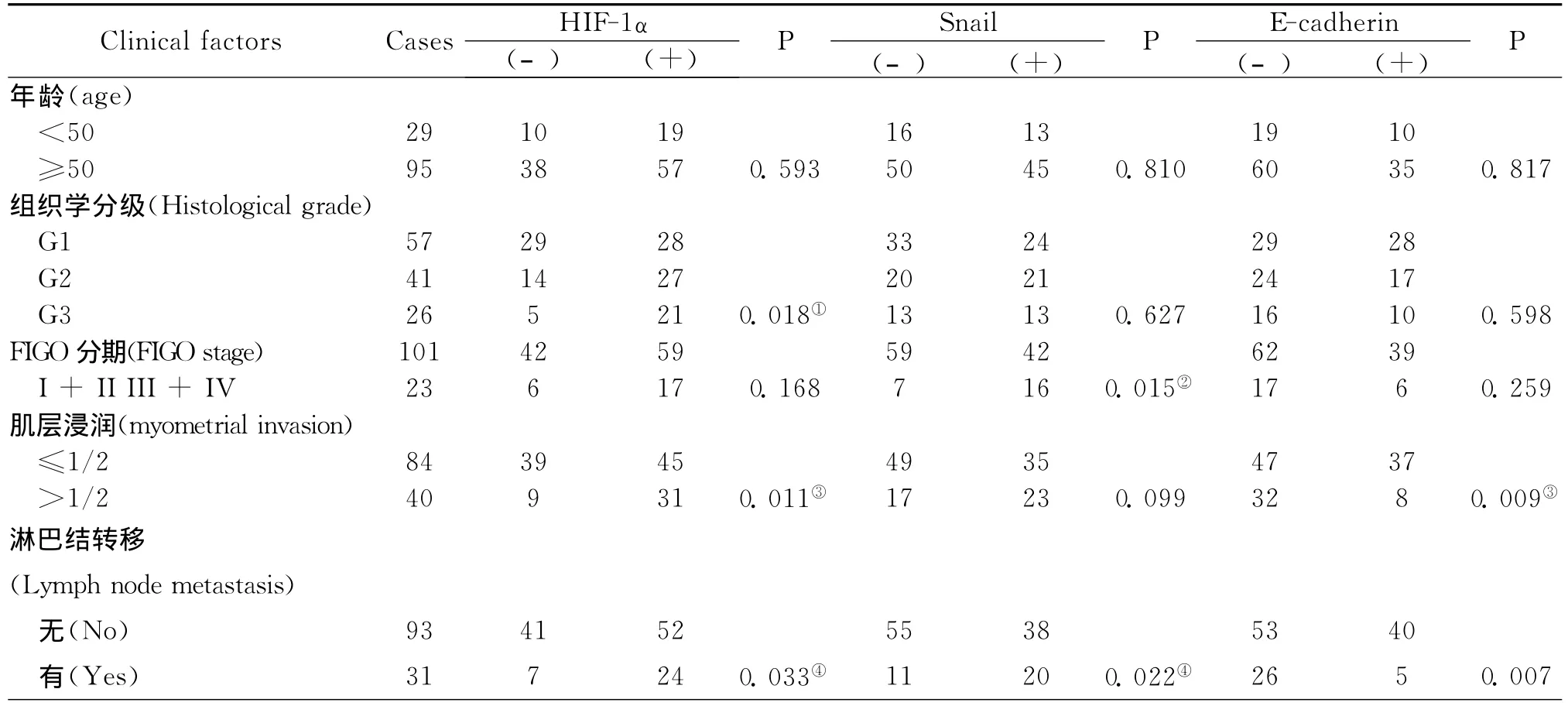
表2 HIF-1α、Snail和E-cadherin表达与I型子宫内膜癌临床病理指标的关系Table 2 The association of HIF-1α,Snail and E-cadherin expression with clinicopathological features in Type I endometrial carcinoma
3.I型子宫内膜癌中 HIF-1α、Snail和 E-cadherin的相关性
I型子宫内膜癌中HIF-1α与Snail的表达呈正相关关系(r=0.214,P=0.017),Snail与 E-cadherin的表达存在负相关关系(r=-0.203,P=0.024)(表3)。

表3 I型子宫内膜癌中HIF-1α、Snail和E-cadherin的相关性Table 3 The correlation between HIF-1α,Snail and E-cadherin expression in Type I endometrial carcinoma
讨 论
缺氧是绝大多数恶性肿瘤,尤其是实体肿瘤的共有特征,HIF-1α是调节细胞内氧代谢的关键性作用因子,影响下游多种靶基因的转录和表达,涉及细胞能量代谢、新生血管生成、离子代谢等过程,最终促使肿瘤细胞适应缺氧微环境,得以持续生长和扩散转移。本研究结果发现,HIF-1α蛋白在I型子宫内膜癌中的阳性表达显著升高,和肿瘤细胞分化程度、肌层浸润、淋巴结转移情况明显相关,说明HIF-1α参与子宫内膜癌的恶变过程,并与浸润和转移等恶性行为关系密切,与其他文献报道一致。Yamamoto等[6]对171例浸润型乳腺癌标本研究发现,HIF-1α蛋白在63例肿瘤组织中过度表达,而对应的正常乳腺或良性增生组织呈低度表达,HIF-1α蛋白与乳腺癌肿瘤大小、淋巴结转移、临床分期和组织学分级明显相关,并与肿瘤增殖指数(Ki67标记)、血管内皮生长因子(VEGF)、环氧合酶2(COX-2)等指标有关,多变量生存分析发现,HIF-1α阳性患者的无瘤生存率和总体生存数明显低于HIF-1α阴性患者,HIF-1α是独立的临床预后判断指标。
EMT现象是生物胚胎发育、器官形成和细胞迁移的基础过程,也存在于肿瘤转移级联反应的早期阶段,是侵袭和转移过程的决定性因素。锌指蛋白转录因子Snail基因是EMT过程中的关键调控因子,定位于人第20号染色体20q12.3,编码含264个氨基酸的蛋白质,由一个含有Cys-His(C2H2)锌指结构域的高度保守的羧基末端和一个高度可变的氨基末端构成。E-cadherin是一种重要的细胞间黏附分子,通过形成连接复合物和确立细胞极性在胚胎发育和组织构型完整性中发挥重要作用。E-cadherin启动子区存两个相邻的E-box结构,Snail基因以锌指区域识别并结合E-box序列,直接抑制E-cadherin的表达和功能,从而有力的促进肿瘤侵袭和转移。Yoshida等[7]对95例上皮性卵巢癌的研究中发现,随着良性卵巢上皮到交界性肿瘤到卵巢癌的恶变过程,Snail蛋白的表达逐渐升高,而E-cadherin的表达水平不断降低和缺失,二者的表达呈相反趋势,并且Snail阳性表达患者生存时间明显减少,Snail是独立的临床预后判断指标。本研究工作发现,58例Snail阳性的I型子宫内膜癌中,有74.1% (43/58)E-cadherin 异 常 表 达,而 66 例Snail阴性的标本,仅有54.5% (36/66)E-cadherin蛋白异常,二者在I型子宫内膜癌中呈负性关系(r=0.203,P=0.024),并与肿瘤的淋巴结转移明显相关。结合上述文献,我们认为E-cadherin可能是Snail直接作用的靶基因,在I型子宫内膜癌侵袭和转移过程中发挥重要作用。
目前关于缺氧微环境和Snail基因在肿瘤中的作用和机制,研究报道少见,相互关系尚不明确。Luo等[8]采用荧光素酶报告基因结合ChIP分析发现,在Snail基因启动子序列存在缺氧反应原件(hypoxia-response element,HRE),HIF-1α通过结合 HRE位点从而直接调控Snail的转录和表达,说明Snail基因具有缺氧调控的直接结构基础。Imai等[9]对卵巢癌研究结果显示,5%O2低氧处理72小时后,卵巢癌细胞SKOV3和OVCAR3的HIF-1α含量表达上调,肿瘤侵袭和转移能力增强,伴随Snail基因mRNA含量的明显增加及E-cadherin的显著减少,而正常卵巢上皮细胞OSE则无上述改变,免疫组化染色结果也发现在卵巢癌组织中HIF-1α蛋白高度表达,与E-cadherin的缺失表达具有相关性。本实验结果显示,HIF-1α的表达从正常内膜到不典型增生和子宫内膜癌的演变过程中不断递增(P<0.01),在淋巴结转移标本中,阳性表达明显增加,而Snail蛋白在子宫内膜恶性演变过程中也逐渐递增,与HIF-1α的升高趋势一致,二者在I型子宫内膜癌中呈明显的正相关(r=0.214,P=0.017)。
以上研究表明,在I型子宫内膜癌中存在HIF-1α高度表达现象,HIF-1α可能通过诱导Snail的产生和抑制E-cadherin的表达,促进肿瘤的侵袭和转移生物学行为。针对 HIF-1α/snail/E-cadherin途径的干预方案可能对于子宫内膜癌的诊治具有重要意义。
[1]Semenza GL.Defining the role of hypoxia-inducible factor 1in cancer biology and therapeutics.Oncogene.2010,29(5):625-634
[2]Brandl M,Seidler B,Haller F,et al.IKK(α)controls canonical TGF(β)-SMAD signaling to regulate genes expressing SNAIL and SLUG during EMT in panc1cells.J Cell Sci.2010,123(Pt 24):4231-4239
[3]姜蕊,赵春明,宋美娟,等 .RNA干扰抑制Snail表达对于胃癌细胞上皮间充质转化以及体外侵袭的影响.中国组织化学和细胞化学杂志 .2010,19(5):483-487
[4]Tan H,Ye K,Wang Z,et al.Clinicopathologic Evaluation of Immunohistochemical CD147and MMP-2Expression in Differentiated Thyroid Carcinoma.Jpn J Clin Oncol,2008,38(8):528-533
[5]Blechschmidt K,Sassen S,Schmalfeldt B,et al.The E-cadherin repressor Snail is associated with lower overall survival of ovarian cancer patients.Br J Cancer,2008,98(2):489-495
[6]Yamamoto Y,Ibusuki M,Okumura Y,et al.Hypoxiainducible factor 1alpha is closely linked to an aggressive phenotype in breast cancer.Breast Cancer Res Treat.2008,110(3):465-475
[7]Yoshida J,Horiuchi A,Kikuchi N,et al.Changes in the expression of E-cadherin repressors,Snail,Slug,SIP1,and Twist,in the development and progression of ovarian carcinoma:the important role of Snail in ovarian tumorigenesis and progression.Med Mol Morphol,2009,42(2):82-91
[8]Luo D,Wang J,Li J,et al.Mouse Snail Is a Target Gene for HIF.Mol Cancer Res.2011,9(2):234-245
[9]Imai T,Horiuchi A,Wang C,et al.Hypoxia attenuates the expression of E-cadherin via up-regulation of SNAIL in ovarian carcinoma cells.Am J Pathol.2003,163(4):1437-1447
图 版 说 明
图1 HIF-1α蛋白在I型子宫内膜癌中的表达(SP法,A×40;B×200)
图2 Snail蛋白在I型子宫内膜癌中的表达(SP法,A×40;B×200)
图3 E-cadherin蛋白在I型子宫内膜癌中的阴性表达(SP法,A×40;B×200)
EXPLANATION OF FIGURES
Fig.1Expression of HIF-1αin Type I endometrial carcinoma(SP method,A×40;B×200)
Fig.2Expression of Snail in Type I endometrial carcinoma(SP method,A×40;B×200)
Fig.3Reduced expression of E-cadherin in Type I endometrial carcinoma(SP method,A×40;B×200)