两种方法对上海及周边地区实验大小鼠螺杆菌携带情况的调查
丁 聪,冯 洁,谢建云,高 诚,3,胡建华
(1.扬州大学比较医学中心,扬州 225009;2.上海实验动物研究中心,上海市实验动物质量监督检验站,上海 201203; 3.上海市计划生育科学研究所,上海 200032)
螺杆菌菌属(Helicobacter spp.)是一组最初从人类和其他哺乳动物胃中分离出来的革兰氏阴性、微需氧、螺旋弯曲状细菌,其中具有代表性的是H.pylori。根据它们喜好的定居部位,可被分为胃螺杆菌和肠肝螺杆菌(enterohepatic helicobacter species,EHS)[1]。自1992年Lee等人发现了鼠型螺杆菌以来,已从啮齿类动物肠道中分离出了大量的螺杆菌属新菌株。目前,已有20余种寄生于某些动物和人类胃肠道且有致病性的螺杆菌被正式命名。对啮齿类而言,有肝型(H.hepacticus)、鼠型(H.muridarum)和胆型(H.bilis)。啮齿类螺杆菌以隐性感染的形式广泛存在于实验大鼠、小鼠中[1],被感染动物大多数以慢性、潜伏性感染为主,无明显症状。现已有研究显示这类细菌不仅在人或动物的胃炎、消化性溃疡、胃恶性肿瘤的发生发展中起到致病作用,也可能与肠道、胆道、肝脏的炎症性疾病和一些肿瘤的发生相关。已有报道实验用啮齿类动物普遍存在螺杆菌自然感染[2,3]。
在构建肿瘤模型和毒理实验研究中,实验大鼠、小鼠模型无意中感染螺杆菌将会严重影响实验动物质量,影响实验进程,对实验数据的可靠性产生潜在干扰。在美国和欧洲,大鼠、小鼠群中螺杆菌有较高的流行率[3]。美国、日本、欧洲等发达国家,以及国际实验动物理事会早已将其列为啮齿类实验动物必须排除的病原微生物。由于缺乏模式菌株和有效的检测方法,我国实验动物质量国家标准至今尚未将其列入。这严重妨碍了我国实验动物事业的对外交流。因此,开展实验动物螺杆菌的监测与控制,是保证实验动物和动物实验质量的重要前提。
本研究分别应用PCR和ELISA方法对上海及周边地区实验小鼠和实验大鼠进行螺杆菌检测,并对各自的阳性检测率进行比较。旨在填补我国实验大鼠、小鼠螺杆菌流行病学资料调查空白,分析评估实验动物微生物学质量,进一步补充和完善实验动物质量控制体系,为我国实验动物等级及监测标准的制定提供参考和依据。
1 材料和方法
1.1 动物来源
所有检测的实验大鼠、小鼠来自上海、江苏、浙江地区不同实验动物生产单位,级别有清洁级和SPF级。
1.2 主要试剂
细菌基因组DNA提取试剂盒购自天根生化科技公司;PCR所用试剂:Taq酶、dNTP、PCR buffer,DNA Marker等购自宝生物工程(大连)有限公司;大鼠、小鼠螺杆菌抗体 I gG检测试剂盒(血清 E LISA试剂盒)购自美国EBI公司。
1.3 样品采集
无菌采取实验大鼠、小鼠的血液,分离血清,同时采集回盲部内容物。血清样品-20℃冻存;回盲部内容物-80℃冻存,备用。
1.4 大鼠、小鼠回盲部内容物中螺杆菌核酸检测——PCR法检测
1.4.1 提取回盲部内容物螺杆菌总DNA:取0.2 g回盲部内容物,悬浮于1 mL的PBS(pH 7.4)中制成细菌悬液,然后按照细菌基因组DNA提取试剂盒说明书严格操作。
1.4.2 引物:根据螺杆菌属特异性16SrRNA基因,合成1对引物[4]编号为:
P7:5'-CTATGACGGGTATCCGGC-3'
P8:5'-ATTCCACCTACCTCTCCCA-3'
引物由上海英骏生物技术有限公司合成。
1.4.3 反应体系:20μL体系内含2μL 10×PCR buffer,1.6μL dNTP(each 2.5 mmol/L),引物P7、P8(10 pmol/L)各1μL,0.3μL Taq DNA聚合酶(5 U/μL),3μL DNA模板,11.1μL灭菌双蒸水。
1.4.4 反应条件:扩增程序为95℃预变性5 min,95℃变性30 s,53℃退火30 s,72℃延伸30 s,共35个循环,最后72℃延伸10 min。PCR产物经浓度为1%的琼脂糖凝胶电泳鉴定。目的产物大小为374 bp。
1.4.5 PCR产物测序:随机抽取阳性PCR产物经凝胶电泳回收纯化后送至上海英骏生物有限公司测序。
1.5 大鼠、小鼠血清抗螺杆菌 IgG抗体检测(ELISA法)
具体操作和结果判定均严格按美国EBI公司试剂盒说明书操作。
2 结果
2.1 大鼠、小鼠回盲部内容物中螺杆菌抗原PCR扩增结果
共检测小鼠352只,其中清洁级101只,SPF级251只;共检测大鼠101只,其中清洁级69只,SPF级32只。其详细结果见表1。随机抽取阳性样本测序,结果登录NCBI中进行BLAST比对,与螺杆菌菌属16SrRNA序列的同源性均在98%~100%之间,部分样品PCR检测结果见图1。
2.2 大鼠、小鼠血清抗螺杆菌抗体ELISA检测结果
应用ELISA法共检测小鼠88只,其中清洁级26只,SPF级62只;共检测大鼠165只,其中清洁级84只,SPF级81只。其详细结果见表2。

表1 不同级别大鼠、小鼠粪便中螺杆菌抗原阳性率分析Tab.1 The positive rates of Helicobacter spp.antigen in the feces from different grade rats and mice
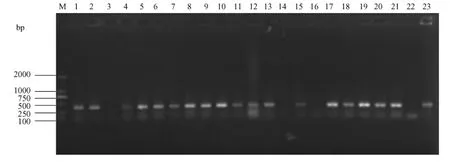
图1 部分样品PCR检测结果注:泳道1,2,4-13,15,17-21:被检阳性样品;泳道3,14,16:被检阴性样品;泳道22:阴性对照;泳道23:阳性对照;M:DNA分子量标准DL2000Fig.1 The Results of some samples detected by PCRNote:1,2,4-13,15,17-21.The clinical positive samples;3,14,16.The clinical negative samples; 22.Negative control;23.Positive control;M.DNA marker DL2000.
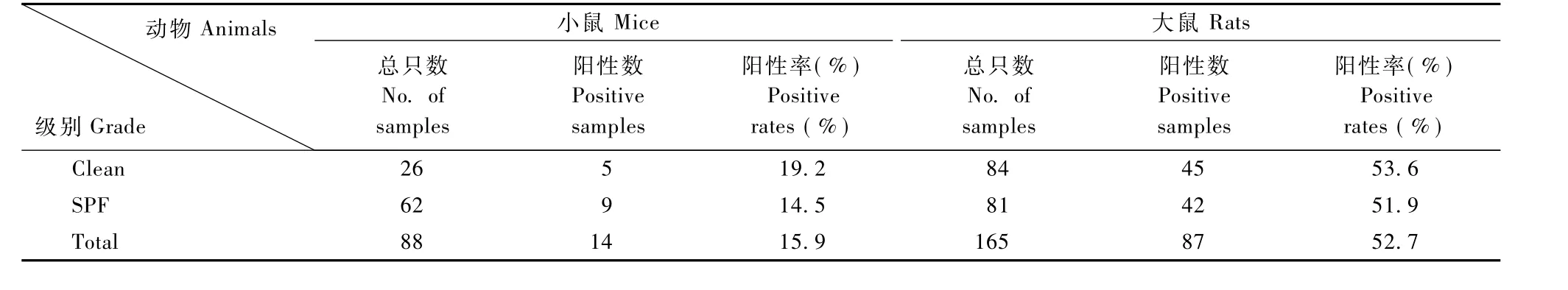
表2 不同级别大鼠、小鼠血清抗螺杆菌抗体阳性率分析Tab.2 The positive rates of serum Helicobacter spp. antibody in different grade rats and mice
2.3 大鼠、小鼠螺杆菌PCR和ELISA的阳性检测率比较
对88只小鼠,101只大鼠分别同时进行PCR和ELISA的检测,结果88只小鼠PCR阳性检测率为72.7%(64/88),ELISA阳性检测率为15.9%(14/ 88);101只大鼠PCR阳性检测率为70.3%(71/ 101),ELISA阳性检测率为49.5%(50/101)。
3 讨论
啮齿类螺杆菌是革兰氏阴性,螺杆状,微需氧菌,培养条件苛刻,该菌呈潜伏性感染。国外已有大量报道大鼠、小鼠种群感染螺杆菌的比例呈增长趋势[5],虽然螺杆菌感染可能会导致临床疾病,但由于螺杆菌所产生的病理现象是宿主依赖型的,在临床上很少被察觉,因此常发生实验人员不知道实验大鼠、小鼠已感染螺杆菌的情况。螺杆菌感染的影响不仅局限于胃肠系统,也可能对繁殖、胃肠器官及其它器官如乳腺的肿瘤发展、疫苗免疫应答以及其它方面产生影响。已有大量数据显示,大鼠和小鼠模型无意中感染螺杆菌将会对实验数据的可靠性产生潜在干扰。因此,研究机构应定期检查实验大鼠和小鼠是否感染螺杆菌并将这些病原体清除[5,6]。目前,实验室啮齿类螺杆菌检测方法主要是细菌学分离培养、组织病理学、生化鉴定或电镜观察早期螺杆菌感染情况、免疫学方法(如ELISA)检测感染后期的特异抗体以及分子生物学方法。传统的生化鉴定方法比较简单,但操作繁琐,检测周期一般为1~2周,即使应用商业化的快速鉴定试条也需要5~6 d。PCR方法和免疫学方法相对简单。
本研究通过检测大鼠和小鼠回盲部内容物中螺杆菌抗原和血清中抗螺杆菌抗体,对大鼠和小鼠中螺杆菌携带率进行了分析和评价。PCR方法检测结果显示,大鼠螺杆菌平均阳性率高于小鼠平均阳性率;小鼠中清洁级阳性率高于SPF级;大鼠中SPF级阳性率略高于清洁级。血清中抗螺杆菌抗体ELISA检测结果也显示,大鼠螺杆菌平均阳性率高于小鼠平均阳性率。清洁级大鼠和小鼠血清中抗螺杆菌抗体阳性率皆高于SPF级。国外有报道螺杆菌在实验小鼠上有较高的携带率,SPF级实验小鼠中肠肝科螺杆菌的检出率达到87.5%,并且动物之间交叉感染率达到100%[7]。此次我们调查结果显示上海及周边地区大鼠的螺杆菌携带率高于小鼠,可提示这些地区今后要进一步加大对大鼠螺杆菌的定时监测与饲养管理力度,同时也为我国实验动物螺杆菌等级标准的制定提供了一定参考和依据。
比较两种方法的阳性检出率结果可以看出PCR法的阳性检出率要高于ELISA法,这与国内外的研究均相符[8,9]。螺杆菌是经粪口途径传播,长期存在于动物肠道及粪便中,先天的体液及细胞介导的免疫反应不能清除螺杆菌感染[10]。但应注意到粪便和肠道中含有一些PCR反应的抑制物,提高模板DNA的纯度可直接影响PCR的敏感性。PCR检验是以检测病原基因为目标,属“病因”诊断,因而针对性强,对在体外难培养的螺杆菌,此方法特别有效,适合于进行螺杆菌流行病学调查。ELISA方法的特异性和敏感性较好,血清学方法具有无创伤和重复性好的优点,但由于抗体的持续存在和产生时间,使血清学存在一定的假阳性和假阴性。在本次研究中就发现PCR法检测均阴性的30只大鼠和24只小鼠中ELISA法分别检出了15只阳性大鼠和2只阳性小鼠,ELISA法检测均阴性的51只大鼠和74只小鼠中PCR法分别检出了36只阳性大鼠和52只阳性小鼠。国外的相关研究也都表明血清学不太适合啮齿类螺杆菌根除判断,可用作螺杆菌感染后期的初筛,PCR法可用于大鼠和小鼠感染螺杆菌最终诊断结果的判定。目前,PCR方法是最快最敏感的检测螺杆菌的方法[9]。
综上所述,不同检测方法的调查结果皆表明,上海及周边地区大鼠螺杆菌的携带率高于小鼠,大鼠和小鼠中存在着不同程度的螺杆菌感染,这也与张丽芳、Goto等人的文献报道相符[7,11,12]。两种方法阳性检出率比较结果表明回盲部内容物PCR法较血清抗螺杆菌抗体ELISA检测法更为敏感。因此,应用PCR检测大鼠和小鼠中螺杆菌DNA是可行的,且具有较高的特异性。本次研究也表明,在加强PCR引物、试剂和操作的标准化前提下,PCR检测方法可以用于大鼠和小鼠螺杆菌的初步调查和流行病学监测,从而为我国实验动物螺杆菌的感染状况提供有用的流行病学数据,这也有助于实验动物种群中螺杆菌隐性感染的及时监测,从而进一步降低或减少对实验数据的潜在干扰。
[1]Ceelen LM,Haesebrouck F,Ducatelle R,et al.The occurrence and clinical significance of enterohepatic Helicobacter species in laboratory rodents[J].Vlaams Diergeneeskundig Tijdschrift,2007,76:103-116.
[2]Whary MT,Fox JG.Natural and experimental Helicobacter infections[J].Comp Med,2004,54:128-158.
[3]Nancy ST, Xu SL, Nambiar P, et al.Entherohepatic Helicobacter species are prevalent in mice from commercial and academic institutions in Asia,Europe,and North Amercia[J].J Clin Microbiol,2007,45(7):2166-2172.
[4]Lela KR,Craig LF,Reuel RH,et al.Identification of murine Helicobacter by PCR and restriction enzyme analyses[J].JClin Microbiol,1996,34:942-946.
[5]Chichlowski M,Hale LP.Effects of Helicobacter Infection on research:The case for eradication of Helicobacter from rodent research colonies[J].Comp Med,2009,59(1):10-17.
[6]Sharp JM,Vanderford DA,Chichlowski M,et al.Helicobacter infection decreases reproductive performance of IL10-deficient mice[J].Comp Med,2008,58(5):447-453.
[7]Goto K,Ohashi H,Takakura A,et al.Current status of Helicobacter contamination of laboratory mice,rats,gerbils,and house musk shrews in Janpan[J].Current Microbiol,2000,41 (3):161-166.
[8]张丽芳,刘星,李红.啮齿类螺杆菌不同检测方法的比较[J].中国比较医学杂志,2008,18(5):62-65.
[9]Shames B,Fox JG,Dewhirst F,et al.Identification ofwidespread Helicobacter hepaticus infection in feces in commercial mouse colonies by culture and PCR assay[J].JClin Microbiol,1995,33:2968-2972.
[10]Whary MT,Fox JG.Detection,eradication,and research implications of Helicobacter infectins in laboratory rodents[J].Lab Animal,2006,35(7):25-27.
[11]张丽芳,李红.从实验小鼠成功分离一株啮齿类螺杆菌─胆汁螺杆菌[J].中国实验动物学报,2005,13(2):75.
[12]Zenner L.Pathology,diagnosis and epidemiology of the rodent Helicobacter infection[J].Comp Immunol Microbiol Infect Dis,1999,22:41-61.

