采用微渗透泵测定清醒大鼠肾小球滤过率
王静波,王海涛,汪照寒
(1.沈阳市第六人民医院肝硬化病房,沈阳 110006;2.沈阳医学院附属沈洲医院普外科,沈阳 110001; 3.中国医科大学附属第一医院传染科,沈阳 110005)
血液流经肾小球滤过膜后形成超滤液,即开始了尿液的生成,超滤液形成比率即肾小球滤过率(GFR),是评估肾脏功能、判断肾脏疾病进程的重要参考指标之一。没有生物学活性、能够自由通过肾小球滤过屏障、在肾小管既不被重吸收也不被再分泌的物质,是测定GFR的理想标记物。很多种物质被用于测定GFR,如内源性物质——肌酐和胱抑素 C[1,2],还有外源性物质——菊粉、荧光标记的EDTA和左旋糖等等[3,4],其中菊粉清除率被认为是评价肾脏功能的金指标。GFR测定主要有两种方法:①测定标记物的尿排泄率[1,5];②标记物单剂负荷量注入静脉后,根据其血液动力学变化测定清除率[6]。
在过去的十几年中,随着遗传学和分子生物学的发展,通过整合啮齿类动物基因组序列构建疾病模型,使多种疾病的研究不断深入[7,8]。然而,由于缺少简单易行的GFR测定方法,使得肾脏疾病的研究相对滞后。由于啮齿类动物血容量有限、血中含有高浓度内源性非肌酐类似物,不宜用肌酐清除率测定 GFR[7,9]。本研究中,我们用荧光素异硫氰酸酯(FITC)标记菊粉(FITC-菊粉)作为标记物,通过微渗透泵技术,在大鼠清醒状态下通过测定FITC-菊粉尿排泄率计算GFR。
1 材料和方法
1.1 材料
雄性SD大鼠(体重200±20 g,购自中国人民解放军军事医学科学院实验动物中心,动物合格证号:SCXK-2007-0040),FITC-菊粉(Sigma公司,美国),微渗透泵 (Alzet,model 2001),代 谢 笼(Columbus Instrument,美国),透析袋(联合碳化公司)。
1.2 FITC-菊粉溶液的准备
FITC-菊粉(24%)在沸水中溶解于生理盐水,吸入MWCO 1,000透析袋中,在1 000 mL生理盐水中室温过滤24 h。为避光盛透析液的烧杯外包铝箔纸。由于水分自由扩散作用,透析液扩散至透析袋内,使袋内FITC-菊粉溶液浓度由24%降至8%。吸出透析袋内FITC-菊粉溶液,用0.22μm针头式过滤器过滤灭菌。
1.3 微渗透泵的植入
将稀释后终浓度为8%的FITC-菊粉溶液注入泵内,并于生理盐水中浸泡4~6 h。大鼠麻醉后(0.8%戊巴比妥钠,40 mg/kg,腹腔注射)置于暖床上,腹部剃毛,碘伏消毒。沿腹中线在肋窝下剪开一个0.5 cm的切口,把2个装有上述FITC-菊粉溶液的微渗透泵分别置于腹腔左右两侧,逐层缝合切口,分笼饲养,每天查看术后大鼠状态并称量体重。
1.4 血液和尿液的收集
植泵后第7天将大鼠随机分成2组(每组10只),其中一组先收集 24 h尿液,用 500 mmol/L HEPES液洗刷代谢笼2次,收集残留在代谢笼上的FITC-菊粉。24 h尿液标本收集结束时,采用 Hem等[10]介绍的方法通过隐静脉采集血液标本。将大鼠放入顶端带有通气口的100 m L玻璃管中,两条后腿露在管外,股内侧刮毛,碘伏消毒,隐静脉采血大约1.5 mL,离心后(4 000 r/min,10 min)收集血清。另外一组不收集尿液仅采集血液标本。装标本的试管注意外包铝箔纸避光。
1.5 血清和尿液标本FITC荧光量的测定
为避免pH值对FITC荧光值测定的影响,所有血液和尿液标本均用pH 7.4的500 mmol/L HEPES缓冲液调定 pH值。一般在400μL尿液或血清中加入100μL HEPES缓冲液,混合液的 pH值仍为7.4。然后将500μL上述混合液吸入杯中,荧光分光光度计测定FITC荧光值,激发波长485 nm,发射波长538 nm。
1.6 FITC荧光值与菊粉浓度相关性的检测
通过检测已知浓度的 FITC-菊粉溶液的 FITC荧光值来确定两者的相关性。对于尿液标本,标准曲线浓度为(0~120)μg/m L,400μL尿液标本中加入上述范围内不同浓度的 FITC-菊粉溶液100μL,用pH 7.4的500 mmol/L HEPES缓冲液调定pH值至7.4。对于血液标本,标准曲线浓度为(0~300) μg/m L,400μL血清中加入上述范围内不同浓度的FITC-菊粉溶液 1 00μL,用 p H 7.4的 5 00 mmol/L HEPES缓冲液调定pH值至7.4。采用线性回归分析,相关系数分别为0.99、0.98,确定尿液和血液中FITC荧光值与菊粉浓度之间密切相关。
1.7 FITC-菊粉溶液稳定性的检测
通过测定滤过液中FITC荧光值来验证溶液中FITC-菊粉结合的稳定性。将过滤后的 F ITC-菊粉溶液室温下继续滤过7 d,分别在第1、3、5、7天测定过滤液中FITC荧光值,计算该值占过滤液中总FITC荧光值的比例,分别为0.89%、0.91%、1.18%和1.43%。第1天和第7天无明显不同,所以植泵7 d时间里FITC与菊粉结合稳定。
1.8 计算GFR
参照文献[6,11],用两种方法计算GFR:①需要收集24h尿量,GFR1=UFITC-inulin·V/PFITC-Inulin(UFITC-Inulin为尿液中 F ITC荧光值,V为 2 4 h尿量,PFITC-Inulin为血清中 F ITC荧光值);②无需收集 2 4 h尿量,GFR2=R/[Iss](R为FITC-菊粉溶液泵入速率,[Iss]为血清FITC-Inulin浓度)。GFR计量单位为mL/min,体重校正后为m L/min·kg(大鼠体重),双肾重量校正后为m L/min·g(大鼠双肾重量)。
1.9 统计学分析
2 结果
2.1 微渗透泵植入腹腔后第1天大鼠体重明显下降,第3天体重开始增加,第4天恢复至植泵前,第7天体重平均增加(9.5±1.3)g。
2.2 植泵后第7天,采用收集24 h尿量方法计算GFR为2.31±0.33 mL/min;采用无需收集尿量方法计算GFR为2.53±0.33 m L/min(表1),两者之间差异无统计学意义(图1A)。分别用大鼠体重和双肾重量校正后,两种方法计算出的GFR之间无统计学意义(表1,图1B~1C)。
3 讨论
肾小球滤过率(GFR)是评估肾脏功能的主要参考指标之一。菊粉清除率被认为是测定GFR的金标准,因为菊粉能够自由通过肾小球滤过膜,在肾小管内既不被重吸收也不被分泌。用FITC标记后可以检测出血中微量菊粉,提高检测灵敏度。之前有学者应用FITC-菊粉在麻醉状态下成功测定大鼠GFR[12,13]。检测GFR主要有两种方法:(1)负荷剂量菊粉一次性注入后利用FITC-菊粉血浆清除动力学,测定菊粉清除率。这种方法的优点是不需要收集24 h尿量,也不需要手术。(2)测定FITC-菊粉尿排泄率,是本研究采用的方法。在大鼠腹腔内植入微渗透泵(Alzet微渗透泵是一次性使用囊性无菌微渗透泵,容积为(200±8)μL,恒定泵入速率1 μL/h,使用时间7 d),将FITC-菊粉溶液持续匀速泵入腹腔,通过腹膜吸收入血,菊粉在体内逐渐蓄积,当入血速率与尿液排泄速率达到平衡时,即植泵后第7天,血液中FITC-菊粉浓度达到稳态,此时测定血清中FITC荧光量计算GFR。本研究采用两种方法计算GFR:(1)用FITC-菊粉溶液的泵入速率除以稳态时血清中菊粉浓度,此方法不需要收集24 h尿量;(2)用尿液中菊粉浓度除以血清中菊粉浓度,再乘以24 h尿量,此方法需要收集24 h尿量。通过分析发现此两种方法计算出来的GFR数值相近。
表1 大鼠GFR数值(±s,n=10)Tab.1 GFR values of the rats(±s,n=10)

表1 大鼠GFR数值(±s,n=10)Tab.1 GFR values of the rats(±s,n=10)
UFITC-Inu lin,尿液中FITC荧光值;V,24 h尿量;PFITC-Inu lin,血清中FITC荧光值;R,FITC-菊粉溶液泵入速率;[Iss],稳态后血清中FITC荧光值;BW,大鼠体重(kg);KW,大鼠双肾重(g);P值定义为0.05
肾小球滤过率1 GFR1 (UFITC-Inu lin·V/PFITC-Inu lin)肾小球滤过2 GFR2 (R/[Iss]) P值P value GFR1 vs GFR2肾小球滤过率GFR(m L/min)2.31±0.33 2.53±0.33 0.207 GFR,m L/min·kg大鼠体重 11.13±1.53 11.66±1.32 0.462 GFR,mL/min·g大鼠双肾体重1.23±0.11 1.29±0.12 0.146
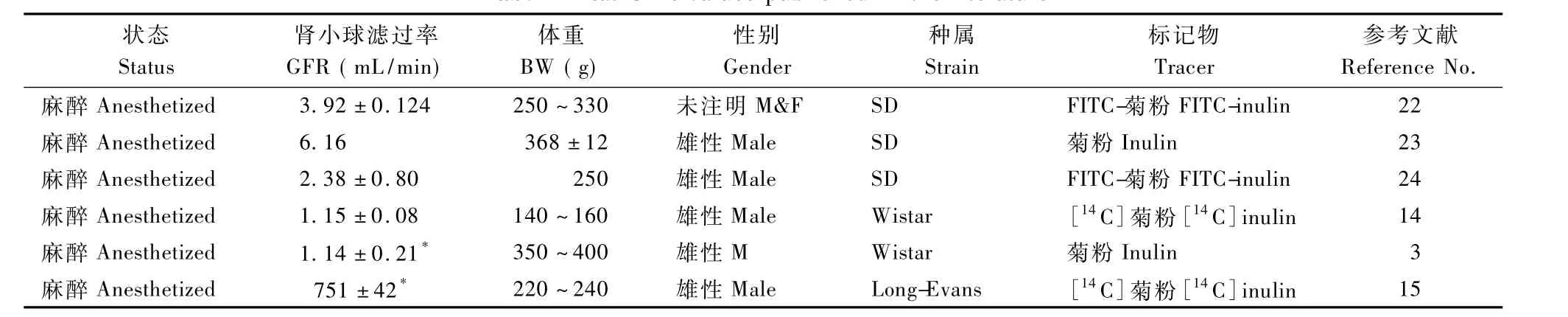
表2 已发表文献中大鼠GFR数值Tab.2 Rat GFR values published in the literature
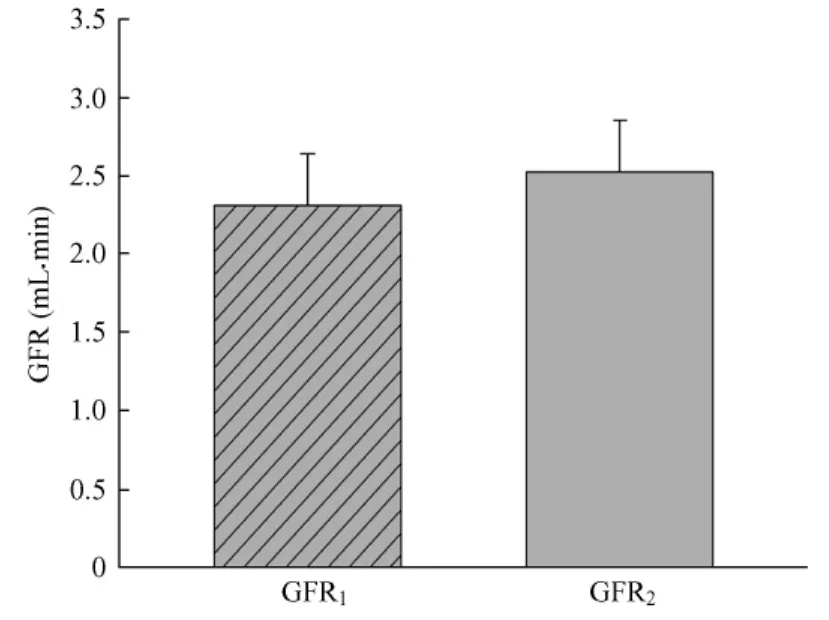
图1A 采用微渗透泵通过两种方法测定清醒大鼠GFR(mL/min) GFR1采用搜集24 h尿量方法测定的GFR,GFR2采用无需搜集24 h尿量方法测定的GFR,两者之间差异无统计学意义(P出=0.098).Fig.1A GFR in the conscious rats determined by twomethods using micro-osmotic pumping(mL/min).GFR1 determined by collecting 24-hour urine;GFR2 determined without collecting 24-hour urine,P>0.05,there was statistically no significant difference between the GFR values obtained by two methods.
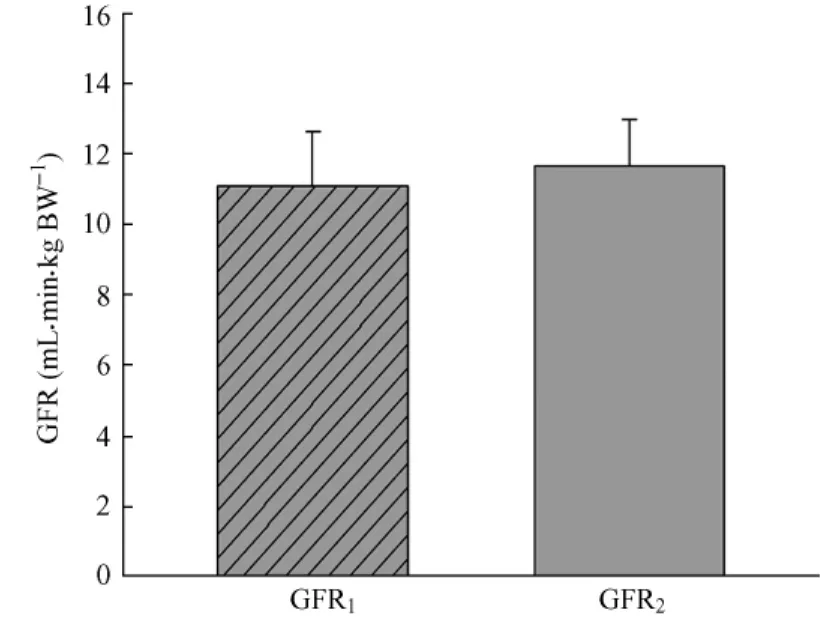
图1B 采用微渗透泵通过两种方法测定清醒大鼠GFR(m L/min·kg体重) GFR1采用搜集24 h尿量方法测定的GFR,GFR2采用无需搜集24 h尿量方法测定的GFR,两者之间差异无统计学意义(P=0.115).BW,大鼠体重(kg).Fig.1B GFR in the conscious rats determined by two methods using m icro-osmotic pumping(m L/min·kgBW).GFR1:determined by collecting 24 hour urine;GFR2:determined without collecting24-hour urine.BW:body weight.P>0.05,there was statistically no significant difference between the GFR values obtained by twomethods.
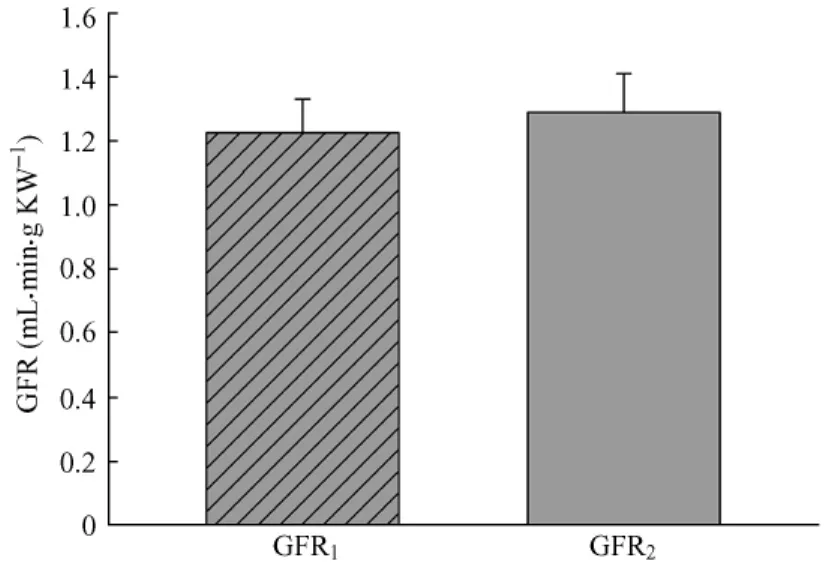
图1C 采用微渗透泵通过两种方法测定清醒大鼠GFR(m L/min·g大鼠双肾重量) GFR1采用搜集24 h尿量方法测定的GFR,GFR2采用无需搜集24 h尿量方法测定的GFR,两者之间差异无统计学意义(P =0.121).KW,大鼠双肾重量 ( g).Fig.1 CGFR in the conscious rats determined by two methods using micro-osmoticpumping(m l·min·g KW-1) GFR1:determined by collecting 24-hour urine;GFR2:determ ined without collecting 24-hour urine.KW:kidney weight.P>0.05,there was statistically no significant difference between the GFR values obtained by twomethods.
关于大鼠GFR测定的研究很少,尤其是清醒状态下测定GFR。从已发表的文献中发现大鼠GFR变化范围很大(表2),主要与以下因素相关:(1)性别[16,17],(2)种属[18],这是由于性别、种属不同体重及肾脏的大小亦不同,GFR通过体重、肾脏重量校对后,该差异可被纠正;(3)麻醉[19,20],GFR是一个动力学参数,可以随生理因素的变化而改变,其中最主要的是肾血流量减少引起的肾小球血流动力学改变,据Bouby[21]等报道清醒状态下的GFR仅仅是麻醉状态下的60%左右。本研究大鼠在清醒状态下泵入菊粉溶液,并且在清醒状态下收集血液及尿液标本,除外麻醉对GFR的影响。我们测得的GFR数值为2.31mL/min、体重校正后为11.13 m L/min· kg体重,低于报道的SD大鼠GFR均值3.24mL/m in和12.81 m L/min·kg体重,大约降低了30%~40%,与Bouby等[21]的报道相符。考虑与采集标本时大鼠处于清醒状态而非麻醉状态有关,证明了麻醉对GFR有较明显的影响。
总之,用FITC标记菊粉采用微渗透泵技术,测定清醒状态下大鼠GFR,当菊粉浓度在血中达到稳态时,采用无需收集24 h尿量和需要收集尿量两种方法计算出来的GFR相近;在去除麻醉影响后,GFR数值与已发表的结果无明显不同。本研究表明采用微渗透泵技术,用FITC-菊粉作为标记物,可以比较准确地测定清醒状态下大鼠GFR,尤其是无需收集尿液的方法,实验更简化,易于操作。
致谢感谢刘沛教授对本研究的指导。感谢中国医科大学中心实验室李春艳老师在荧光分光光度计使用方面的指导。感谢中国医科大学实验动物中心杨晨老师在动物实验方面的指导。还要感谢本科室同志们对我科研工作的大力支持。
[1]Eisner C,Faulhaber-Walter R,Wang Y,et al.Major contribution of tubular secretion to creatinine clearance in mice[J].Kidney Int,2010,77(6):519-526.
[2]Sharawey MA,Shawky EM,Ali LH,et al.Cystatin C:a predictor of hepatorenal syndrome in patients with liver cirrhosis[J].Hepatol Int.2011,Mar 12.[Epub ahead of print].
[3]Fischer PA,Bogoliuk CB,Ramirez AJ,et al.A new procedure for evaluation of renal function without urine collection in rat[J].Kidney Int.2000,58:1336-1341.
[4]Schock-Kusch D,Xie Q,Shulhevich Y,et al.Transcutaneous assessment of renal function in conscious rats with a device for measuring FITC-sinistrin disappearance curves[J].Kidney Int.2011 Mar 2.[Epub ahead of print].
[5]Schock-Kusch D,Sadick M,Henninger N,etal.Transcutaneous measurement of glomerular filtration rate using FITC-sinistrin in rats[J].Nephrol Dial Transplant.2009,24 (10):2997-3001.
[6]Sturgeon C,Sam AD,Law WR.Rapid determination of glomerular filtration rate by single-bolus inulin:a comparison of estimation analyses.JAppl Physiol.1998,84:2154-2162.
[7]Meneton P,Ichikawa I,Inagami T,et al.Renal physiology of the mouse[J].Am JPhysiol Renal Physiol.2000,278:339-351.
[8]Li XC,Cook JL,et al.Intrarenal transfer of an intracellular cyan fluorescent fusion of angiotensin II selectively in proximal tubules increases blood pressure in rats and mice[J].Am J Physiol Renal Physiol.2011,Feb 9.[Epub ahead of print]
[9]Stridh S,Sällström J,Fridén M,et al.C-peptide normalizes glomerular filtration rate in hyperfiltrating conscious diabetic rats[J].Adv Exp Med Biol,2009,645:219-225.
[10]Hem A,Smith AJ,Solberg P.Saphenous vein puncture for blood sampling of the mouse,rat,hamster,gerbil,guinea pig,ferret and mink[J].Lab Anim.1998,32:364-368.
[11]Qi Z,Breyer MD.Measurement of glomerular filtration rate in consciousmice[J].Methods Mol Biol,2009;466:61-72.
[12]Brooks HL,Sorensen AM,Terris J,et al.Profiling of renal tubule Na+transporter abundances in NHE3 and NCC nullmice using targeted proteomics[J].JPhysiol.2001,530:359-366.
[13]Milia AF,Gross V,Plehm R,et al.Normal blood pressure and renal function in mice lacking the bradykinin B2receptor[J].Hypertension.2001,37:1473-1479.
[14]Jobin J,Bonjour JP.Measurement of glomerular filtration rate in conscious unrestrained rats with inulin infused by imp lanted osmotic pumps[J].Am JPhysiol.1985,248:734-738
[15]Shirley DG,Walter SJ,Zewde T.Measurement of renal function in unrestrained conscious rats[J].J Physiol.1989,408:67 -76.
[16]Gold farb DA,Matin SF,Braun WE,et al.Renal outcome 25 years after donor nephrectomy[J].J Urol.2001,166:2043 -2047.
[17]Noonan WT,Banks RO.Renal function and glucose transport in male and femalemice with diet-induced type II diabetesmellitus[J].Proc Soc Exp Biol Med.2000,225:221-230.
[18]Laouari D,Burtin M,Phelep A,et al.TGF-alpha mediates genetic susceptibility to chronic kidney disease[J].J Am Soc Nephrol.2011,22(2):327-335.
[19]López-Lago MA,Thodima VJ,Guttapalli A,et al.Genomic deregulation duringmetastasis of renal cell carcinoma imp lements a myofibroblast-like program of gene expression[J].Cancer Res.2010,70(23):9682-9692.
[20]Han X,Chesney RW.Stress-responsive gene TauT and acute kidney injury[J].JBiomed Sci,2010,24;17 Suppl 1:S28.
[21]Bouby N,Ahloulay M,Nsegbe E,et al.Vasopressin increases glomerular filtration rate in conscious rats through its antidiuretic action[J].JAm Soc Nephrol.1996,7:842-851.
[22]Sohtell M,Karlmark B,Ulfendahl H.FITC-inulin as a kidney tubule marker in the rat[J].Acta Physiol Scand.1983,119:313-316.
[23]Cord S,A lbert D,W illiam R.Rapid determination of glomerular filtration rate by single-bolus inulin:a comparison of estimation analyses.JAppl Physiol.1998;84:2154-2162.
[24]Yu WM,Sandoval RM,Molitoris BA.Rapid determination of renal filtration using an optical ratiometric imaging approach[J].Am JPhysiol Renal Physiol.2007,292:1873-1880.

