营养不良性肺水肿大鼠肺泡液体清除机制的研究
李乃静,李 伟,谷 秀,李胜岐,何 平
(1.中国医科大学附属盛京医院老年病科,3呼吸科,辽宁,沈阳 110004; 2.沈阳药科大学药物分析教研室,辽宁,沈阳 110016)
肺泡上皮具有阻止液体进入肺泡腔内和主动清除肺泡腔内液体的作用,是抵抗肺水肿形成的一道重要屏障。临床上多种消耗性疾病可以造成肺损伤,引起肺泡上皮屏障的破坏,通透性增加,出现肺水肿[1,2]。但有关在营养不良病理状态下肺泡上皮屏障结构和功能的变化尚缺乏深入的研究。本实验探讨营养不良对肺泡上皮屏障结构和功能的影响,并观察钠通道阻断剂、Na+-K+-ATP酶阻断剂及β受体激动剂对营养不良性肺水肿大鼠肺泡液体清除功能的影响,旨在为早期治疗营养不良性肺水肿提供新的思路。
1 材料和方法
1.1 实验材料
动物:雄性Wistar大鼠(体重300~330 g,由中国医科大学附属盛京医院实验动物中心提供,合格证号:SYXK(辽)2003-0019)。药物:β2肾上腺素能受体激动剂特布他林、钠通道阻断剂氨氯吡咪、Na-K-ATP酶阻断剂哇巴因购于美国Sigma公司。
1.2 营养不良大鼠动物模型的制备[3]
大鼠自由摄取水,但禁食。正常对照组大鼠自由摄取水和食物。
1.3 分组及方法
将动物随机分组,每组动物10只,共12组。
1.3.1 营养不良对大鼠肺泡液体清除率(alveolar fluid clearance,AFC)的影响:分别测定禁食48 h、120 h大鼠及正常对照组大鼠总肺水量(lung water content,TLW)、肺血管外水量(extravascular lung water,EVLW)和肺泡液体清除率,并取部分肺组织浸入4%多聚甲醛固定,石蜡包埋,连续切片,HE染色,普通光镜观察肺组织形态。
1.3.2 钠通道阻断剂氨氯吡咪的作用:将5×10-4mol/L氨氯吡咪加入5%白蛋白等渗生理盐水溶液5 m L/kg灌注到禁食120 h大鼠(A1组)及正常大鼠(A2组)气管内,测定AFC。
1.3.3 Na-K-ATP酶阻断剂哇巴因的作用:5× 10-4mol/L哇巴因加入5%白蛋白等渗生理盐水溶液5 m L/kg灌注到禁食120 h大鼠(B1组)及正常大鼠(B2组)气管内,测定AFC。
1.3.4 氨氯吡咪和哇巴因的联合作用:将5×10-4mol/L氨氯吡咪和5×10-4mol/L哇巴因加入5%白蛋白等渗生理盐水溶液5 m L/kg灌注到禁食120 h大鼠(C1组)及正常大鼠(C2组)气管内,测定AFC。
1.3.5 β2肾上腺素能受体激动剂特布他林的作用:将10-5mol/L特布他林加入5%白蛋白等渗生理盐水溶液5 m L/kg灌注到禁食120 h大鼠(D1组)及正常大鼠(D2组)气管内,测定AFC。
1.3.6 进食后营养不良大鼠AFC的变化:营养不良大鼠禁食120 h后自由摄取水和食物,72 h测定AFC(E组)。
1.4 指标测定
1.4.1 AFC的测定:将大鼠用10.0%水合氯醛0.03 m L/10g体重的计量进行腹腔麻醉,气管切开后进行气管插管。腹主动脉放血处死大鼠,将气管、肺脏、心脏全部取出。用保鲜膜包被后放入37℃水浴箱中孵育。通过气管导管将Evans蓝标记(0.15 mg/mL)标记的5%白蛋白等渗生理盐水溶液以5 m L/kg体重灌入大鼠气管内。并给予4 mL的氮气以确保灌注液到达肺脏。并且持续给予10%的氧气,使气道内保持7 cm H2O的气道压力,孵育1 h后通过分光光度仪,在波长620 nm处测定Evans蓝标记的白蛋白浓度。AFC计算公式如下[3]:AFC(%)=(Vi Vf)/Vi×100,Vf=Vi×Pi/ Pf,式中Vi和Vf分别代表起始和最终肺泡液体总量,i表示灌注前,f表示孵育1h后吸出的肺泡灌洗液体积。P是Evans蓝标记的白蛋白浓度。
1.4.2 肺组织含水量测定:TLW和EVLW的测定采用Noble法并加以改动[4],公式如下:
TLW=(肺湿重-肺干重)/肺干重
每克湿肺含残血量=(匀浆液Hb÷血液Hb) ×匀浆总样本量×1.055/匀浆肺质量
湿肺含残血量=肺湿重×每克湿肺含残血量EVLW=(肺湿重-肺干重-湿肺含残血量)/肺干重
1.5 统计学方法
2 结果
2.1 病理表现
正常对照组及禁食大鼠病理表现及TLW及AFC基础值:正常对照组大鼠的肺泡腔基本干燥,肺间质无水肿,肺泡周围血管无扩张、充血(图1);禁食48 h大鼠可见到肺泡周围血管扩张、淤血(图2)。禁食120 h大鼠可见到肺间质增宽、淤血,出现肺水肿(图3)(图1~3见封三)。
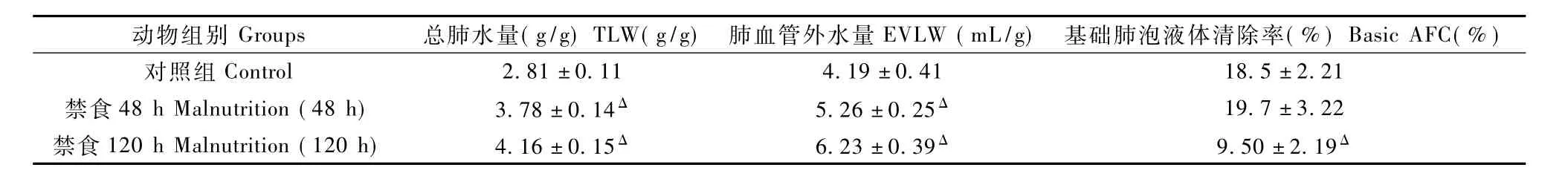
表1 营养不良对大鼠TLW、ELVW及AFC的作用(x±s,n=10)Tab.1 Effects ofmalnutrition on TLW,EVLW and AFC in the rats(x±s,n=10)
2.2 营养不良对TLW、EVLW及AFC的作用
见表1。TLW及EVLW均随着大鼠禁食时间的延长而增加,禁食48 h、120 h大鼠TLW及EVLW与对照组比较差异有显著性。但是禁食48 h内大鼠AFC与对照组比较差异无显著性。
2.3 药物对AFC的作用
药物对禁食120 h大鼠的作用结果分别为:A1组(6.02±1.56)%;B1组(6.84±2.44)%;C1组(4.34±2.30)%;D1组:(24.3±3.82)%;A1、B1组AFC与禁食120 h大鼠基础AFC比较明显降低(P均<0.05),C1组AFC与禁食120 h大鼠基础AFC比较明显降低(P<0.01),D1组AFC与禁食120 h大鼠基础AFC比较明显增加(P<0.05)。药物对正常对照组大鼠AFC的作用结果分别为:A2组(7.59±2.78)%;B2组(10.7±1.57)%;C2组(6.04±3.19)%;D2组(25.8±2.08)%,A2、B2组AFC与正常对照组大鼠基础AFC比较明显降低(P均<0.05),C2组与正常对照组大鼠基础AFC比较明显降低(P<0.01),D2组AFC与正常对照组大鼠基础AFC比较明显增加(P<0.05);D1组AFC与D2组AFC比较差异没有显著性(P>0.05),说明特布他林对正常对照组大鼠及禁食120 h大鼠AFC的作用差异无显著性。E组AFC结果为:12.9%±2.07%,与营养不良120 h大鼠基础AFC比较明显升高(P<0.05),是正常对照组大鼠基础AFC的70%。
3 讨论
伴随着肺泡上皮离子转运功能和水通道的发现,对肺水肿和肺损伤的发生机制有了更深刻的理解。即液体通过肺泡上皮屏障的运动并不完全依赖静力的被动变化和肺毛细血管的渗透性,肺泡上皮所具有的主动转运功能对于保持肺泡干燥和进行有效的气体交换起着至关重要的作用[5,6]。临床上许多危重症患者存在营养不良,严重者可以发生肺水肿。而有关营养不良导致肺损伤和肺水肿的具体机制尚缺乏深入了解。本实验结果表明营养不良亦可以导致肺损伤的发生。大鼠禁食48 h即出现肺泡周围血管扩张、淤血等肺损伤的表现,总肺水量和肺血管外水量增加。且随着营养不良时间的延长肺脏损伤程度越来越重,到120 h出现间质性肺水肿,总肺水量和肺血管外水量进一步增加。该实验表明营养不良大鼠在肺组织含水量明显增加的情况下肺泡液体清除率依然可以维持正常。一般如果EVLW能够保持在5~6 g/g以下,则肺泡上皮细胞液体清除功能可以维持在正常水平[7]。
以钠通道阻断剂氨氯吡咪和Na-K-ATP酶阻断剂哇巴因能够降低正常大鼠及营养不良大鼠肺泡液体清除率,说明肺泡上皮细胞不仅参与生理情况下钠水的调节亦参与肺损伤后钠水的转运,清除肺泡腔内过多液体,避免水肿液的聚集。肺泡上皮细胞的这一功能主要是通过钠主动转运来实现的,钠的主动转运由钠通道和Na+-K+-ATP酶共同完成,即由上皮细胞的钠通道摄取Na+,然后经由基底膜上的Na+-K+-ATP酶将Na+泵至肺间质同时伴随水的吸收,以保持肺泡腔相对干燥的环境和进行有效的气体交换[8,9]。在氨氯吡咪的作用下,禁食120 h大鼠和正常大鼠肺泡液体清除率分别下降了31%和59%,在哇巴因的作用下,营养不良大鼠和正常大鼠肺泡液体清除率分别下降了28%和42%。说明禁食120 h大鼠肺泡液体清除率的降低与在营养不良状态下钠通道和Na+-K+-ATP酶的活性部分被抑制有关。
本实验结果表明营养不良大鼠重新进食后72 h,肺泡液体清除率恢复了70%,说明禁食120 h并未造成大鼠肺泡液体清除功能不可逆的损伤。肺损伤后的肺泡上皮液体清除能力与损伤程度有关,肺损伤后,最早出现的是内皮细胞的损伤,导致血管周围液体的集聚,出现间质性肺水肿。说明与内皮细胞相比,肺泡上皮细胞有着更强的抗损伤能力[10]。只要肺泡上皮屏障未受到破坏肺泡液体清除能力可以维持正常。但如果肺泡上皮紧密连接损伤后细胞旁的通透性增加,则肺泡液体清除能力减退。肺泡上皮屏障功能可以作为判定肺损伤后,肺水肿恢复程度的一个指标。即使肺脏受到损伤,只要肺泡上皮屏障未受到破坏,肺泡液体清除率正常肺泡上皮一定能够完成钠、水的转运,清除肺内过多的液体。一般能在损伤12 h内吸收一些水肿液的患者恢复快,死亡率低。相反,则恢复慢,死亡率高[11]。营养不良大鼠肺泡上皮细胞对β2肾上腺素能受体激动剂特布他林的反应与对照组比较差异无显著性,说明在轻、中度肺损伤时,肺泡上皮细胞β2肾上腺素能受体并没有遭到破坏。同时也说明,特布他林能够通过调节肺泡上皮液体转运功能,加速肺水肿液的吸收。肺泡上皮在轻、中度损伤的情况下仍对钠水具有主动转运功能,为临床上通过调节钠水转运治疗肺水肿奠定了理论基础。轻、中度肺损伤时,肺泡上皮细胞对特布他林的反应仍然是正常的,进一步说明肺泡上皮细胞依然保持正常的功能。这为临床早期治疗肺水肿或急性肺损伤提供了理论依据。
本实验结果表明营养不良可以导致肺水肿的发生,其机制与钠通道和Na+-K+-ATP酶的活性部分被抑制有关。提示我们在救治营养不良肺水肿患者时应争取在肺泡上皮屏障未受到完全破坏之前积极补充营养,并使用β2肾上腺素能受体激动剂特布他林等药物改善肺泡液体清除功能,以免贻误病情,危及患者生命。attenuates pulmonary edema in rats exposed to 100%oxygen[J].JAppl Physiol.2000,89:1759-1765.
[2]Berger G,Guetta J,Klorin G,et al.Sepsis impairs alveolar epithelial function by downregulating Na-K-ATPase pump[J].Am JPhysiol Lung Cell Mol Physiol.2011,301:L23-L30.
[3]Sakuma T,Zhao YZ,Sugita M,et al.Malnutrition impairs alveolar fluid clearance in rat lungs[J].Am JPhysiol Lung Cell Mol Physiol,2004,286:L1268-L 1274.
[4]谷秀,李胜岐,佐久间勉.β肾上腺素能受体激动剂对离体大鼠肺泡液体清除率的作用[J].中华结核和呼吸杂志,2005,28(6):390-393.
[5]Dada lA,Sznajder JI.Mechanisms of pulmonary edema clearance during acute hypoxemic respiratory failure:role of the Na,K-ATPase[J].Crit Care Med,2003,6:S248-252.
[6]Berger MM,Pitzer B,Zugel S,et al.Alveolar but not intravenous S-Ketamine inhibits alveolar sodium transport and lung fluid clearance in rats[J].Anesth Analg,2010,111:164 -170.
[7]Berthiaume Y,Hans G,Folkesson M,et al.Lung edema clearance:20 years of progress[J].JAppl Physiol,2002,93:2207-2213.
[8]Saldias F,Comellas AP,Pesce L,et al.Dopamine increases lung liquid clearance during mechanical ventilation[J].Am J Physiol Lung Cell Mol Physiol,2002,283:L 136-L143.
[9]Li NJ,LiW,He P,et al.Effect of beta3-adrenergic agonists on alveolar fluid clearance in hypoxic rat lungs[J].Chin Med J,2010,123:1028-1033.
[10]Crapo J,Barry BD,Foscue HA,et al.Structural and biochemical changes occurring during exposure to lethal and adaptive doses of oxygen[J].Am Rev Respir Dis,1990,122:L23-43.
[11]Brasch F,Birzele J,Ochs M,et al.Surfactant proteins in pulmonary alveolar proteinosis in adults[J].Eur Respir J,2004,24:426-435.

