SP和CGRP在炎症性肠病大鼠结肠中的表达规律
张 峰,袁川评,柳巨雄,曾 林,胡娟峰
(1.军事医学科学院实验动物中心,北京 100071;2.吉林大学,长春 130062)
炎症性肠病(inflammatory bowel disease,IBD)是一种在我国及欧美等诸多国家极为普遍的慢性胃肠道疾病,其病因和发病机制尚不明确,主要与环境、遗传、免疫等多种因素密切相关[1]。而胃肠肽类激素不仅作为肽能神经递质发挥作用,同时也参与了 IBD发病的神经免疫机制。其中 P物质(substance P,SP)和降钙素基因相关肽(calcitonin gene-related peptide,CGRP)分别作为兴奋性和抑制性神经递质的代表,在IBD发病中的作用越来越受到关注。为了观察SP和CGRP在IBD大鼠结肠组织中的表达规律来探讨二者在IBD发病机制中的意义,我们采用三硝基苯磺酸 (TNBS)化学诱导建立IBD大鼠动物模型,采用 real-time RT-PCR方法检测SP和CGRP于建模后不同时期(第0、3、7、14、21、28天)结肠组织中的mRNA表达水平的变化,为进一步确定二者在炎症性肠病过程中发挥重要作用提供实验依据。
1 材料和方法
1.1 材料
未成年雌性W istar大鼠60只,体重(120±10) g,清洁级(由吉林大学基础医学部实验动物中心提供,动物合格证号:SCXK-(吉)2007-0003),随机分为PBS对照组20只,模型组40只。放置于(23± 1)℃、湿度<60%的环境中分笼饲养,并正常饮水摄食。5%三硝基苯磺酸 (trinitrobenzene sulfonic acid,TNBS)购自Sigma公司。
1.2 方法
1.2.1 建模:采用本实验室常用建模方法,即对W istar大鼠进行24 h禁食不禁水处理,将5%TNBS与无水乙醇以体积比2∶1配成混合液,按每只大鼠0.1 m L/100 g对模型组进行直肠灌注[2],对照组给予等体积的PBS。灌注后,正常进食饮水。
1.2.2 取材:分别于建模后第0、3、7、14、21、28天取结肠组织,一部分用于固定,进行常规HE染色,一部分用于提取总RNA,进行real-time RT-PCR的检测。
1.2.3 HE染色:将固定12 h以上的结肠组织依次通过酒精梯度脱水、透明、浸蜡、包埋后制作5μm厚的连续切片,然后进行HE染色,镜下观察在不同时期结肠组织的病理变化。
1.2.4 SP、CGRP和 β-actin的引物和探针引物设计:根据 GenBank中大鼠SP、CGRP和β-actin的基因序列设计引物,详见表1。引物均由上海生物工程技术有限公司和成。
1.2.5 大鼠 SP、CGRP和 β-actin的克隆:按照Trizol使用说明提取大鼠结肠组织总 RNA.以各基因特异性引物进行反转录和PCR扩增,其中反转录体系为20μL,根据说明书进行加样。总RNA 2 μL,Oligo-dT Primer(10μmol/L)1.0μL,DEPC H2O 9.5μL,5×buffer 4.0μL,dNTPm ixture(2.5 mmol/L)2.0μL,reverse transcriptase(5 U/μL) 1.0μL,RNase inhibitor(40 U/μL)0.5μL.混匀后置于42℃水浴90 min,90℃水浴5 min,冰浴冷却备用。PCR扩增反应体系25μL,具体参考说明书进行加样。H2O 17.5μL,10×PCR buffer 2.5 μL,dNTPm ixture(2.5 mmol/L)2μL,上下游引物(10μmol/L)各1μL,反转录产物1μL,Ex Taq(5 U/μL)0.1μL。反应条件为:95℃预变性3 m in;95℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环;72℃延伸5 m in。并将获得的基因片段连接至pMD18-T,进行PCR鉴定及测序。

表1 大鼠SP、CGRP和β-actin引物和探针序列Tab.1 Primers and probe sequence of SP,CGRP andβ-actin of the rats
1.2.6 SP、CGRP和 β-actin mRNA水平的定量检测:对鉴定正确的GAPDH和IL-6质粒重新转化扩增,提取质粒,进行梯度稀释,制作 real-time PCR标准曲线。反应体系为:反转录产物1μL,Taqman real-time PCR master mix 12.5μL,上下游引物及探针各1μL,H2O 8.5μL,反应条件:95℃预变性3 min;95℃变性30 s,62℃退火45 s,72℃延伸30 s,35个循环;72℃延伸5 min。将备好的结肠cDNA样品分别进行real time PCR检测。用建立的荧光定量PCR测定,并绘制出标准曲线给出标准曲线的表达式。他们分别为:β-actin:y=-3.174230x+ 32.527992,R2=0.999347;SP:y=-4.440373x+ 30.221874,R2=0.999013;CGRP:y=-4.383040x +29.985718,R2=0.99922。实验结果采用相对定量即SP或CGRP初始浓度/GAPDH初始浓度表示,根据样品荧光定量扩增曲线和SPSS13.0软件分析,得出IBD发生不同时期,SP和CGRP mRNA在IBD大鼠结肠组织中的表达变化.
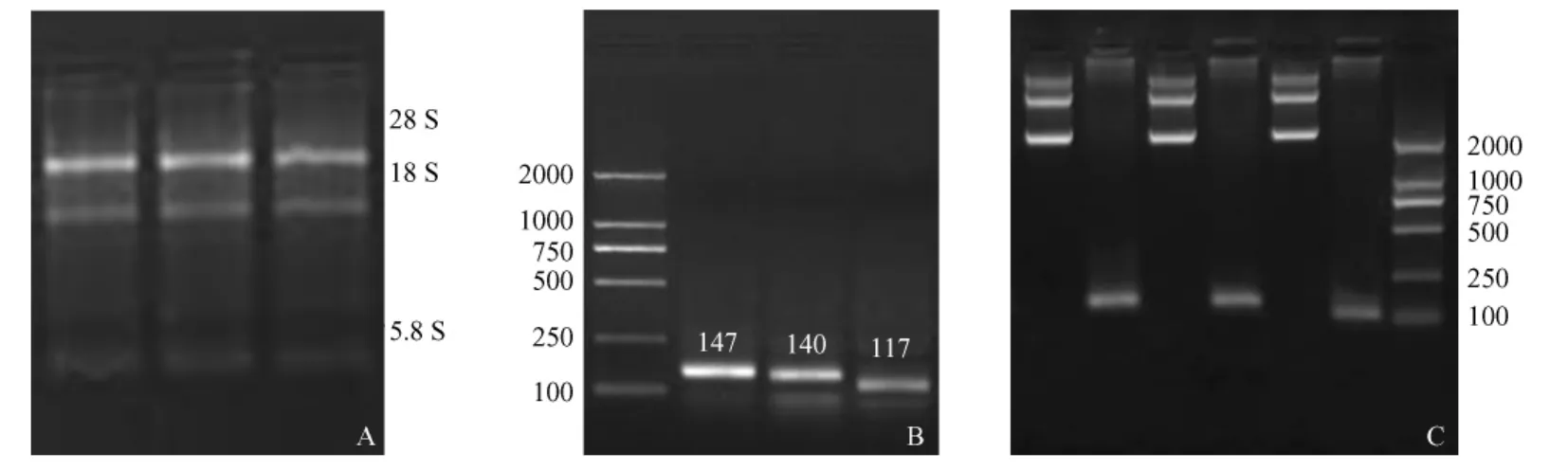
图3 A,结肠组织的总RNA电泳图;B、C分别为β-actin,CGRP和SP的扩增和质粒鉴定结果Fig.3 A.Total RNA of the colon tissue;B,C.Amplification and identification ofβ-actin,CGRP and SP genes,respectively
1.2.7 统计学方法:各组数据结果以mean±SD表示。统计用SPSS13.0软件包,实验结果进行单因素方差分析。
2 结果
2.1 结肠大体、显微病理学变化
动物于造模后24 h即出现懒动,采食量明显减少,体重较对照组明显降低。黄色稀便,肛门周围被毛被稀便沾染,最长时可达两周,有4只大鼠分别在灌肠后3~8日死亡。
在造模后第3、7天处死大鼠剖检发现,整个结肠重量明显增加,肠壁增厚、肠黏膜充血、水肿、糜烂、有溃疡灶,有些大鼠在肠壁损伤部位有假膜样物质覆盖,而且第7天最为严重(图1A~F)。镜下观察发现(图2A~F),灌药后第3天肠绒毛出现脱落,出血和水肿,肠腔内含有大量的坏死组织,肠腔扩张,肠腺减少;第7天肠上皮坏死、脱落,黏膜层和固有层出现了大量炎性细胞和严重的水肿现象;第14天可以看到水肿和出血开始逐渐消退,肠腺开始新生,肠黏膜结构开始形成;第21天,肠上皮的杯状细胞和隐窝开始新生,而且还可以看出肠黏膜上皮是在坏死组织的基础上开始新生的;第28天出血和水肿完全消失,黏膜肌层结构致密,在肠黏膜上有大量的杯状细胞、发达的肠腺和隐窝形成(图1,2见彩插7)。
2.2 SP、CGRP和β-actin基因重组质粒构建
成功提取大鼠结肠组织的总RNA,电泳后可清晰看到28S、18S、5.8S三个条带(图3A)。以总RNA为模板,SP、CGRP和β-actin基因的特异性引物进行反转录和PCR扩增,分别获得了117、140、147 bp的基因片段,与预期目的片段大小一致(图3B)。分别将PCR产物连接转化,提取质粒,并进行质粒的PCR鉴定(图3C)。
2.3 样品荧光定量PCR
通过Real-time RT-PCR方法检测了SP、CGRP mRNA在IBD大鼠不同时期结肠组织中的表达变化(图4)。SP和CGRP的mRNA水平在建模后逐渐升高,直到第7天达到最大值,然后随着疾病的恢复而逐渐降低。
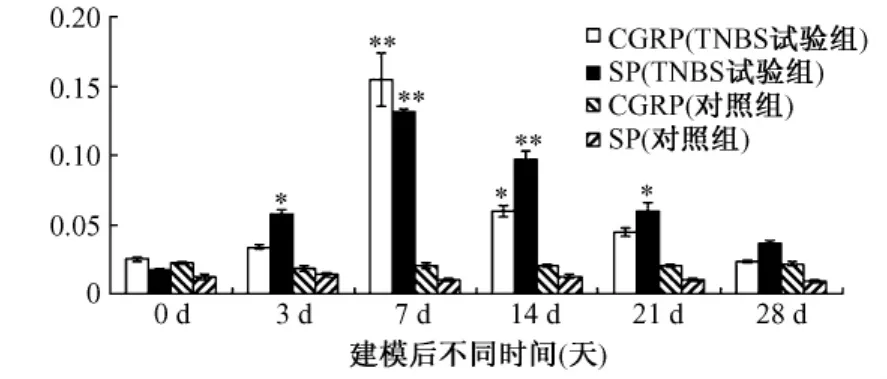
图4 CGRP和SP在IBD大鼠结肠组织中的表达变化(**表示P<0.01,差异极其显著,*表示P<0.05,差异显著)Fig.4 Expression of CGRP and SP in the colonof IBD rats.(*P<0.05,**P<0.01)
3 讨论
IBD是一种在我国及欧美等诸多国家极为普遍的慢性胃肠道疾病,以肠道炎症和肠黏膜损伤为主要特征,但至今其发病机制尚未阐明,目前认为它是一种自身免疫性疾病,与遗传、免疫、环境及黏膜屏障密切相关[1]。其中免疫因素在IBD发生发展中起着至关重要的作用。而神经肽作为一种神经调质,不仅在神经信息的传导中起重要作用,也是炎症反应时激活神经-免疫系统“对话”,诱发机体连锁免疫反应的重要介质[3]。
SP是一种发现最早、广泛分布于中枢和外周神经系统的具有多种生物活性的神经肽(11肽)。外周组织器官内的SP主要来源于器官内辣椒素敏感神经末稍,但大量实验已经证实SP也可由淋巴细胞[4]、嗜酸粒细胞[5]、肥大细胞[6]和单核巨噬细胞[7]合成分泌,且这类细胞表面还存在着SP的特异性受体NK1R。其生理作用为强烈促进消化系统平滑肌收缩,刺激小肠、结肠黏膜分泌水和电解质等。而降钙素基因相关肽(CGRP)是一种存在于感觉神经末梢的神经肽,由37个氨基酸组成,广泛分布于中枢和外周神经系统,在消化道中也大量存在。CGRP免疫反应神经纤维在肠肌层神经丛有大量分布,在血管周围、黏膜、黏膜下层也有一些,在肌层中几乎没有。它可以对巨噬细胞、淋巴细胞及其它免疫细胞发挥免疫调节作用,通过抑制T细胞的增殖来降低巨噬细胞抗原提呈和活化淋巴细胞的功能[8]。比如,它可促进单核细胞分泌IL-1、IL-6、TNF-α等炎症因子[9],也可促进SP从初级传入纤维末稍释放并抑制中性内肽酶对SP的降解[10]。释放出的SP可促进肥大细胞脱颗粒释放组胺、激肽、趋化因子、前列腺素、白三烯、IL-1、IL-6、IL-8、IFN-γ等大量炎症介质,可延缓中性粒细胞凋亡[11],促进中性粒细胞黏附和移行[12],促进内皮细胞产生黏附分子[13],促进肥大细胞表达TNF-α mRNA和分泌TNF-α[14]。
在本实验中,我们通过采用TNBS化学诱导建立IBD大鼠模型,采用real-time RT-PCR技术分别检测了CGRP和SP于不同时期的mRNA水平,发现二者在结肠组织中的表达量均与疾病的发展程度呈正相关。与对照组比较,模型组结肠组织中的SP和CGRP均随着疾病的发展而逐渐升高,直到第7天达到最大值,随后逐渐减低,直到28 d接近于正常水平。已有研究发现,溃疡性结肠炎(UC)病人结肠黏膜SP含量明显高于正常人,且结肠中P物质神经纤维比正常人神经纤维线密度明显增高,UC中肠道SP的升高与疾病的严重程度也是呈正相关的,亦即SP的水平可以间接反映疾病的严重程度[15,16]。近年来随着对SP受体NKR研究的深入,发现NK-1R在UC病人结肠中的分布与正常人没有明显差异,都是分布在固有层单核细胞、上皮细胞、黏膜下血管平滑肌以及肠肌丛,但是UC病人结肠中NK-1R的含量却明显高于正常人[17-19]。Goode等[19]测得UC病人结肠组织中NK-1R的mRNA和蛋白质表达水平也都显著高于正常结肠组织,推测过高的NK-1R表达于UC的发病有着重要关系。Lam rani A等[20]使用NK-1R拮抗剂用于由硫酸葡聚糖诱导的实验性结肠炎,发现能够很好地降低实验性结肠性的肠道炎症反应,NK-1R拮抗剂能够降低能够降低疾病活动指数,降低MPO活性,他们发现NK-1R拮抗剂能够减轻肠道氧化应激,推测其与改善肠道炎症有关,但具体作用机制还不是很清楚。Ioana等[21]将NK-1R拮抗剂LY303870用于由T细胞受体缺陷鼠IBD模型上,发现同样能够很好的改善肠道炎症反应。此外,Stucchi等[22]还发现SP参与了UC病人的隐窝炎,使用NK-1R拮抗剂后能明显改善其临床症状,同时降低组织髓过氧化物酶(MPO)活性,暗示NK-1R拮抗剂对隐窝炎有着一定的治疗价值,并有学者指出,在炎症反应调节中SP受体可能是一个潜在的治疗目标[23]。但也有研究者[19]发现,在严重UC患者肠道中SP含量是下降的,同时指出其机制可能与血管活性肠肽下降机制相类似,与在疾病严重期造成的黏膜神经受到很大破坏有关。
同样,我们发现结肠中CGRP mRNA水平与大鼠IBD发病程度呈正相关。众所周知,IBD是一种自身免疫性疾病,体内稳态失衡就会导致该疾病的发生。因此,当IBD发生时,免疫失衡,同样起着免疫调节作用的SP水平显著升高时,相应的CGRP也会随着升高,使二者呈现平衡状态。已有学者发现通过辣椒辣素、热、酸诱导小鼠之后发现结肠中CGRP释放量显著增加[24,25]。因此我们可以推断,在IBD的发生发展过程中,CGRP起着重要的免疫调节作用,同时促进SP的释放[9-14]。从而促进相应的免疫细胞释放大量的炎症介质,使机体产生炎症反应[25]。但也有学者在先后使用CGRP阻断剂和CGRP抗体分别抑制内源性和外源性CGRP后,发现UC模型的炎症症状明显加重,由此推断感觉性神经肽CGRP在UC中通过介导感觉神经的保护效应而减轻结肠黏膜炎症反应[26]。
本实验中,模型组大鼠结肠SP和CGRP表达均较对照组显著增加。已有学者证明在实验性慢性结肠炎症大鼠脊髓中Fos、SP、CGRP表达均显著增多[27],这也就揭示了模型炎症可能与外周初级传入神经元的损伤有关,而可能的机制是炎症、化学物质的刺激激活内脏感受器,导致从肠道传入脊髓的伤害性信号增多,通过释放SP和CGRP等神经递质作用于相应的受体,从而导致疾病炎症的加重。因此,我们可以推断神经递质SP和CGRP在IBD的发生发展过程发挥了重要的作用。
[1]邓长生,夏冰.炎症性肠病(第2版)[M].北京:人民卫生出版社.2006:58-73.
[2]张雪莉.电刺激疑核对炎症性肠病大鼠IL-2、IFN-γ表达的影响[D].吉林大学,2008:19-27.
[3]张建文.结扎冠状动脉诱发SP和CGRP在大鼠心肌组织内的变化及其吗啡、曲马多干预效应的研究[J].山西医科大学,2005,42-45.
[4]Lai JP,Douglas SD,Ho WZ.Human lymphocytes express substance P and its receptor[J].J Neuroimmunol,1998,86 (1):80-86.
[5]Metwali A,Blum AM,Ferraris L,et al.Eosinophils within the healthy or inflamed human intestine produce substance P and vasoactive intestinal peptide[J].JNeuroimmunol,1994,52:69 -78.
[6]Toyoda M,Makino T,Kagoura M,et al.Immunolocalization of substance P in human skin mast cells[J].Arch Dermatol Res,2000,292(8):418-421.
[7]Ho WZ,Lai JP,Zhu XH,Uvaydova M,et al.Human monocytes and macrophages express substance P and neurokinin-1 receptor[J].J Immunol,1997,159(11):5654-5660.
[8]李继锋,王舟,纪祥瑞.降钙素基因相关肽在神经免疫内分泌网络中的作用[J].中国神经免疫学和神经病学杂志,2004,1(3):177-179.
[9]Cuesta MC,Quintero L,Pons H,et al.Substance P and calcitonin gene-related peptide increase IL-1 beta,IL-6 and TNF alpha secretion from human peripheral blood mononuclear cells[J].Neurochem Int,2002,40:301-306.
[10]Ballet S,Aubel B,Mauborgne A,et al.The novel analgesic,cizolirtine,inhibits the spinal release of substance P and CGRP in rats[J].JNeuropharmacol,2001,40(4):578-589.
[11]Bockmann S,Seep J,Jonas L,et al.Delay of neutrophil apoptosis by the neuropeptide SubstanceP:involvement of caspase cascade[J].Peptides,2001,22:661-670.
[12]Kahler CM,Pischel A,Kaufmann G,et al.Influence of neuropeptides on neutrophil adhesion and transmigration through a lung fibroblast barrier in vitro[J].Exp Lung Res,2001,27:25-46.
[13]Lindsey KQ,Caughman SM,Olerud JE,et al.Neural regulation of endothelial cell-mediated inflammation[J].J Investig Dermatol Symp Proc,2000,5:74-78.
[14]Cocchiara R,Lampiasi N,Albeggiani G,et al.Mast cell production of TNF-alpha induced by substance P evidence for a modulatory role ofsubstanceP-antagonists [J].J Neuroimmunol.1999,101:128-136.
[15]Watanabe T,Kubota Y,Muto T.Substance P containing nerve fibers in rectal mucosa of ulcerative colitis[J].Dis Colon Rectum,1997,40(6):718-725.
[16]Watanabe T,Kubota Y,Muto T.Substance P containing nerve fibers in ulcerative colitis[J].Int J Colorect Dis,1998,13 (2):61-67.
[17]Törnblom H,Lindberg G,Nyberg B,et al.Full-thickness biopsy of the jejunum reveals inflammation and enteric neuropathy in irritable bowel syndrome[J].Gastroenterology,2002,123:1972-1979.
[18]Vento P,Kiviluoto T,Keränen U,et al.Quantitative comparison of growth-associated protein-43 and substance P in ulcerative colitis[J].JHistochem Cytochem,2001,49:749-758.
[19]Goode T,O'Connell J,Anton P,et al.Neurokinin-1 receptor expression in inflammatory bowel disease:molecular quantitation and localisation[J].Gut,2000,47(3):387-396.
[20]Lam rani A,Tulliez M,Chauvelot-Moachon L,et al.Effects of octreotide treatment on early TNF2 production and localization in experimental chronic colitis[J].A liment Pharmacol Ther,1999,13(5):583-594.
[21]Sonea I M,Palmer MV,Akili D,et al.Treatment with neurokinin-1 receptor antagonist reduces severity of inflammatory bowel disease induced by cryptosporidium parvum[J].Clin Diagn Lab Immunol,2002,9(2):333-340.
[22]Stucchi AF,Shebani KO,Leeman SE,et al.A neurokinin-1 receptor antagonist reduces an ongoing ileal pouch inflammation and the response to a subsequent inflammatory stimulus[J].Am JPhysiol Gastrointest Liver Physiol,2003,285(6):1259 -1267.
[23]Terbeek WP,Biemond I,Muller ES,et al.Substance P receptor expression in patients with inflammatory bowel disease[J].Neuropeptides,2007,41:301-306.
[24]Roza C,Reeh PW.Substance P,calcitonin gene related peptide and PGE coreleased from themouse colon:a new model to study nociceptive and inflammatory responses in viscera,in vitro[J].Pain,2001,93:213-219.
[25]Evangelista S,Tramontana M.Involvement of calcitonin gene related peptide in rat experimental colitis[J].J Physiol Paris,1993,87(4):277-280.
[26]Reinshagen M,Flamig G,Ernst S,et al.Calcitonin gene related peptidemediates the protective effect of sensory nerves in amodel of colonic injury[J].J Pharmacol Exp Ther,1998,286(2):657-661.
[27]郑雪雁.实验性慢性结肠炎症大鼠的内脏感觉变化及帕罗西汀的影响[D].福建医科大学,2007:27-28.

