甲型H1N1流感病毒感染不同免疫缺陷小鼠的比较
刘 颖,邓 巍,徐艳峰,朱 华,马春梅,李枫棣,鲍琳琳,秦 川
(中国医学科学院医学实验动物研究所,卫生部人类疾病比较医学重点实验室;中国医学科学院医学实验动物研究所,国家中医药管理局人类疾病动物模型三级实验室)
流感病毒的全球流行往往导致严重的后果,1918年的西班牙流感最终致使5 000万人死亡,而2009年爆发的甲型H1N1流感病毒的大流行迅速蔓延传播至世界两百多个国家和地区,造成数万人死亡。流感病毒感染宿主后,针对病原体的适应性免疫在病毒的清除中起到关键作用,并据此设计出多种流感疫苗应。近来随着对非特异性的固有免疫的研究不断深入,发现包括NK细胞、肺泡巨噬细胞和DC等在控制病毒复制和调节病毒特异的适应性免疫中都起到重要的作用。缺少T细胞、B细胞和NK细胞的小鼠不能抵御病毒感染但能够通过给予特异性抗体进行治疗,而T细胞和B细胞重排缺陷的小鼠感染后始终不能清除病毒,体重持续下降直到死亡。本研究中使用了四种不同的免疫缺陷型小鼠建立甲型H1N1流感病毒感染模型,比较了其在感染病毒后动物的存活率、体重减少情况和肺组织病变上与野生型小鼠的差异。
1 材料和方法
1.1 实验动物
雌性4~6周C57BL/6小鼠、BALB/c小鼠、SCID小鼠、NOD/LtJ小鼠、BALB/c-nu小鼠和NODSCID小鼠(各10只)(由北京华阜康提供SCXK2009-0004)。小鼠按品系分笼饲养,实验前3 d安置于ABSL-3实验室独立送风隔离笼具中适应环境。
1.2 病毒感染
H1N1病毒A/California/7/2009(CA7)株,以106TCID50。各品系小鼠经乙醚麻醉后进行滴鼻攻毒,每只小鼠50μL,攻毒后每天观察,分别于第4天、第7天和第14天处死小鼠取材检测小鼠感染后的肺组织病毒载量和病理改变。实验在中国医学科学院实验动物研究所ABSL-3实验室中进行。
1.3 动物牺牲及标本处理
断颈处死小鼠,打开胸腔,保留肺组织:取右上肺叶于组织裂解液中用于提取组织RNA;取右中肺叶于冻存管置-80℃冰箱中备份保存;其余肺叶于10%中性甲醛溶液中固定。
1.4 肺组织总RNA提取及PCR检测
RNeasy Mini Kit试剂盒(Qiagen,74106)提取肺组织总RNA,反转录成cDNA。使用荧光染料Power SYBR Green PCR Master Mix(ABI,4367659)进行real-time PCR检测(ABI Stepone PCR仪)。扩增程序94℃3 min;94℃30 s,59℃30 s,72℃30 s,共35个循环;95℃,15 s;60℃1 min;95℃15 s。每次试验的标准品作106copies/m L、105copies/m L、104copies/m L、103copies/m L、102copies/m L浓度梯度稀释,阴性对照(H2O)与样品一起提取RNA后做realtime PCR。通过读取仪器数据得到病毒载量。所用H1N1亚型特异性引物为 SW-H1 F786 5’-AATAACATTAGAAGCAACTGG-3’,SW-H1 R920 5’-AGGCTGGTGTTTATRGCACC-3’,目的片段大小为153 bp[1]。
1.5 病理学检查
取小鼠肺组织,10%中性甲醛溶液固定,常规石蜡包埋,HE染色,光镜下观察其病理变化。
1.6 统计学方法
小鼠的体重变化用体重百分比表示,即以小鼠当天体重减去0 d体重的差值作分子,以0 d体重做分母,记录为平均体重变化±标准差,数值采用每组的平均数。各组小鼠肺组织病变面积使用单因素方差分析进行两两比较。
2 结果
2.1 小鼠感染后存活情况和大体观察
各组小鼠感染H1N1病毒后逐渐出现进食减少、消瘦、被毛逆立、弓背、反应迟钝等症状。感染H1N1病毒的6种小鼠在观察的14 d内,仅有野生型的C57BL/6小鼠有50%存活,BALB/c小鼠和各免疫缺陷品系的小鼠死亡率均为100%。其中,NK细胞缺陷的NOD/LtJ小鼠感染早期即开始大量死亡,至感染后第8天已经没有存活小鼠;T细胞缺陷的BALB/c-nu小鼠在中晚期大量死亡,至感染后第11天全部死亡;而T细胞和B细胞缺陷的SCID和T、B、NK细胞联合缺陷的NOD-SCID小鼠分别于感染后第3天和第4天开始出现死亡,至感染后第13天和第12天全部死亡(图1)。剖检过程中可见感染小鼠肺脏有明显的充血和水肿,肺组织表面有局部实变,其他脏器未见明显改变。
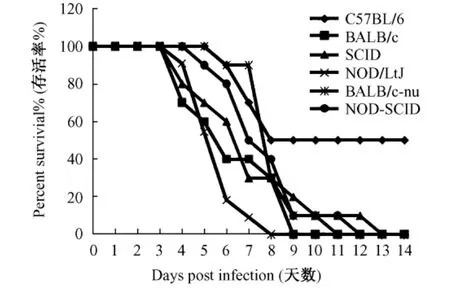
图1 不同品系小鼠感染H1N1流感病毒存活率Fig.1 Survival rate of differentmouse strains infected with influenza A(H1N1)virus
2.2 小鼠体重变化
C57BL/6小鼠体重下降缓慢,只(7~10)d降至最低,约为实验前的80%~90%,而后存活小鼠体重逐渐回升;其余品系小鼠体重随病情发展快速下降,直至死亡,其中SCID小鼠体重下降最快,10 d降至感染前体重的60%以下,BALB/c小鼠、NOD/ LtJ、BALB/c-nu和NOD-SCID小鼠体重下降较快,(7~10)d降至感染前体重的60%~70%(图2)。
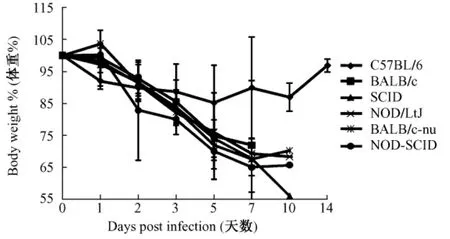
图2 不同品系小鼠感染H1N1流感病毒后体重变化情况Fig.2 Different laboratory mouse strains exhibit variablekinetics of weight loss after influenza A(H1N1)virus infection
2.3 小鼠肺组织病毒载量检测结果
攻毒后4 d和7 d处死小鼠取肺组织RT-PCR检测流感病毒的表达量(表1),各组小鼠均染毒。攻毒后4 d C57BL/6小鼠病毒载量较小,其余各品系小鼠病毒载量较大,将各组小鼠病毒拷贝数取对数后进行方差分析,各品系小鼠间差异没有显著性。
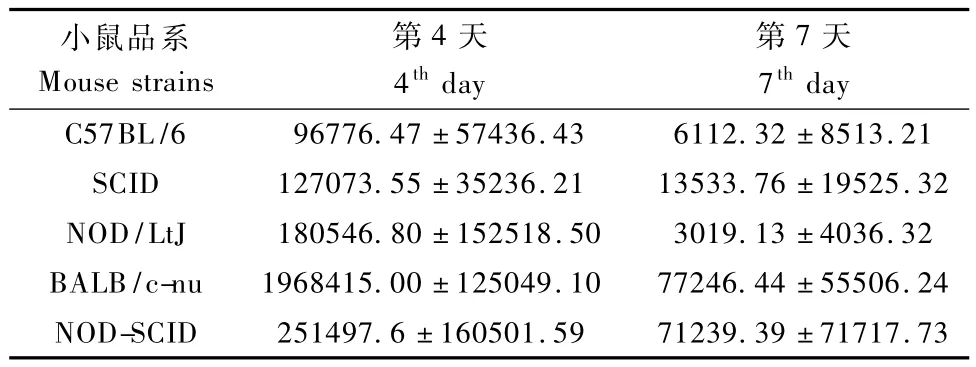
表1 H1N1感染小鼠肺组织病毒拷贝数Tab.1 Virus copy number ofm ice infected with H1N1 virus
2.4 小鼠肺组织病理观察结果
感染H1N1流感病毒后,各品系小鼠肺组织均出现了一定程度的损伤,其中BALB/c-nu小鼠的损伤面积最小,SCID小鼠的损伤面积最大,但统计学上差异没有显著性(图3);C57BL/6小鼠和NOD/ LtJ小鼠7 d的病变面积较4 d有所局限缩小,BALB/c小鼠、SCID小鼠、BALB/c-nu小鼠和NODSCID小鼠7 d的病变面积较4 d略有扩大,但均没有统计学意义。
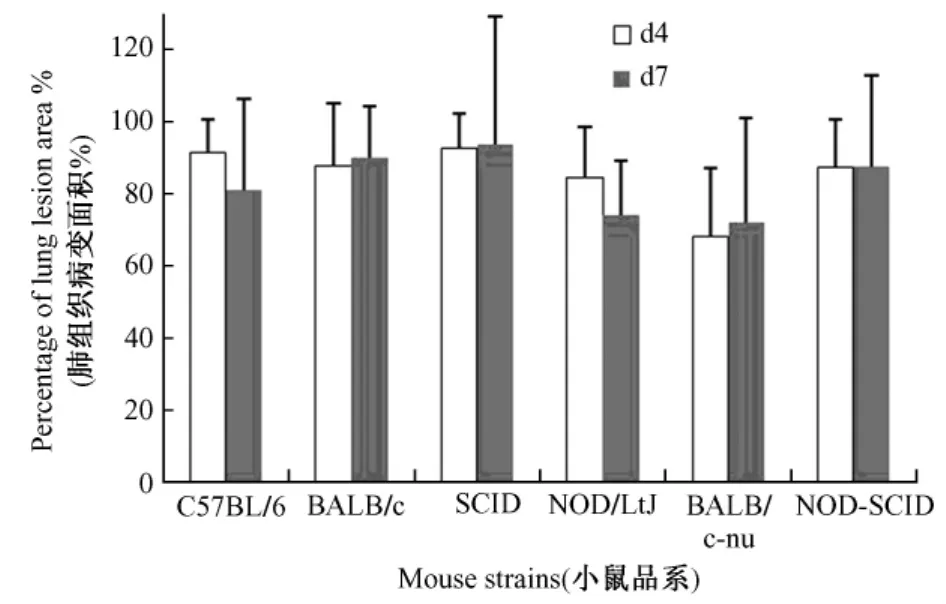
图3 不同品系小鼠感染H1N1流感病毒后肺组织损伤面积比例Fig.3 Percentage of lung lesion area in different laboratory mouse strains after infection with influenza A(H1N1)virus
除肺组织损伤的病变面积不同外,各品系小鼠肺组织的病变特点也不尽相同。从肺组织病理改变看,C57BL/6小鼠感染初期表现为较弥漫的间质性肺炎,血管扩张充血,周围水肿,有单核细胞、淋巴细胞和中性粒细胞浸润,细支气管上皮较完整,肺泡间隔增宽,肺泡受压变形,腔内有炎细胞;感染后期病变逐渐局限,细支气管上皮细胞出现增生,渗出的炎细胞逐渐减少。与野生型C57BL/6小鼠相比,BALB/c小鼠和其余四种免疫缺陷型小鼠感染后病变随病程进展不断加重,没有恢复好转,这与存活情况和体重减少的结果相一致。除了出现间质性肺炎和血管变化外,由于缺乏清除病毒的免疫机制,免疫缺陷小鼠细支气管上皮细胞和肺泡上皮细胞出现了变性坏死和脱落,SCID小鼠和NOD/ LtJ小鼠感染后7 d和NOD-SCID小鼠感染后4 d和7 d表现尤为严重。与C57BL/6小鼠肺组织内多种炎症细胞的浸润参与炎症反应对抗病毒感染不同,免疫缺陷小鼠的肺组织内炎细胞数量很少,SCID小鼠以中性粒细胞和巨噬细胞为主,NOD/LtJ小鼠以中性粒细胞和单核细胞为主,BALB/c-nu小鼠以中性粒细胞为主,NOD-SCID小鼠仅有少量的单核细胞和巨噬细胞(图4,见彩插1)。
3 讨论
在流感病毒的初次感染中,固有免疫和适应性免疫在病毒的清除和病变的局限中都起着重要的作用。我们使用甲型H1N1病毒A/California/7/ 2009(CA7)株感染野生型和4种免疫缺陷型小鼠,观察各品系小鼠病毒感染和肺组织的病理改变。结果发现不同品系的小鼠感染流感病毒,由于宿主本身的免疫系统功能状态不同,所以对病毒的反应存在差异。
从动物死亡情况看,野生型的C57BL/6小鼠的存活率最高,为50%;BALB/c小鼠和各免疫缺陷品系的小鼠死亡率均为100%。其中,NK细胞缺陷的NOD/LtJ小鼠感染早期即开始大量死亡;T细胞缺陷的BALB/c-nu小鼠在中晚期大量死亡。从动物体重减低的情况看,C57BL/6小鼠感染后体重下降后又回升;BALB/c小鼠和各免疫缺陷品系小鼠感染病毒后体重随病情发展快速下降,直至死亡。这说明在病毒感染早期,NK细胞起到重要的清除病毒的作用,NK细胞缺陷的小鼠感染流感病毒后很快出现死亡;而在感染晚期主要由特异性的T细胞清除病毒,T细胞缺陷小鼠在感染中晚期大量死亡。NK细胞被认为不仅在对抗病毒感染的固有免疫过程中发挥作用,同时在调节病毒特异的适应性免疫中也起到重要作用。然而之前的研究也发现,虽然NK细胞在病毒感染早期的固有免疫中有重要的作用,但流感病毒发展出逃避固有免疫的能力[2,3],病毒能够降低NK细胞的活性[4]。而且除了NK细胞,固有免疫还有DC、巨噬细胞、中性粒细胞等多种细胞和组分参与作用,所以BALB/c小鼠与NOD/ LtJ小鼠,SCID小鼠与NOD-SCID小鼠间在死亡率上并没有明显的差异。这些结果说明在甲型H1N1流感感染的过程中NK细胞的缺陷影响到感染早期动物的存活,但对整个发病的预后并没有起到决定性的影响。T、B细胞联合缺陷的SCID小鼠较T细胞单独缺陷的小鼠更早出现死亡,体重下降也更为明显,说明B细胞在流感病毒的感染中起到至关重要的作用。之前也有研究表明流感的初次感染中,单独B细胞缺陷的小鼠和同时缺乏B细胞和CD8+T细胞的小鼠均不能抵抗病毒的感染,前者尽管也有大量的CD8+T细胞浸润但仍然不能抵抗病毒的感染。但单独CD4+T细胞缺陷的小鼠却仅仅引起病毒清除的延迟,但仍能存活下来[5],所以在T细胞对抗流感病毒的过程中,CD8+T细胞的作用可能占主导作用。
从肺组织病理改变看,C57BL/6小鼠感染由弥漫的间质性肺炎逐渐局限;BALB/c小鼠和其余四种免疫缺陷型小鼠感染后病变随病程进展不断加重,没有恢复好转,这与存活情况和体重减少的结果相一致。除了出现间质性肺炎和血管变化外,由于缺乏清除病毒的免疫机制,免疫缺陷小鼠细支气管上皮细胞和肺泡上皮细胞出现了变性坏死和脱落。但由于各品系小鼠的免疫系统表型的差异,肺组织中浸润的炎细胞种类也有差异,但除了相应的淋巴细胞数量减少外,其他组分的炎症细胞由于缺乏相应的刺激和诱导因子,对流感病毒感染的反应也有所降低,参与炎症反应的数量减少。由此可知流感病毒感染中,NK细胞、T细胞和B细胞除了直接的病毒杀伤作用和抗体中和作用外,对其他炎症细胞的活化和诱导也起着重要的作用。但BALB/c小鼠虽然免疫系统没有显著缺陷,但肺组织内的炎症细胞数量明显少于C57BL/6小鼠肺组织内炎症细胞数量,造成这一现象的具体机制还有待于进一步研究。
[1]鲍琳琳,孙惠惠,占玲俊,等.A/California/7/2009与A/ California/4/2009病毒感染力比较[J].中国比较医学杂志,2010,20(1):6-9.
[2]Heltzer,ML,Coffin SE,Maurer K,et al.Immune dysregulation in severe influenza[J].J Leukoc Biol.2009.85:1036-1043.
[3]Gobbo D,Villani N,Marini S,et al.Suppressor cells induced by influenza virus inhibit interleukin-2 production in mice[J].Immunology 1990.69:454-459.
[4]Mao HW,Tu WW,Liu YP,et al.Inhibition of human natural killer cell activity by influenza virions and hemagglutinin[J].J Virol,2010,(5):4148-4157.
[5]Wu HY,Haist V,BaumgartnerW,et al.Sustained viral load and late death in Rag2-/-mice after influenza A virus infection[J].Virol J,2010,7:172,doi:10.1186/1743-422X-7-172.

