上肢精准测试系统在食蟹猴脑缺血研究中的应用
朱 华,刘 颖,李 秦,卢 珊,冯 铭,肖 冲,安沂华,赵春华,王任直,秦 川
(1.中国医学科学院北京协和医学院比较医学中心,卫生部比较医学重点实验室,北京 100021; 2.中国医学科学院实验动物研究所Motac合作实验室,北京 100050;3.中国医学科学院北京
协和医院,北京 100073;4.中国医学科学院基础医学研究所,北京 100005; 5.北京神经外科研究所,北京 100050)
动物模型是研究缺血性脑卒中损伤机制、对神经保护剂疗效作出判断必不可少的工具。啮齿类动物大脑与人的大脑有许多不同,对于相同缺血损伤的反应可能不同。因此,难以明确怎样将动物的给药方案扩大到人体。非人灵长类在种属关系上较接近于人,脑血管的解剖学特点与人类似,更应引起研究者注意的是非人灵长类可技巧性的使用四肢完成运动任务。利用这些特点制备的灵长类缺血性脑卒中动物模型用于评价干细胞等神经保护剂的效果,不仅可以从组织病理学及影像学方面,更可通过较系统的行为学分析评价其疗效。
1 材料和方法
1.1 实验动物
成年雄性食蟹猴18只[SCXK-(京)2005-005],购自协尔鑫生物资源研究所,年龄4~6岁,体重4.2~4.5 kg。
1.2 主要仪器及试剂
精准上肢测试系统:透明树脂板上嵌有食槽,每次训练及采集数据时将该装置悬挂于猴笼正面。
1.3 脑缺血模型的制作
使用光化学法制作局部脑缺血模型。具体方法见参考文献[1]。
1.4 干细胞移植
1.4.1 动物及分组:18只动物分为模型对照组、高剂量组、低剂量组,分组的原则是各组动物间体重差异没有显著性。各组剂量(表1)。
1.4.2 细胞注射:细胞为250μL的无色悬液,5个移植途径,每个移植途径50μL。进针深度9 mm。每次注射完毕留针 1 min。移植速度50μL/min。对照组注射等体积生理盐水。注射途径、速度、进针深度与剂量组相同。
1.5 行为学数据采集
1.5.1 前期训练:首先使动物消除恐惧心理,诱导动物能从实验者手中抓取水果块。与动物建立感情后,挂上实验装置,将水果块置于食槽中央。逐步引导动物从投食处取食。每天上、下午固定时间各进行1次。训练期间每日喂食改为1次,每次30 g,训练结束后给与。保证饮水。训练期间监控动物体重,根据体重调整喂食量。
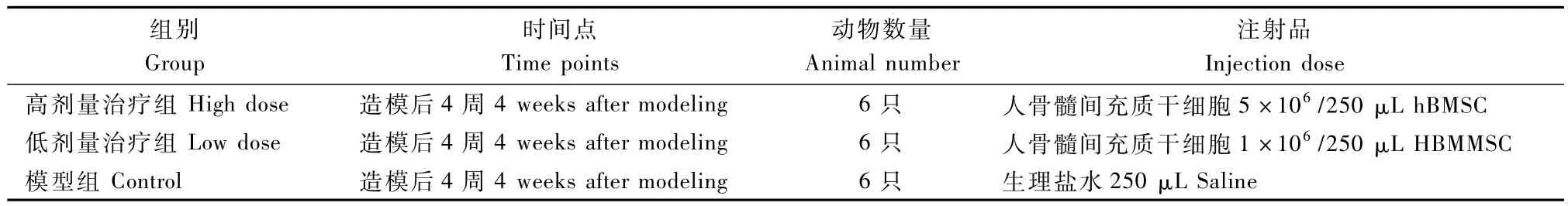
表1 动物分组Tab.1 Grouping of the animals
1.5.2 数据采集:所有动物从实验装置中取食状况稳定后进行本底数据采集。方法:将苹果切成2 cm ×2 cm×2 cm大小,摆放在食槽中央,每次5块。用秒表记录动物动物将5块水果全部取走的时间。每次数据的采集在1 d内完成,共5次,每次间隔2 h。每次采集时,水果块的大小、形状及摆放位置要一致。造模后1 d、3 d、1、2、3、4周及干细胞注射后1 d、3 d、1、2、3、4、5、6、8周采集实验数据,方法及采集时间与采集本底数据时相同。比较造模前后动物受损伤侧上肢抓取水果块的时间,评价造模效果。比较干细胞注射前后动物受损伤侧上肢抓取水果块的时间,评价干细胞的治疗效果。
1.5.3 神经功能评分:造模后1 d、3 d、1、2、3、4周及干细胞注射后1 d、3 d、1、2、3、4、5、6、8周使用经过修改、细化的Kito灵长类动物神经功能损害评分表对模型动物进行神经功能评分,其中意识28分,感觉系统22分,运动系统32分,骨骼肌共济协调18分共100分[6]。
1.5.4 数据处理:使用SPSS13.0软件进行数据分析,统计方法采用相关性分析,单因素方差分析,P值小于0.05时认为差异有显著性。
2 结果
2.1 模型制作
18只动物在麻醉苏醒后均出现了与梗死部位相对应的神经系统定位体征。主要表现为动物苏醒后6 h内表现为有意识但情绪低落,对疼痛和声音刺激不反抗。骨骼肌出现共济失调。受损伤侧上肢出现明显的麻痹,不能抓握。跛行。术后3 d部分动物的抓握能力有所恢复,但在采集数据的各个时间点,动物受损伤侧上肢抓取水果块的时间与手术前差异均存在极显著性 (P<0.01)(表2)。神经功能评分在术后24 h最高,随后出现渐进性恢复(表3)。
2.2 干细胞治疗
干细胞治疗后1 d,动物的行为学表现已出现好转,但与对照组比较差异无显著性。从治疗后3 d开始到治疗后第8周,模型组动物与高低剂量组动物间在抓取水果块的时间上差异均存在显著性 (P<0.05)(表4)。神经功能评分在治疗2周后差异出现显著性(P<0.05)(表5)。高、低剂量组间差异未见显著性。
表2 手术前后动物抓取水果块时间的比较(s;±s;n=18) Tab.2 Comparison of the times at that the animals pick up the food before and after surgery

表2 手术前后动物抓取水果块时间的比较(s;±s;n=18) Tab.2 Comparison of the times at that the animals pick up the food before and after surgery
Note:**P<0.01,手术前,B.S:before surgery;手术后,A.S:after surgery.
时间Time术前B.S术后24 h 24 hrs A.S术后3 d 3 d A.S术后1周1 wk A.S术后2周2 wks A.S术后3周3 wks A.S术后4周4 wks A.S左手upper left hand 13.4±1.82 150.9±16.27**105.1±10.73** 87.5±8.96** 64.9±17.09** 58.1±12.82** 48.4±8.40**

表3 手术前后神经功能评分结果 n=18Tab.3 Comparison of neurological deficit scores before and after surgery
表4 干细胞治疗前后动物抓取水果块时间的比较(s;±s;n=6) Tab.4 Comparison of the times at that the animals pick up the food before and after stem cell transplantation

表4 干细胞治疗前后动物抓取水果块时间的比较(s;±s;n=6) Tab.4 Comparison of the times at that the animals pick up the food before and after stem cell transplantation
Note:*P<0.05,手术前,B.S:before surgery;手术后,A.S:after surgery;A.T:after stem cell transplantation.
组别Group时间Time术前B.S术后24 h 24 h A.S术后4周4 wks A.S移植1天1 d A.T移植3天3 ds A.T移植1周1 wk A.T模型组Control 12.4±2.71 160.3±9.19 50.6±9.65 46.8±11.56 44.3±15.75 48.2±13.72高剂量组High dose 14.0±6.90 155.5±20.37 47.0±6.45 34.4±17.17 18.6±2.98* 17.7±6.18*低剂量组Low dose 13.3±1.97 140.7±24.34 49.3±10.64 32.4±12.89 23.4±8.32* 21.9±5.59*组别Group时间Time移植2周2 wks A.T移植3周3 wks A.T移植4周4 wks A.T移植5周5 wks A.T移植6周6 wks A.T移植8周8 wks A.T模型组Control 42.1±17.48 46.5±7.49 41.5±2.69 49.0±3.39 46.6±14.99 46.5±15.98高剂量组High dose 19.1±5.86* 27.8±16.94* 25.3±14.61* 27.1±15.40* 22.2±6.93* 22.8±6.35*低剂量组Low dose 23.6±6.12* 22.2±1.60* 15.7±1.81* 20.8±0.72* 18.7±1.94* 20.0±5.90*
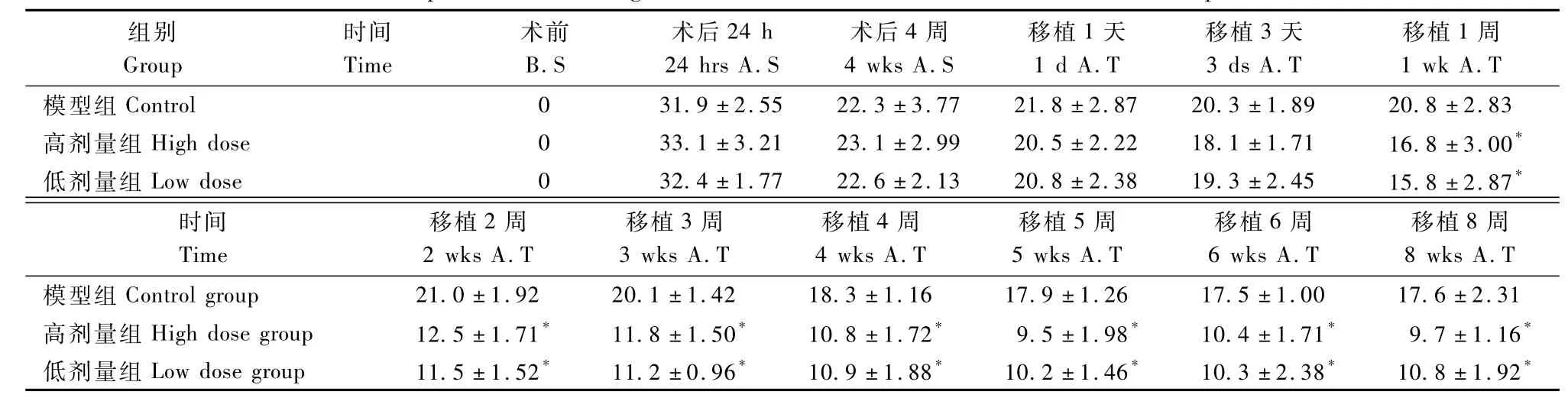
表5 干细胞治疗前后神经功能评分结果(n=6) Tab.5 Comparison of neurological deficit scores before and after stem cell transplantation
3 讨论
对实验动物缺血损伤后的行为做出评价是与人类卒中后临床表现特点紧密相关的。1999年在美国福罗里达州召开的STAIR卒中会议制订了六条评价脑卒中新药的标准,其中第四条强调了神经功能测评的重要性。目前在对神经保护剂的疗效进行评价时,研究者们的注意力大多放在缺血后的病理改变上。但早在1986年,Bothe等就已经发现了“隐蔽损伤”现象[2],即缺血损伤后有时尽管组织病理表现是接近正常甚至是正常的,但已存在功能异常。此时,以缺血面积或细胞的丧失程度做为评价标准显然是不可靠的。因而缺血损伤后行为学检查所显示的功能异常成为确定神经元早期死亡的唯一手段。
目前用于非人灵长类的神经行为评价方法主要有两种:量表法和通过完成任务来测试动物脑缺血损伤后的运动损害、认知障碍、肢体力量及精细运动功能等。专门为猴卒中设计的量表包括卒中临床等级评价量表[3]、标准神经评定量表[4,5]、猴栓塞后神经缺陷评价量表等[6],其中的猴栓塞后神经缺陷评价量表即我们采用的kito量表。这个量表专门针对神经系统损伤而设计,与临床卒中病人采用的量表类似。通过完成任务来测试非人灵长类神经功能的方法主要有:抓取食物丸任务[7,8],主要用于评价手的灵巧度;山和谷阶梯任务[9],主要用于鉴别运动损害与视觉空间缺陷。精细运动测试主要用于评价肢体力量和精细运动功能,符合本实验的要求。因此采用这种测试方法评价模型动物的神经功能。
用量表对灵长类的神经功能进行评价的优点是比较直观,可分系统对神经功能进行评价,不需要对动物进行训练。但要求评价者有较丰富的经验,不同的人对同一动物进行评价其结果可能相差较多。精细上肢运动测试方法在实验正式开始前需要花费大量时间对动物进行训练,动物一旦掌握了抓取食物的方法,即可通过时间上的差异对动物手术前后及注射干细胞后的疗效进行比较客观的评价。
我们对文献报道的精细上肢运动测试系统进行了改造,使测试板配有树脂玻璃限制,只有被评价的上肢能接近,通过记录动物取出全部水果块的时间可提供关于肢体力量、精细运动功能方面的全部信息。实验结果显示,食蟹猴光化学法造模后出现了明显的行为学症状。随着时间推移症状有所减轻,2周左右神经功能评分和精细上肢运动测试都达到稳定状态。表明模型建立方法是稳定可靠的。剂量组行为学在注射干细胞后3 d开始改善。神经功能评分和精细上肢运动测试分别在注射后2周和1周出现显著性差异。在今后的实验中,可通过2名有经验的人员分别进行评价,取二者平均值的方法减少量表评价法的主观性。
综上所述,上肢精准测试系统虽然在实验前需要做较多的准备工作,但因其能客观准确的反应动物神经功能,结合神经功能评分,在非人灵长类脑卒中动物模型建立和药效学评价方面有广泛的应用前景。
[1]朱华,李秦,冯铭,等.光化学法制作食蟹猴局部脑缺血模型[J].中国比较医学杂志,2008,18(9):32-34.
[2]Bothe HW,Bosma HJ,Hofer H,et al.Selective vulnerability of hippocampus and disturbances ofmemory storage after mild unilateral ischermia of gerbil brain[J].Stroke,1986,17:1160-1163.
[3]Ben R,Naimath K,Eray T,et al.Chronic ischemic stroke model in cynomolgus monkeys:behavioral,neuroimaging and anatomical study[J].Neurol Res,2003,25(1):68-78.
[4]Huang J,Mocco J,Choudhri TF,et al.A modified transorbital baboon model of reperfused stroke editorial comment[J].Stroke,2000,31(12):3054-3063.
[5]Mack WJ,King RG,Hoh DJ,et al.An improved functional neurological examination for use in nonhuman primate studies of focal reperfused cerebral ischemia[J].Neurol Res,2003,25 (3):280-288.
[6]Kito G,Nishimura A,Susumu T,et al.Experimental thromboembolic stroke in cynomolgus monkey[J].J Neurosci Methods,2001,105(1):45-53.
[7]Yonas H,Wolfson SK,Dujovny JM,et al.Selective lenticulostriate occlusion in the primate.A highly focal cerebral ischemiamodel[J].Stroke,1981,12(5):567-572.
[8]Marshall JW,Ridley RM,Baker HF,et al.Serial MRI functional recovery and long term infarct maturation in a non human primate model of stroke[J].Brain Res Bull,2003,61 (6):577-585.
[9]Marshall JW,Ridley RM.Assessment of cognitive and motor deficits in a marmosetmodel of stroke[J].ILAR J,2003,44 (2):153-160.

