扶正败毒颗粒对脓毒症大鼠急性肺损伤保护作用的实验研究*
张 韧 王丁超 苏秀平 高 翔 王 静 吴桂玲 陈晓敏
1河南省濮阳市中医院(河南濮阳457003)
2河南省中医院(河南郑州450008)
急性肺损伤(ALI)是临床上常见的急性呼吸系统功能失常,其中由感染导致的脓毒血症是引起ALI的最常见的病因。目前认为脓毒症是炎症失控导致的紊乱,是机体对微生物产物发生失控的免疫反应[1],其中肿瘤坏死因子-α(TNF-α)是脓毒症发生早期的重要炎性细胞因子,大量释放则对机体造成损伤,白细胞介素-1(IL-1)可与 TNF-α 协同作用加重多器官损伤[2]。 本实验以脓毒症大鼠为研究对象,观察大鼠不同时间点的肺组织含水量、动脉血气变化、肺组织IL-1、TNF-α表达变化,探讨中药复方扶正败毒颗粒对脓毒症大鼠肺损伤的保护作用。
1 材 料
1.1 实验动物 青年SD大鼠,清洁级,雌雄各半,鼠龄3~4月,体质量(300±50)g,154只。 由河南实验动物中心提供,合格证号:scxk(豫)2009-0006。
1.2 药品与仪器 扶正败毒颗粒(濮阳市中医院中药制剂室提供);乌司他丁(广东天普生化医药股份有限公司生产,批号:国药准字 S19990050);IL-1单克隆抗体及TNF-α单克隆抗体均由武汉博士德生物工程有限公司提供。光学显微镜(Olympus optical Co.LTD,JAPAN,型号 PM-10AD)。电子天平(上海精科天平厂,型号 JA1203)。
1.3 分组与造模 将SD大鼠按随机数字表法分为模型组、扶正败毒颗粒组、乌司他丁组及扶正败毒颗粒联合乌司他丁联合组(联合组)各36只,假手术组10只。参考文献[3-4]加以改良制备脓毒症动物模型。水合氯醛腹腔注射麻醉大鼠,待完全麻醉后,仰卧位固定大鼠,颈部皮肤常规备皮、消毒,于颈外侧下颌至心脏的中点作一约1cm的横切口,钝性分离皮下组织,暴露右侧颈外静脉,沿血管向近心端方向插入留置针约1cm,将导管从留置针管与颈外静脉夹孔中把心导管慢慢置入达右心房,结扎固定,导管末端经皮下隧道从颈后中央引出并固定于皮肤,管内注射125U/mL肝素0.5mL抗凝,插入置管针封闭导管。然后沿腹白线中段作3cm切口,探查取出盲肠,用4号丝线距盲端1cm处结扎,用12号针穿刺3孔,挤出少许粪便于腹腔内,回纳盲肠,分层缝合腹腔。手术过程中保持大鼠肛温(37.0±0.5)℃,保持室温(26.0±1.0)℃。
1.4 给药方法 假手术组、模型组、乌司他丁组分别于造模后第1日用生理盐水灌胃,同时扶正败毒颗粒组、联合组用扶正败毒颗粒(36.8mg/100g)灌胃(灌胃容积为1mL/100g),每日灌胃1次直至取材;乌司他丁组、联合组大鼠分别于造模后第1日腹腔内注射乌司他丁(1万U/㎏),假手术组、模型组、扶正败毒颗粒组同时用同等容积的生理盐水腹腔注射,每日1次直至取材。
1.5 标本采集与检测 (1)腹主动脉血气:测定大鼠口腔温度,并记录,取腹主动脉血2mL采用电极法进行血气测定,PaO2、PaCO2。(2)肺组织含水量:称取肺组织湿重,然后放入恒温箱(100±2℃)干燥,24h后取出,称取干重,计算肺组织含水量。计算公式:肺组织含水量=(肺湿重-肺干重)/肺湿重×100%,以%表示。(3)脏器组织IL-1,TNF-α表达:检测采用免疫组织化学SP法检测,在400倍光镜下观察,细胞膜、细胞浆呈棕色为免疫组化阳性;用Image-Pro Plus 5.1专业图像采集与分析系统采集图像,并进行半定量分析,每张切片随机选取不重叠的5个视野拍照,测定其平均吸光度及阳性细胞数,取其平均值代表各细胞因子的表达水平。(4)病理观察:取肺组织4%多聚甲醛固定,经脱水、透明、浸蜡、包埋,切成4~6μm厚的切片,常规脱蜡、脱水,苏木素-伊红(HE)染色,脱水、透明、封片。光学显微镜观察肺、肠组织病理形态学改变。
1.6 统计学处理 应用SPSS13.0统计软件。计量资料采用单因素方差分析方法,数据以s)表示;组内差异比较采用单因素方差分析两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠动脉血PaO2、PaCO2比较 见表1。与假手术组比较,模型组动脉血 PaO2显著降低,PaCO2显著升高(P<0.01);与模型组比较,扶正败毒颗粒和乌司他丁及联合组PaO2升高,PaCO2下降,以联合7d组尤为显著(P<0.01);与扶正败毒颗粒通组比较,乌司他丁组无显著差异(P>0.05),见表1。
表1 各组大鼠动脉血PaO2、PaCO2比较 (mmHg,
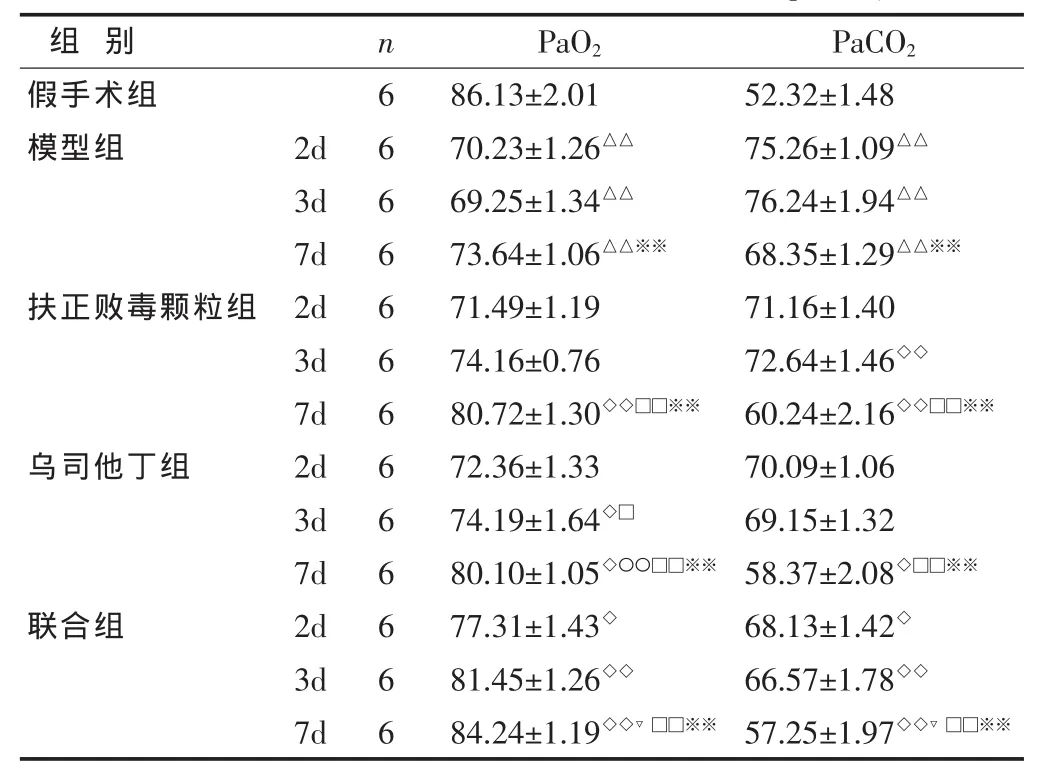
表1 各组大鼠动脉血PaO2、PaCO2比较 (mmHg,
与假手术组比较,△P<0.05,△△P<0.01; 与模型组比较,◇P<0.05,◇◇P<0.01;与扶正败毒颗粒组比较,▽P<0.05;与联合组比较,〇P<0.05,〇〇P<0.01;与 2d组比较,□P<0.05,□□P<0.01;与 3d组比较,*P<0.05,*P<0.01。 下同。
?
2.2 肺组织含水量变化结果 见表2。与假手术组比较,模型组大鼠肺组织含水量显著升高(P<0.01);与模型组比较,扶正败毒颗粒和乌司他丁及联合组含水量均显著降低 (P<0.05或0.01),与2d、3d组相比,扶正败毒颗粒和乌司他丁7d组的肺组织含水量均显著降低(P<0.05或0.01),以联合7d组下降尤为显著(P<0.01)。
表2 各组大鼠含水量比较(

表2 各组大鼠含水量比较(
?
2.3 肺组织TNF-α、IL-1的表达变化 见表3。与假手术组比较,模型组大鼠肺组织TNF-α、IL-1表达均升高 (P<0.05或0.01);与模型组相比,扶正败毒颗粒和乌司他丁及联合组各时间点 TNF-α、IL-1的表达水平均显著下降(P<0.05或 0.01),以联合7d组的尤为显著(P<0.01);与联合组相比,扶正败毒颗粒组和乌司他丁组TNF-α、IL-1表达水均显著升高 (P<0.05或0.01),以 2d组尤为显著(P<0.01)。与 2d 、3d组相比,以联合 7d组 TNF-α、IL-1 表达水平下降尤为显著(P<0.01)。
表3 各组大鼠肺组织TNF-α、IL-1阳性细胞表达变化(IOD,

表3 各组大鼠肺组织TNF-α、IL-1阳性细胞表达变化(IOD,
?
2.4 肺组织病理改变 假手术组大鼠肺组织可见肺泡大一致,肺泡壁菲薄,支气管上皮完整,管腔内无分物,支气管上皮正常,外周无炎性细胞浸润。模型2d组可见肺间质有单核细胞、淋巴细胞浸,肺组织出现散在性病灶;3d组可见病灶增大、数量多,肺泡壁广泛淋巴细胞及单核细胞浸润,有些区域可见肺泡出血,肺泡壁结构不清。7d组更为明显,肺泡腔内满布炎性渗出物、血性渗出物明显,大量上皮脱落,肺泡壁结构不清,大片的肺实变。扶正败毒颗粒组在第2、3、7日均较模型组有显著改善,病变范围、程度均较模型组明显减轻。联合7d组改善尤为显著,表现为病变范围较局限,炎细胞密度较低,肺泡腔内渗出物少,肺泡结构较模型组完整。
3 讨 论
ALI主要是因机体炎症反应失控所导致的器官损伤[5]。本组资料显示模型组大鼠肺组织炎性因子TNF-α,IL-1表达水平明显高于假手术组,表明促炎细胞因子在脓毒症大鼠急性肺损伤损伤中发挥了重要作用。TNF-α是由活化的巨噬细胞、单核细胞和T淋巴细胞产生,具有核心作用,是导致炎症介质级联反应的始发因子。一旦TNF-α被分泌出来,炎症连锁反应即被启动,促进其他细胞因子的激发释放,引起组织损害。有报道促炎症细胞因子TNF-α在感染性休克中发挥关键作用,直接导致某些脏器的损伤[6]。IL-1是另一种主要由巨噬细胞产生的促炎性细胞因子,是体内调节免疫和炎症反应的中心介质,是细胞因子网络中的关键因子,能激活多种免疫和炎症细胞:刺激单核细胞和巨噬细胞产生IL-6和TNF-α;刺激中性粒细胞释放炎症介质;诱导内皮细胞活化,与TNF-α协同作用,促进血管内皮-白细胞黏附分子的表达,趋化中性粒细胞等炎症细胞进人病变部位,增加血管内皮通透性,加重组织损伤[7-8]。所以,降低促炎细胞因子TNF-α,IL-1水平对防止ALI具有重要意义。本实验结果显示,扶正败毒颗粒能够降低组织炎性因子TNF-α,IL-1表达水平,提示扶正败毒颗粒通过降低脏器组织中炎性细胞因子TNF-α,IL-1含量,进而减轻脓毒症大鼠多器官损伤和降低死亡率。
综上所述,促炎因子TNF-α,IL-1在ALI中发挥了重要作用,扶正败毒颗粒能够降低脏器组织中TNF-α,IL-1表达水平以减轻脏器损伤;降低了肺组织的含水量,提高动脉血氧含量,对脓毒症大鼠具有确实的防护作用,为扶正败毒颗粒防治脓毒症性MODS提供了参考。
[1] SatSharma,MD,FRCPC,etal.Septic shock multiple organ failure and acute respiratory distresss yndrome[J].Medseape,2003,9(12):199-209.
[2] 邱海波,潘家绮,赵永强,等.肿瘤坏死因子-α、白细胞介素-1β和巨噬细胞炎性蛋白-2在感染及器官损伤中的作用及治疗探讨[J].中国危重病急救医学,1996,8(3):139-142.
[3] 施新猷.现代医学实验动物学[M].北京:人民军医出版社,2000:298-335.
[4] Xiang D Z,Vverbeken K,Vanlommela T,etal.Intimal hyperplasia after long-term venous catheterization[J].Eur Surg Res,2000,32(4):236-245.
[5] 陈海龙,关凤林,吴咸中.多器官功能不全综合征研究的现状和展望[J].中国急救医学,2000,20(7):439.
[6] Andrzejczak D,Gorska D,Czarnecka E.Influence of amlodipine and atenolol on lipopolysaccharide (LPS)-induced serum concentrations of TNF-alpha,IL-1beta,IL-6inspontaneouslyhypertensiverats (SHR) [J].Pharmacol Rep,2006,58(5):711.
[7] 孙卫民,王惠琴.细胞因子研究方法学[M].北京:人民卫生出版社,1999:584.
[8] 罗正曜.休克学[M].天津:天津科学技术出版社,2001:601.

