117例高分级脑胶质瘤术后同步放化疗的前瞻性研究
齐立伟 范育伟 李玉 袁亚文
117例高分级脑胶质瘤术后同步放化疗的前瞻性研究
齐立伟 范育伟 李玉 袁亚文
目的 回顾性分析并评价术后同步放化疗治疗高分级脑胶质瘤的疗效。方法 117例高分级脑胶质瘤患者术后随机分为观察组(58例)和对照组(59例)。对照组给予术后常规放疗,总剂量DT=60Gy/6周。观察组化疗与放疗同步进行。在脑部放疗20~30Gy时,口服司莫司汀(Me-CCNU)150mg,放疗期间每周一次,共3~4次,放疗结束后每6~8周一次,共6~8次。结果 局部近期疗效观察组和对照组有效率分别为68.97%和25.42%,两者比较差异有统计学意义(P<0.01)。中位复发时间观察组和对照组分为14.25个月和10.38个月(P<0.01)。1、2、3、4年生存率观察组和对照组分别为72.41%、43.10%、22.41%、12.09%和49.15%、15.25%、10.17%、1.69%。经统计分析,2年生存率差异有统计学意义(P<0.05)。观察组急性反应加重,远期损伤两组相近。结论 术后同步放化疗能提高高分级脑胶质瘤患者局部控制率,延长复发时间,并可提高生存率。
脑胶质瘤;放射治疗;化疗;司莫司汀
胶质瘤是起源于神经胶质细胞的肿瘤,主要包括星形细胞肿瘤、少突胶质细胞肿瘤和混合性胶质细胞肿瘤。临床常将恶性星形细胞瘤和胶质母细胞瘤统称恶性胶质瘤,而将Ⅲ级胶质瘤(如间变性星形细胞瘤,间变性少突胶质细胞瘤)、胶母细胞瘤、胶质肉瘤等统称为高分级胶质瘤。高分级胶质瘤恶性程度高,具有浸润性生长的特点,加上病变处于脑内,切除时顾忌太多,因此外科手术难以完全切除,术后局部复发是治疗失败的主要原因。高分级胶质瘤术后无一例生存超过两年,50%死于6个月内。临床研究已经证明术后放疗能提高肿瘤局控率和患者生存率,因此已成为标准治疗方案[1]。然而,目前高分级胶质瘤患者的长期生存率仍不尽人意,5年生存率不超过10%[2]。2005年3月至2009年2月,我院采用同步放化疗的方法治疗高分级脑胶质瘤术后患者58例。并对同步收治的59例相同分级患者行术后单纯放疗。两组资料对比分析,报告如下。
1 资料与方法
1.1 一般资料 2005年3月至2009年2月,我院对手术切除后的117例高分级脑胶质瘤患者采用信封法随机分为两组继续治疗。观察组(A组)采用术后放疗同步口服司莫司汀化疗,对照组(B组)行术后单纯放疗。两组资料如表1。
所有患者经手术后病理证实均为高分级脑胶质瘤(WHOⅢ~Ⅳ级)、放疗前KPS≥70,手术后放疗前头颅MRI提示肿瘤均有2~4cm的不同大小残留,无明显放化疗禁忌证。

表1 患者临床资料
1.2 治疗方法 所有患者术后2~4周皮肤切口拆线后行头颅放疗:B组面膜固定,仰卧位,6 mV-X线等中心照射,常规分割。先全颅照射,DT=40Gy/4周,然后根据术前头颅CT及MRI所见在肿块水肿区边缘外放3cm局部加量DT=20Gy/2周,总剂量DT=60gY/6周。A组放疗方法与B组相同,在放疗DT 20~30Gy时,口服司莫司汀(Me-CCNU)150mg化疗一次,放疗期间每周一次,共3~4次,放疗结束后每6~8周一次重复,共6~8次。
1.3 观察方法 放疗期间每周监测血象,每半月监测肝肾功能,放疗结束后每个月监测血常规、肝肾功能。治疗结束时及治疗后每3个月复查头颅MRI。观察肿瘤变化、复发时间、生存时间、死亡原因等。
1.4 疗效评定标准 对比手术后放疗前及放疗结束后3、6个月时头颅MRI,分为完全缓解(CR):肿瘤病灶消失;部分缓解(PR):肿瘤缩小>50%;无变化(NC):肿瘤缩小<25%或继续增大<25%;肿瘤进展(PD):肿瘤继续增大>25%或出现新病灶。CR+PR者计为有效。血液毒性、急性放射性脑损伤和晚期放射性脑损伤参照放射肿瘤协作组(RTOG)和欧洲癌症研究治疗中心(EORTC)的放射治疗毒性标准分级为1~4级如表2、3。

表2 ROTG急性放射损伤分级标准

表3 ROTG/EORTC晚期放射损伤分级方案
1.5 统计学方法 采用SPSS 11.5对数据进行统计分析,计数资料采用χ2检验,计是资料采用t检验,P<0.05表示差异有统计学意义。
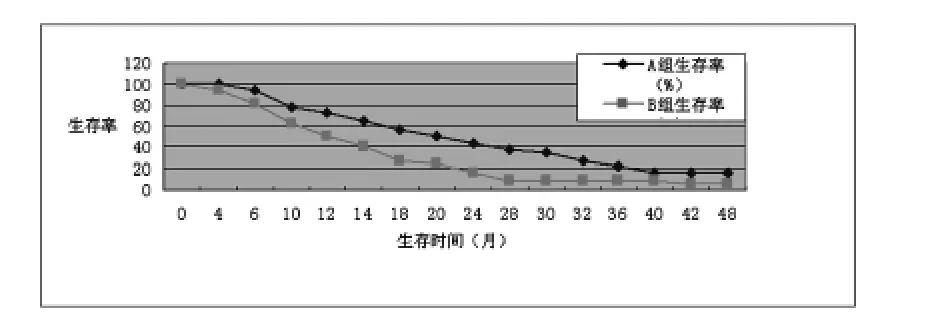
图1
2 结果
2.1 局部近期疗效 以对比手术后放疗前与放疗结束后6个月时头颅MRI影像来观察,结果如下:A组有效率(CR+PR)68.97%(40/58),B组有效率25.42%(15/59)。两者比较差异有统计学意义(χ2=8.183,P<0.01)。
2.2 放疗结束后检查出现复发时间 A组复发时间5~24个月,中位时间14.25个月。B组复发时间4~26个月,中位时间10.38个月。A组复发时间要长于B组约4个月。两者比较差异有统计学意义(t=3.202,P<0.01)。
两组患者生存曲线如下图:1年生存率,A、B组分别为72.41%(42/58)与49.15%(29/59),两者比较差异无统计学意义(χ2=1.630,P >0.05);2年生存率,A、B组分别为43.10%(25/58)与15.25%(9/59),两者比较差异有统计学意义(χ2=6.108,P <0.05);3年生存率,A、B组分别为22.41%(13/58)与10.17%(6/59),两者比较差异无统计学意义(χ2=2.327,P >0.05);4年生存率,A、B组分别为12.09%(7/58)与1.69%(1/59),两者比较差异无统计学意义(χ2=2.930,P>0.05)。可以看出A组生存率在数值上要优于B组,但是经处理后仅2年生存率差异有统计学意义。
2.3 近期急性反应与远期损伤,见表4。
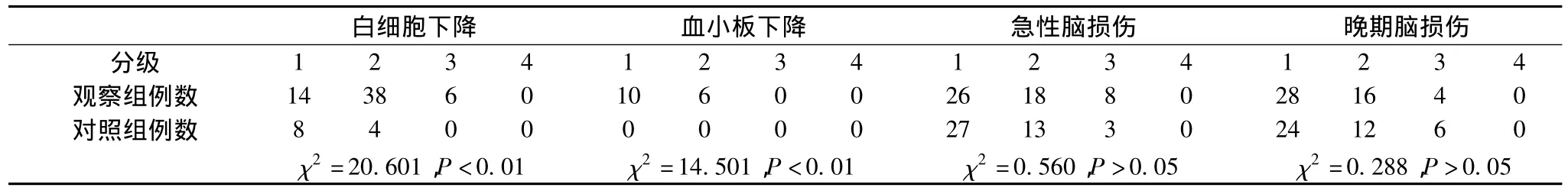
表4 近期急性反应与远期损伤情况
按照RTOG和EORTC的放射治疗毒性标准分级,白细胞下降A、B组总发生率分别为100%(58/58)与20.34%(12/59),比较差异有统计学意义(χ2=20.601,P<0.01)。血小板下降A、B组总发生率分别为27.59%(16/58)与0%(0/59),比较差异有意义(χ2=14.501,P<0.01)。血细胞下降经使用升血细胞药物治疗3~4d后均回升至正常水平。急性脑损伤A、B组总发生率分别为89.66%(52/58)与72.88%(43/59),差异无统计学意义(χ2=0.560,P>0.05)。晚期脑损伤A、B组总发生率分别为82.76%(48/58)与74.92%(42/59),差异无统计学意义(χ2=0.288,P>0.05)。可见在脑损伤方面,无论是急性还是晚期损伤,差异无统计学意义;不过A组在血液毒性表现方面要明显高于B组,但血细胞下降经使用升血细胞药物治疗3~4d后均回升至正常水平,临床可以接受。且所有患者随访期间观测肝肾功能均无明显改变。
3 讨论
高分级胶质瘤由于其恶性程度高,肿瘤呈浸润性生长,与周围组织无明显分界,同时由于脑部功能的特殊性,外科医师在手术时往往投鼠忌器、左右为难,单纯手术预后很差。文献报道无1例活过2年,半数在半年内死亡[3]。术后放疗为降低局部复发,延长患者生存作出了很大贡献。手术加术后放疗已经是高分级胶质瘤的常规治疗方案,但是多年来单纯术后放疗的疗效仍维持在较低水平,中位生存期在9~12月左右徘徊[4]。传统化疗药物对胶质瘤的抗肿瘤活性较低,并且对血脑屏障的通过能力较差。大多数化疗药物在肿瘤组织内难以到达满意浓度。然而,近年来有部分术后放化疗联合与术后单独放疗的随机对照研究结果显示:联合化疗后恶性星形细胞瘤患者的2年生存率从31%提高到37%,胶母细胞瘤从9%提高到13%。并且危险比分析提示,不管肿瘤预后因素如患者年龄、Karnofsky评分、肿瘤组织类型和侵犯范围,放射治疗联合化疗均可提高生存率[5]。我国也有学者报道:头颅照射量达到DT20~30Gy时,血脑屏障开放,此时使用化疗药物可以使肿瘤内药物浓度明显增高,放疗8个月后血脑屏障恢复到治疗前水平[6]。这些均为高分级胶质瘤的综合治疗提供了新思路,我们正是按此思路进行的。
癌细胞的放射敏感性与癌细胞的细胞周期有依赖关系,G2期与M期交界处的放射敏感性高出S期2~3倍。长春碱类药物与ACNU、BCNU、CCNU等药物在细胞周期中对M期有阻断作用,使细胞周期蓄积在G2~M期,此时进行照射因细胞敏感较易收到显著效果[7]。司莫司汀(Me-CCNU)是洛莫司汀(CCNU)的衍生物,为亚硝脲类抗瘤谱较广的药物。其分子量小,脂溶性大,易透过血脑屏障。与癌细胞DNA起烷化作用,阻止DNA损伤修复,作用于增殖期或非增殖期细胞,正好与放疗作用之间形成细胞周期时相互补,同时抑制了肿瘤细胞对放疗所造成的各种损伤的修复,于放疗起到了协同及增敏作用。本组研究单纯放疗复发时间,生存率及近期治疗有效率等均与国内外有关文献[2]相似,放化综合组在近期疗效、复发时间等方面均较单纯放疗表现出较大优势,尽管关键数据1、2、3、4年生存率比较中仅有第2年生存率表现出了统计学差异,但是1、3、4年生存率从数值上看仍具有一定优势(72.41%vs 49.15%,22.41%vs 10.17%,12.09%vs 1.69%),其间差距依旧令人鼓舞。分析其之所以统计学显示无明显差异可能与样本含量较少以及随访时间尚短有关,下一步工作中会注意加强。
本组研究同时显示,放化综合组患者的急性血液学毒性与单纯放疗组比较明显升高,主要为司莫司汀的延迟性骨髓抑制,经使用血细胞生长因子3~4d后均回升至正常水平。观测治疗前后肝肾功能均无明显改变。在脑损伤方面,无论是急性还是晚期损伤,均无明显差异,说明放化综合治疗的安全性。
今后,随着放疗技术的日益发展,检查与治疗技术的进一步提高,生物治疗手段的逐渐丰富[8],以及以替莫唑胺(TMZ)等为代表的第二代口服烷化剂的进一步研究[1]深入,有望通过术后同步放化疗的方式来进一步提高高分级胶质瘤的治疗效果。
[1] Stupp R,Mason WP,van den Bent MJ,et al.Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma.N Engl J Med,2005,352:987-996.
[2] 杨军,马林.高分级胶质瘤的放化综合治疗.中华放射肿瘤学杂志,2006,15(2):100-103.
[3] 谷铣之,殷蔚伯,刘泰福,等.肿瘤放射治疗学.北京:北京医科大学中国协和医科大学联合出版社,1993:737-738.
[4] 邱幸生,陈龙华.脑恶性胶质瘤放射治疗进展.广东医学,2005,26(9):1174-1175.
[5] Stewart L A,Chemotherapy in adulthigh-grade glioma:a systematic review and meta-analysis of individual patient data from 12randomised trials.Lancet,2002,359(9311):1011-1018.
[6] 秦德兴,郑蓉,唐谨,等.脑部放射治疗对血脑屏障的影响.中国放射肿瘤学,1990,4(1):29-31.
[7] 刘泰福现代放射肿瘤学.上海:复旦大学出版社,上海医科大学出版社,2001,474-475.
[8] 王凡,黄强,周丽英.高聚生联合手术放化疗治疗胶质瘤及其机制的探讨.中国肿瘤临床,2006,33(8):445-448.
Clinical observation on combined chemo-radiotherapy in high grade intracranial glioma
QILi-wei,FAN Yu-wei,LIyu,et at.Department of Radiation Oncology,The First People’s Hospital of Liangyungang city,Lianyungang 222000,China
ObjectiveTo evaluate the efficacy of postoperative concurrent radiochemotherapy for high grade intracranial glioma.M ethods 117 cases of postoperative intracranial glioma were randomized into observation group(58 cases)and control group(59 cases).In the controlgroup,routine postoperative external irradiation were administered with a total dose of60Gy/6weeks.In the observation group,chemotherapy was concurrently with radiotherapy.When the irradiative dosewas20to 30Gy,patients
Me-CCNU 150mg orally,followed by once every week,the total cycles were three to four during the radiation and the total cycles were six to eight.Results The local response rate of the observation group and control group was68.97%and 25.42%,respectively.There was significant difference between them(P<0.01).Median recurrent time was 14.25 months in the observation group and 10.38 months in the control group(P < 0.01).The 1-,2-,3-,4year survival rates were 72.41%,43.10%,22.41%,12.09%,in the observation group and 49.15%,15.25%,10.17%,1.69%,in the control group,respectively.There was statistic significance of the difference between the two groups in 2-year survival rate(P<0.05).The acute toxicity wasmore serious in the observation group.The late toxicity was approximate in both groups.ConclusionPostoperative concurrent radiochemotherapy is able to improve the local control rate and prolong the recurrent time for the patientswith high grade intracranial glioma.It is able to improve survival rate.
Intracranial glioma;Radiotherapy;Chemotherapy;Me-CCNU
222000连云港市第一人民医院放疗科

