阴离子交换树脂对Streptomyces roseosporus发酵液中达托霉素的分离纯化研究
王泽根,王文轶,吴 旻,吴勋贵,王伟明,王 旻
中国药科大学生命科学与技术学院,南京 210009
达托霉素 (Daptomycin)是从玫瑰孢链霉菌(Streptomyces roseosporus)发酵衍生得到[1],是目前全球首个成功开发的环脂肽类抗生素[2]。由于其独特的结构和作用机制,在临床上与万古霉素相比表现出广谱、药效快、给药量小、副反应小等优点,是目前世界上公认的万古霉素等现用抗生素的最佳替代品[3]。此外,达托霉素对高致病耐药菌如耐甲氧西林金葡菌(MRSA),糖肽类敏感的金葡菌(GISA),耐青霉素肺炎链球菌(PRSP)等均有高效低毒的杀菌效果,并且使用方便[4]。
目前,关于达托霉素粗提方法主要有国内采用大孔吸附树脂提取发酵液中达托霉素的报道[5]和国外专利介绍采用丁醇浸提或离子交换树脂提取的方法[6]。本文对国产阴离子交换吸附剂进行筛选,旨在寻找一种分离效果好且价格相对低廉的阴离子交换树脂,从Streptomyces roseosporus发酵液中提取达托霉素,并分别从静态和动态吸附与洗脱两方面考察了操作条件对达托霉素分离纯化效果的影响,以期为达托霉素的进一步纯化提供实验基础。
1 仪器与材料
1200型高效液相色谱仪(包含双泵、自动进样器和DAD紫外检测器,美国Agilent公司);离子交换柱(20 cm×1.5 cm,上海华美实验仪器有限公司);Econo-pump横流泵(美国Bio-RAD公司)。
达托霉素对照品Cubicin注射剂(含量900mg·g-1,美国Cubist公司);乙腈为色谱纯 (美国Merck公司);其他试剂均为分析纯。
弱碱性阴离子交换树脂D301、强碱性阴离子交换树脂717均购自安徽三星树脂厂;弱碱性阴离子交换树脂HZD-9、多孔型环氧系弱碱性阴离子交换树脂335、弱碱性环氧系阴离子交换树脂330、大孔弱碱性丙烯酸系阴离子交换树脂D315均购自上海华震公司。
菌种与培养基见参考文献[7]。
2 方法与结果
2.1 实验方法[8]
发酵液预处理:按文献[7]方法发酵结束后,将达托霉素发酵液以8000r·min-1离心30min,收集上清液。
静态吸附与洗脱:分别量取6种树脂5 mL,加入预先盛有100 mL达托霉素发酵液的250 mL三角瓶中,于200 r·min-1恒温摇床中吸附,吸附完毕后用NaCl水溶液洗脱。
动态吸附:交换柱用树脂装填量30 mL,预处理后的离子交换树脂装柱。将预处理后的发酵液按实验设计流速经离子交换树脂吸附,用5倍柱体积水冲洗后,按实验设计的条件进行阶段洗脱,每个阶段洗脱体积为15倍柱体积(BV)。
2.2 测定方法[7]
达托霉素含量测定:HPLC法,色谱柱为HanBon C18柱 (4.6 mm×150 mm,3 μm);流动相为乙腈 (含0.1%三氟乙酸)-0.1%三氟乙酸水溶液(41︰59);流速为1.0 mL·min-1;检测波长为223 nm;柱温为30℃;进样量为20 μL。
2.3 离子交换树脂的筛选
达托霉素发酵液中可溶性组分复杂,经预处理后仍含有多肽、氨基酸、有机酸、无机盐等杂质。由于达托霉素为脂肽类物质,在碱性条件下带负电,宜用阴离子交换树脂进行分离纯化。因此选用6种不同类型的阴离子交换树脂进行筛选,结果见表1。

表1 不同阴离子交换树脂对达托霉素静态吸附的比较
由表1可见,D315、HZD-9树脂对发酵液中达托霉素的吸附量较低,不适用于对达托霉素的纯化;D301、717、335和330对发酵液中达托霉素的吸附量都比较高。因此,本实验对D301、717、335和330的洗脱率作进一步考察。
从图1可见,尽管D301、717对达托霉素有较高的吸附量,但洗脱率很低,因此,这两种树脂也不适合于达托霉素的分离纯化。330树脂与335树脂比较,虽然其对达托霉素的吸附量稍低,但其洗脱率最高,因此本研究选择330树脂做进一步研究。
2.4 330树脂吸附条件的确定

图1 4种树脂对达托霉素的洗脱率
2.4.1 330树脂对达托霉素静态和动态吸附效果比较2.4.1.1 330树脂的静态吸附时间 将装有330树脂和发酵液的摇瓶放入恒温摇床中,在30℃、200r·min-1、pH8.0~8.5的情况下摇动,定时取样测量。实验结果如图2所示,330树脂对达托霉素的饱和吸附时间为10 h。

图2 330树脂对达托霉素的吸附时间
2.4.1.2 330树脂的动态吸附效果 将发酵液(含达托霉素60.52 mg·L-1,pH8.0~8.5)分别以不同流速流过330树脂床层,考察不同流速对达托霉素的动态吸附效果,结果见图3。由图3可见,随着流速的降低,330树脂对达托霉素的吸附效果越好。但是通过330树脂对达托霉素吸附量的计算,发现从4BV·h-1~0.5 BV·h-1,330树脂对达托霉素的吸附量都低于静态吸附时树脂对达托霉素的吸附量,且低流速动态吸附对达托霉素的饱和吸附时间远多于静态吸附,因此,动态吸附不适用于330树脂对达托霉素的吸附。
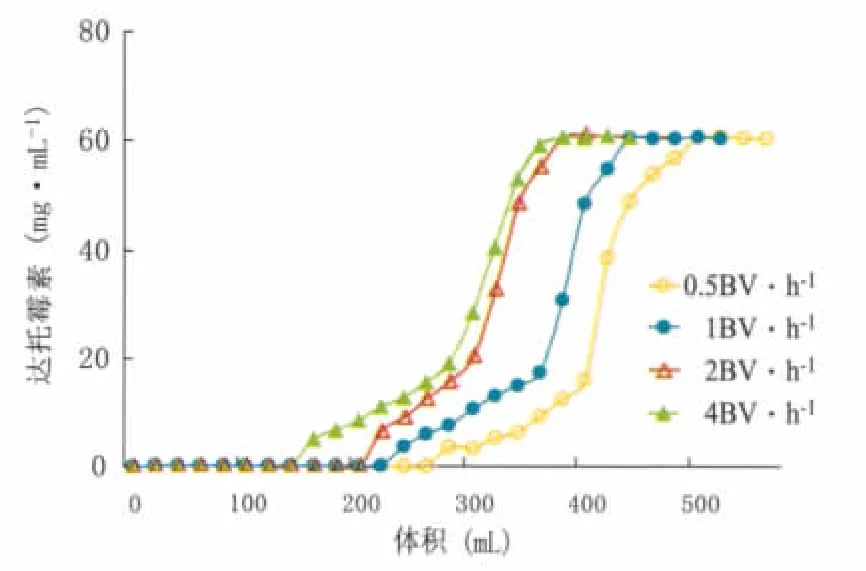
图3 330树脂对达托霉素的动态吸附效果
2.4.2 发酵液pH对吸附效果影响 考察不同pH的发酵液对330树脂吸附效果的影响(图4),结果表明,发酵液的pH对330树脂的吸附性能有明显的影响,pH8.0~8.5时对达托霉素的吸附最有利。达托霉素为脂肽类物质,一般为弱酸性物质,在pH 8.0~9.0已充分解离,有利于与树脂进行离子交换吸附。但在较高的pH环境下,达托霉素稳定性较差,同时发酵结束后,发酵液pH值一般处在7.5~8.5之间,处于较佳吸附范围内,所以可以对发酵液进行直接吸附。

图4 pH对330树脂吸附量的影响
2.4.3 温度对330树脂吸附量的影响 考察不同环境温度对330树脂吸附效果的影响(图5),结果表明,当温度处于15℃~35℃时,对330树脂的吸附效果只有轻微的影响,因此,可在常温下进行330树脂对达托霉素的吸附操作。
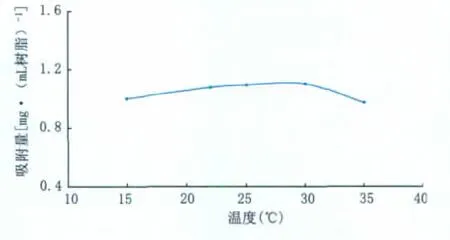
图5 温度对330树脂吸附的影响
2.5 洗脱条件的确定
2.5.1 330树脂洗脱时间 将装有已饱和吸附达托霉素的330树脂摇瓶放入恒温摇床中,在30℃、200 r·min-1、0.8 mol·L-1NaCl的情况下摇动,定时取样测量。实验结果如图6所示,由此可见,达托霉素被330树脂洗脱的时间为8 h,并且通过计算,其洗脱率达到最大洗脱率(92.5%),回收率达到了87.5%,并且纯度由2%提高到60%。
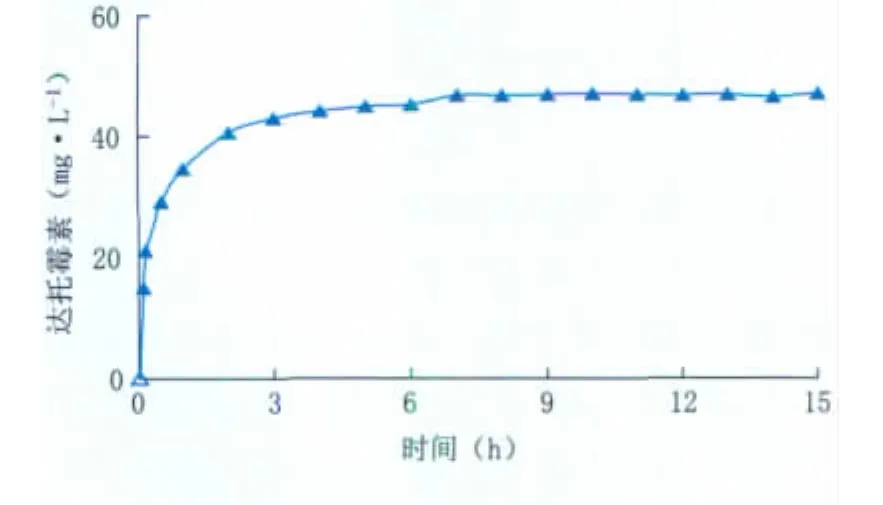
图6 达托霉素的静态洗脱时间
2.5.2 洗脱剂NaCl浓度对洗脱率的影响 发酵液中的杂质与树脂之间吸附力与达托霉素存在明显的差异,采取不同浓度的洗脱剂浓度对饱和吸附达托霉素的树脂进行洗脱,达到达托霉素与杂质分离的目的。采取静态洗脱方式,考察不同浓度NaCl的洗脱效果,结果见图7。可见,随NaCl浓度增加,达托霉素的洗脱率升高,但洗脱液中NaCl浓度达到0.8 mol·L-1时,结合在330树脂上的达托霉素基本上被洗脱下来。但当NaCl浓度继续上升时,洗脱效率并没有增加,反而出现小幅度的下降,并且与330树脂结合更强的杂质也同时被洗脱下来。因此,洗脱液选择0.8 mol·L-1NaCl较为适宜。
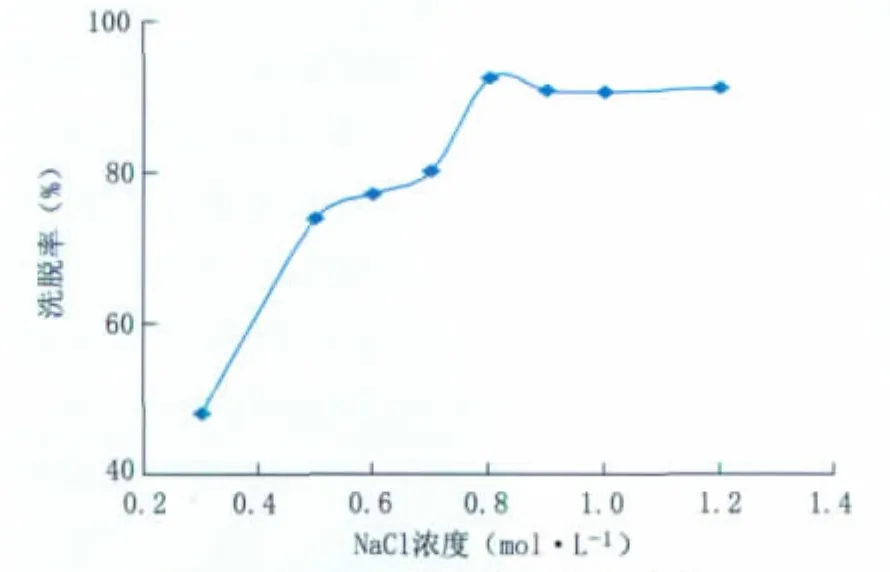
图7 洗脱剂浓度对洗脱率的影响
2.5.3 洗脱体积对洗脱效果的影响 采取静态洗脱的方法,考察洗脱剂体积对洗脱率的影响,结果见图8。由图8可知,当洗脱剂体积达到60 mL(12倍树脂体积),洗脱率达到最大,当洗脱剂体积继续增加时,洗脱率并没有增加,反而稀释了洗脱液中达托霉素的浓度,因此,洗脱剂的最佳洗脱体积为60 mL。

图8 洗脱剂体积对洗脱率的影响
3 结 论
离子交换层析是利用离子交换剂为固定相,依据离子交换剂与溶剂之间的静电作用差异而进行分离的一种技术,它对分离各种生化产品,特别是具有生物活性的生物大分子有良好的效果。它自20世纪40年代末问世以来,随着高分子化学的发展,离子交换层析技术己被广泛应用于蛋白质、多肽、环肽、核酸、寡聚核苷酸和其它带电荷的生物分子的分离纯化中。
本文在实验室规模上初步确定了330阴离子交换树脂纯化Streptomyces roseosporus发酵液中达托霉素工艺,工艺如下:吸附方式为静态吸附,吸附温度为15℃~30℃,吸附液的pH 8.0~8.5,饱和吸附时间为10 h;最适洗脱方式为静态洗脱,洗脱剂为0.8 mol·L-1NaCl水溶液,洗脱体积为12倍树脂体积,洗脱时间为8 h。在优化条件下,发酵液中达托霉素的纯度由2%提高到了60%,回收率达87.5%。考虑到将来向工业化大生产转化的可能,在选择制备工艺时,也注意了大规模生产时的可操作性以及物料节约问题。比如提取工艺,在不影响提取得率的前提下,减少了提取时间,有利于提高生产效率。在树脂的选择问题上,考察各种树脂的吸附性能、价格、耐用性等因素。
在本实验中,发现0.8 mol·L-1NaCl水溶液几乎可以把结合在树脂上的达托霉素全部洗脱下来,又因为在强酸或强碱环境下,都不利于达托霉素的稳定性,因此,在本实验中没有对洗脱剂pH作进一步考察。
[1] Tedesco K L,Rybak M J.Daptomycin[J].Pharmacotherapy,2004,24(1):41-57.
[2] 任晓蕾,张海英,李玉珍.环脂肽类抗生素达托霉素[J].中国新药杂志,2009,18(12):1075-80.
[3] Thorne,Grace M,Alder J,et al.Daptomycin:a novel lipopeptide antibiotic[J].Clin Microbiol Newsl,2002,24 (5):33.
[4] 史丽娟,石 磊.新型抗革兰氏阳性菌药物—达托霉素[J].中国医药导刊,2008,10(7):1100-2.
[5] 石 磊,史丽娟,蒋 沁,等.达托霉素发酵液大孔树脂吸附分离的研究[J].中国抗生素杂志,2008,22(2):84-9.
[6] Thomas JK,Lai JJ,Joseph P,et al.High purity lipopeptides,lipopeptide micelles and processes for preparing same:US,6696412Bl[P].2004-02-24.
[7] 祝宇松,陈国胜,王 旻,等.达托霉素发酵培养基的响应面法优化 [J].中国医药工业杂志,2010,41(3):183-6.
[8] 刘骥翔,叶 华,谭天华,等.离子交换层析纯化透明质酸[J].生物加工过程,2009,7(4):32-5.

