氮杂环类化合物的反应研究
张建伟 樊媛洁
(首都医科大学化学生物学与药学院,北京100069)
当季胺盐与碱作用时可能发生各种反应。如果季胺盐有β氢存在,容易进行Hofmann消除反应产生烯烃。碱也可以作用于α氢原子形成N-ylide,在一定条件下可进行Stevens重排等反应产生三级胺[1-2]。设想在一个氮杂环三级胺的氮原子上引入一个乙腈基即生成它们的季胺盐,在碱的作用下在亚甲基上定点形成一个N-ylide,进而可发生重排得到结构改造的氮杂环。许多具有生物活性的天然产物含有氮杂环,通过对N-甲基六氢吡啶及托品酮反应的研究为天然产物及含氮杂环的先导化合物的结构改造提供依据和方法。
1 材料和方法
1.1 仪器
熔点用毛细管熔点仪测定(温度计未校正),1HNMR和13CNMR由AM-500核磁共振仪(德国Bruker公司)测定,CDCl3为溶剂,TMS为内标;HRMS MS用Quattro Micro ZQ2000质谱仪(美国Waters公司)测定。
1.2 方法
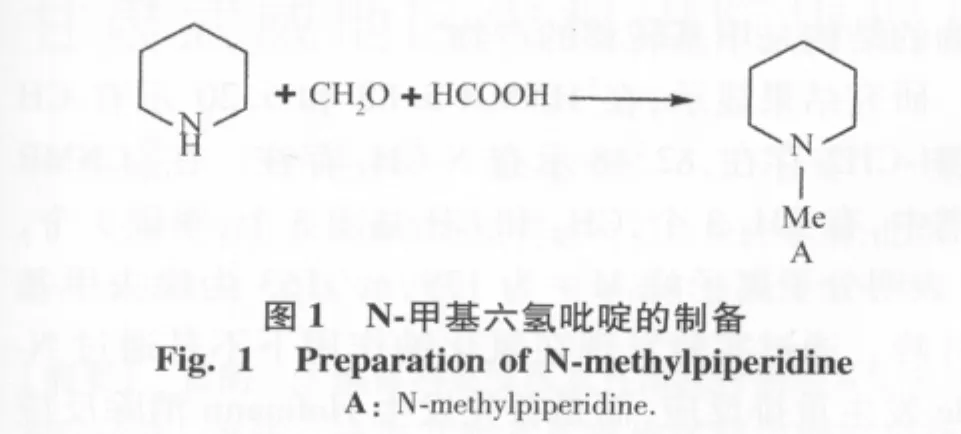
1)N-甲基六氢吡啶(图1A)的制备:在250 mL三口瓶中加入26.5 mL六氢吡啶,加10 mL甲酸和26 mL甲醛,40℃加热2 h后回流6 h,冷却后在冰水浴中加入浓盐酸20.5 mL,蒸除过量甲酸和甲醛,在冰水浴上加入9.6 g氢氧化钠配成的50%溶液,过滤,收集84℃~107℃的液体,氢氧化钾干燥,过滤得液体即为N-甲基六氢吡啶。
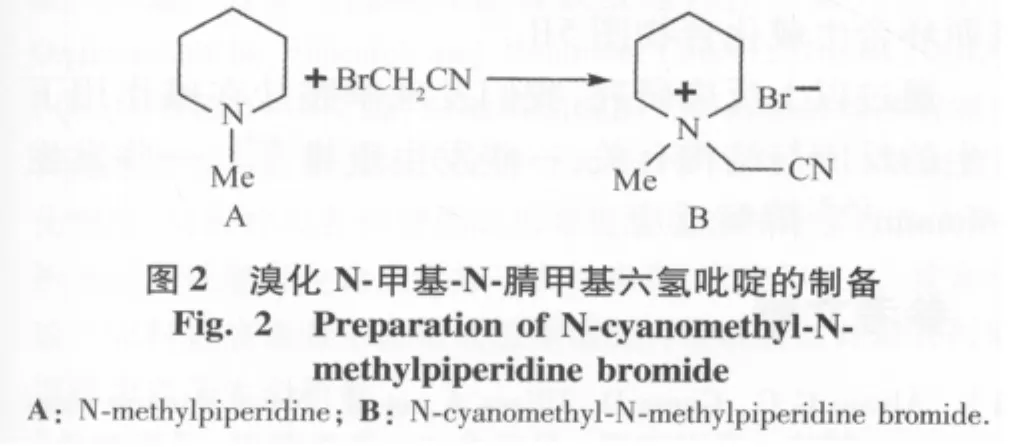
2)溴化N-甲基-N-腈甲基六氢吡啶(图2B)的制备:2 g的N-甲基六氢吡啶(图1A)溶于10 mL乙酸乙酸中,加入1 g的溴乙腈,反应1 h,有大量白色沉淀出现,过滤,乙酸乙酯充分洗涤,干燥,乙酸乙酯-甲醇重结晶得白色固体(图2B)。
3)溴化N-甲基-N-腈甲基六氢吡啶与氢化钠的反应:在25 mL三口瓶中加入80%氢化钠230 mg,10 mL无水四氢呋喃和200 mg季胺盐(图2B),48℃反应9 h,冷却过滤,浓缩,经柱层析选用展开剂乙酸乙酯∶甲醇=10∶1洗脱,得黄色固体(图3C)。
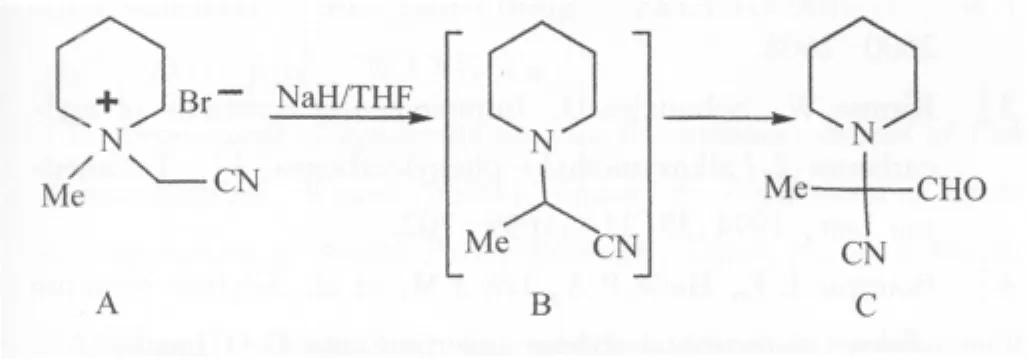
图3 溴化N-甲基-N-腈甲基六氢吡啶的反应Fig.3 Reaction of N-cyanomethyl-N-methylpiperidine bromideA:N-cyanomethyl-N-methylpiperidine bromide;B:2-piperidinyl-1-propiontrile; C: 2-piperidinyl-2-cyanoyl-propionaldehyde.
4)2-六氢吡啶基1-丙腈(图3B)的制备:18.6 g的亚硫酸氢钠溶于45 mL水中,加入5 mL乙醛,混合物加热至60℃,冷却到35℃,搅拌加入17.6 mL六氢吡啶,保持温度35℃,2 h后加入11.6 g氰化钾溶于25 mL水中的溶液,反应1.5 h后,上层液被分离,过滤,减压蒸馏收集63℃~58℃/mm。
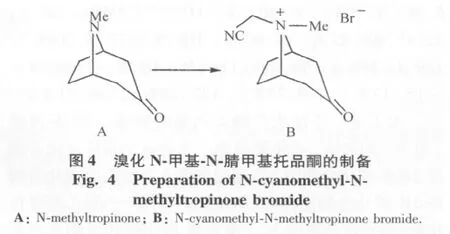
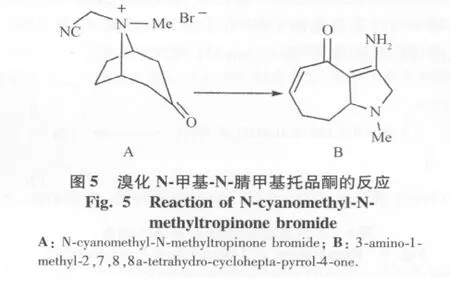
5)溴化N-腈甲基托品酮的制备:100 mg托品酮,加5 mL乙酸乙酯使其溶解,同时加入360 mg溴乙腈,室温反应20 h,过滤得粗品120 mg,甲醇-乙酸乙酯重结晶得白色固体(图4B)。
6)溴化N-腈甲基托品酮与氢化钠的反应:在25 mL三口瓶中加入80%氢化钠140 mg,5 mL无水四氢呋喃和70 mg季胺盐(图4A),50℃反应1 h,冷却过滤,浓缩,经柱色谱分离得棕色固体(图5B)。
2 结果
本课题组对溴化N-甲基-N-腈甲基六氢吡啶的反应进行了研究。以六氢吡啶为原料,通过2步反应,制备得到N-甲基六氢吡啶化合物16 g液体(图1A),产率68%和溴化N-甲基-N-腈甲基六氢吡啶化合物(图2B)1.8 g,产率99%,mp183℃ ~184℃。化合物(图2B)与过量的氢化钠在四氢呋喃中反应,50℃反应9 h,得到淡黄色固体化合物(图3C)。产率42%,mp123℃~127℃。1HNMR(500 MHZ):δ1.46 (m,1H),1.80(m,3H),2.08(m,2H),2.98(td,2H),3.30(s,3H,NCH3),4.45(d,2H),8.37(s,1H,CHO),13CNMR(125 MHZ,ppm):171.21,121.72,63.28,54.77,21.34,21.26,MS m/z 166 (M+,63%),151(M-15,24%),137(M-29,91%),123(14%),109(100%),96(14%)。HRMS的M+计算值166.1106,实测值166.1094分子式为C9H14N2O。
本课题组应用这种重排反应方法对阿托品桥环化合物进行了研究。托品酮与溴乙腈反应制得季胺盐(图4B)产率64%,mp203℃~210℃。溴化N-腈甲基托品酮在四氢呋喃中与过量氢化钠于50℃反应1 h,过滤、浓缩,经柱色谱得棕色固体(图5B)产率47%,mp 111℃114℃。1HNMR:δ2.48(s,NCH3),5.88(d,1H),6.20(dt,1H),13CNMRδ:29.6,32.45,39.8,61.4,69.4,108.9,132.8,141.7,159.8,186.5。MS m/z:178(M+100%),163(M+ -15,17%),149(32%),122(12%),109(31%)。
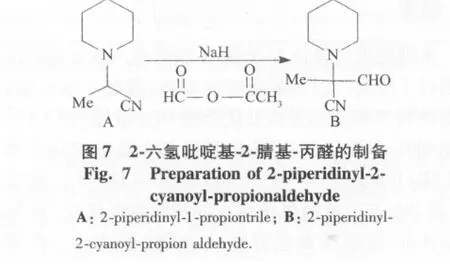
为了进一步证明产物2-六氢吡啶基-2-腈基-丙醛(图3C)的结构,希望能找到一个合适的条件使化合物图3B生成化合物图3C,通过如图6、7反应合成化合物图3B,将化合物图3B在氢化钠的作用下与甲乙酐进行反应,得到化合物图3C。溴化N-腈甲基托品酮在四氢呋喃中与过量氢化钠于50℃反应1 h,过滤、浓缩,经柱色谱得棕色固体,产率47,mp111℃~114℃。

3 讨论
化合物图3C是由化合物图3B与四氢呋喃中的不纯物过氧化氢物产生的甲酸酯反应而形成的。1HNMR8.37处有醛基存在,δ4.45处为一双峰说明是与氮原子相连的2个e键上的氢,δ2.97处为td峰,说明是与氮原子相连的2个a键上的氢,表明含有六氢吡啶环存在和13CNMR DEPT分析含有3种类型的-CH2,更进一步证明六氢吡啶环的存在,而且在低场171 ppm处表明碳上连有一个氢原子,说明是醛基,高分辨质谱显示分子组成为C9H14N2O,分子离子峰M+为166,含有失去甲基和醛基的片断的碎片峰,以及失去甲基,醛基和氰基的碎片峰,由此推测出化合物的结构是甲基转移的产物。
研究结果显示,在1HNMR 5.88和6.20示有-CH =CH-CH2-存在,δ2.48示有N-CH3存在。在13CNMR波谱中,有CH23个,CH3和CH基团3个,季碳3个,MS表明分子离子峰M+为178,m/z163为除去甲基碎片峰。通过实验发现在氢化钠作用下不是通过N-ylide发生重排反应,而是首先发生Hofmann消除反应进而环合生成化合物图5B。
通过以上反应研究,我们发现季胺盐在碱作用下发生的反应与结构有关,一些发生重排[3-5],一些发生Hofmann[6-7]降解反应。
[1] Álvaro G G,Gema D,Ulises A,et al.Novel domino reactions in β-carbolines with triple bonded dienophiles[J]. Tetrahedron Lett,2008,49(38):5467-5470.
[2] Tayama E J,Otoyama S J,Tanaka H.Resolution of nitrogen-centered chiral tetraalkylammonium salts:application to[1,2]Stevens rearrangements with N-to-C chirality transmission[J].Tetrahedron:Asymmetry,2009,20(22):2600-2608.
[3] Kirmse W,Schnitzler D.Intramolecular reactivity of arylcarbenes:2-(alkoxymethyl)phenylcarbenes[J].Tetrahedron Lett,1994,35(11):1699-702.
[4] Bourque L E,Haile P A,Loy J M,et al.Silylene oxonium ylides:di-tert-butylsilylene insertion into C-O bonds[J]. Tetrahedron,2009,65(28):5608-5613.
[5] Mortimer A J,Aliev A E,Tocher D A,et al.Synthesis of the tagetitoxin core via photo-stevens rearrangement[J]. Org Lett,2008,10(23):5477-5480.
[6] Patterson J M,Barnes M W,Johnson R L.Synthesis of some substituted 3-nitro-1,5-pentanediamines[J].J Org Chem,1966,31(10):3103-3106.
[7] Ishizumi K,Inaba S,Yamamoto H.Quinazolines.III. Curtius and hofmann reactions of 2'-benzoyloxanilic acids. Novel syntheses of quinazolinones[J].J Org Chem,1974,39(17):2587-2591.
