蜡蚧轮枝菌对茶蚜的侵染模型
王联德, 王雪芹
(福建农林大学生物农药与化学生物学教育部重点实验室, 福建 福州 350002)
茶蚜Toxopteraaurantii又名桔二叉蚜、茶二叉蚜、可可蚜,属同翅目蚜科,是茶树上的一种重要害虫,在我国各茶区每年均有不同程度发生。它主要为害茶树的嫩芽、嫩叶和嫩梢,一般集中在1芽3叶上,吸汁为害。茶树受害严重时,嫩梢芽叶萎缩卷曲,生长停止。受害芽叶制成的干茶色暗、汤浊且带腥味,色、香、味均极低劣,严重影响茶叶的产量和品质[1]。目前,对蚜虫的防治主要是运用化学杀虫剂,既杀伤了天敌,又污染了环境,农药残留也影响茶叶的品质,成为我国茶叶贸易和出口的重要障碍[2]。因此发展以生物防治为主要内容的茶叶无公害生产,从源头上控制农残,是提高茶叶产量和品质的关键。
蜡蚧轮枝菌Lecanicillium(Verticillium)lecanii是蚜虫类、蚧类、螨类和粉虱的重要病原真菌, 除寄生同翅目害虫的重要种类外,还可寄生螨类、蓟马和线虫等。作为微生物杀虫剂,已被多个国家应用于蚜虫、烟粉虱和温室白粉虱的防治[1,3-6]。近几年国内也有一些利用蜡蚧轮枝菌防治温室害虫如白粉虱、烟粉虱、蚜虫和粉蚧的研究[5-6]。本研究用4株蜡蚧轮枝菌接种茶蚜,观察茶蚜实验种群染病流行情况,用Gompertz模型比较了4株蜡蚧轮枝菌对茶蚜的侵染流行速率。
1 材料与方法
1.1 孢子悬浮液的制备
4株蜡蚧轮枝菌株(V07、V08、V23和V27),保存于福建农林大学植物保护学院,均由安徽岳西的感病鳞翅目蛹虫体分离纯化而得。菌株在低温(3 ℃)黑暗条件下保存于萨氏培养基(去除葡萄糖成分)上,并定期转接,试验前经蚜虫复壮。供试培养基为马铃薯蔗糖培养基(PSA)。将复壮后的4株菌株分别接种于Φ9 cm的PSA培养基上,在24 ℃恒温培养箱中培养7 d,前3 d无光照条件培养以利于孢子萌发和菌丝生长,后4 d以L∶D(14∶10)光照培养以促进分生孢子的形成;然后转接于250 mL液体PSA培养基中,置于摇床(120 r·min-1)培养7 d;添加0.03%吐温-80湿润剂于培养液,在振荡器上振荡5 min。以血球计数板检测分生孢子浓度。将各菌株配制成2×107孢子·mL-1的悬浮液(作为母液);用含0.03%吐温-80湿润剂的蒸馏水分别将母液稀释至2×103、2×104、2×105、2×106孢子·mL-14种浓度。在测定时另取少量悬浮液涂在含0.05%氯霉素的PSA培养基薄层上,28 ℃下培养24 h后,在光学显微镜40倍目镜下镜检孢子萌发率。
1.2 供试蚜虫
茶蚜种群为福建农林大学南区茶园的茶树(未施农药)上自然发生的蚜虫,在室内盆栽茶树苗上饲养数代。挑选健康无翅成蚜,用软毫的细毛笔挑取转入蚜虫饲养盒中。蚜虫饲养盒制作参照文献[7]的方法,将刚配制的1.5 mL 2%琼脂溶液倒入培养皿(Φ3.5 cm,深1 cm)中,用打孔器将新鲜茶树叶片制备成圆叶片,当小皿中的琼脂溶液呈半凝固状态时,将茶叶圆片正表面平贴于琼脂溶液表面,并将叶圆片边缘浸没在琼脂溶液中以防止叶片水分过快流失,并将培养皿盖盖好。
1.3 试验方法
将滤纸(Φ8 cm)平铺于布氏漏斗(Φ8 cm)内,漏斗下置一100 mL烧杯;另取Φ18 cm滤纸剪成带柄扇形,用软毫细毛笔将茶树叶片上健壮的无翅成蚜转于剪好的扇形滤纸上,每个处理转移50头茶蚜。取20 mL接种液(对照以0.03%吐温-80溶液代替分生孢子悬浮液)沿扇形滤纸扇柄处迅速倒出,将在扇面的茶蚜浸于悬浮液中3 s;迅速将扇形滤纸提起平放于吸水纸上,并将布氏漏斗底部吸水纸上个别茶蚜用毛笔尖小心移到吸水纸上,将茶蚜体表多余的悬浮液吸去;将处理后的能爬动的茶蚜移入蚜虫饲养盒;将蚜虫饲养盒放入培养箱(24 ℃),并使饲养盒相对湿度(RH)为100%。每日定时观察蚜虫发病情况,并将仔蚜虫清除出饲养盒,连续观察8 d。设每株菌株每个接种浓度为1个处理,每个处理有50头无翅成蚜。每个处理设置3个重复。
1.4 数据处理
参照植物病害发病分级标准[8],对蜡蚧轮枝菌侵染茶蚜情况进行分级(镜检)。0级:未见虫体表面长有菌丝。1级:可见虫体表面长有菌丝,较稀疏。2级:明显可见菌丝体在虫体的部分器官(如头、胸、腹末端、足)长出,但分生孢子尚未产生,或者个别开始出现。3级:虫体表面长满了菌丝体,大量分生孢子出现。虫生真菌侵染昆虫的发病指数公式表示如下:

(1)
由式(1)得出如下蜡蚧轮枝菌侵染茶蚜的发病指数公式:
Y=(1x+2y+3z)/(3x+3y+3z+3s)
(2)
式中,Y为发病指数,x为1级感染的蚜虫数,y为2级感染的蚜虫数,z为3级感染的蚜虫数,s为0级感染的蚜虫数。
各处理茶蚜的累计病情指数(Y)随时间(t)的变化,采用改进的Gompertz模型进行拟合[9]:
Y=Kexp〔(-Bexp(-Rt)〕
(3)
式中,K、B和R为待估参数,其中K表示特定寄主—病原—环境系统中的病情指数上限;B仅为位置参数;R为表观侵染速率,指在单位时间内新增病害数量与原有病害数量的比率,是流行速度的表达方式之一。以上数据分析、运算均采用DPS数据处理软件[10]。
2 结果与分析
孢子萌发镜检结果表明,蜡蚧轮枝菌4个菌株5个浓度的分生孢子萌发率均在98%以上,可用于生物测定。用Gompertz模型模拟4株蜡蚧轮枝菌不同接种量(孢子对数浓度)对茶蚜的侵染动态趋势,拟合结果(表1)表明,各处理累计发病模型的决定系数(r2)﹥0.7,模型经卡方检验达到极显著水平,表明用该模型拟合茶蚜发病指数的效果很好。
表1随时间变化的累计病情指数拟合Compertz模型的参数估计1)
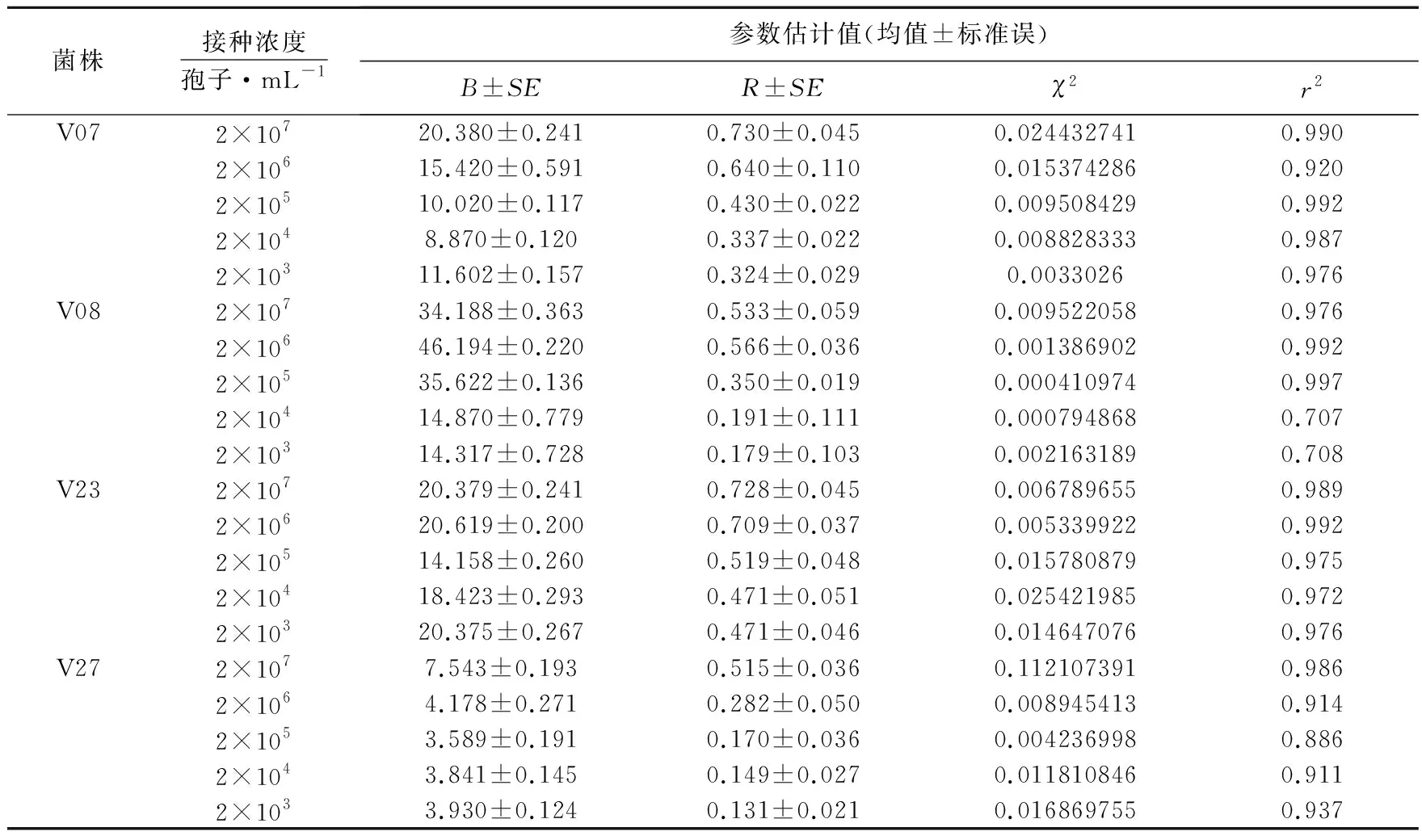
Table 1 Estimates of parameters from fitting the infection-caused cumulative disease indices of Toxoptera aurantii colonies to Compertz model
通过Gompertz模型拟合各处理蜡蚧轮枝菌对茶蚜的侵染过程,获得侵染速率R值。从图1可以看出,4株菌株对茶蚜的侵染速率与初始接种浓度对数值均呈线性相关,侵染速率随着初始接种浓度的升高而增大,斜率分别为0.112、0.108、0.015和0.086。
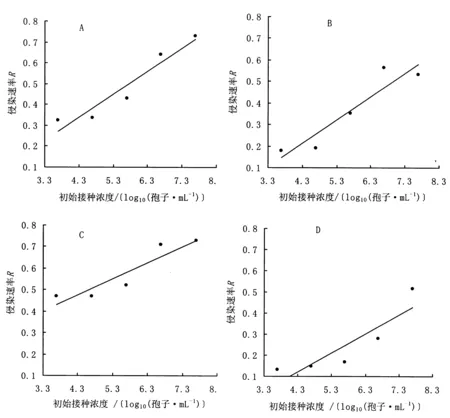
A.菌株V07,F1,4=36.15,p =0.009,r2=0.923;B.菌株 V08,F1,4=21.4,p =0.019,r2=0.877;C.菌株V23,F1,4=17.9,p =0.024,r2=0.857;D.菌株V27,F1,4=11.69,p =0.042,r2=0.796。图1 蜡蚧轮枝菌各初始接种浓度对数值与侵染速率R的关系Figure 1 The regression of the parameters R from fitting of Gompertz model against the logarithm transformed initial inoculating dose of L.lecanii
3 讨论
蜡蚧轮枝菌是寄主范围和地理分布均十分广泛的昆虫病原真菌,不同寄主和地理来源的菌株不仅分生孢子大小形状有差异,萌发速率也有差异,对昆虫的侵染致病力也有差异[11]。本试验比较4株蜡蚧轮枝菌对茶蚜成虫的侵染,发现V07、V23为侵染作用较强的菌株,初始接种剂量相同时,V07侵染速率最大。这可能与不同蜡蚧轮枝菌菌株的生物学特性,如孢子萌发速率、产孢量等的差异有关[12]。
初始接种剂量影响着蜡蚧轮枝菌对茶蚜的侵染流行速率。在初始接种剂量高的种群中,蜡蚧轮枝菌侵染茶蚜的流行速率远远高于初始接种剂量低的种群。这与必须有适当的孢子数目才能引起病害流行的观点相符[8]。因此,利用蜡蚧轮枝菌侵染蚜虫使得蚜虫种群出现流行病,除了要具备潮湿条件外,还必须有数量较高的初始侵染源。本试验以较高的初始接种剂量,在较短时间内形成数量较大的分生孢子和菌丝体,缩短达到流行高峰的时间,以克服因蜡蚧轮枝菌流行时间长及高湿(至少10-12 h相对湿度达到85%-100%[13])诱发植物病害的问题[14]。在茶园,梅雨季节的潮湿条件或夜间露水的短时间湿润将有利于蜡蚧轮枝菌孢子萌发,引起蜡蚧轮枝菌在茶蚜种群中流行。
本研究引入植物病害流行学中描述植物病害严重程度的等级及植物病害流行学Gompertz模型,以此描述蜡蚧轮枝菌在茶蚜实验种群中的流行动态,更加简捷地评估了蜡蚧轮枝菌对茶蚜实验种群的控制效果。
[1] 肖润林,彭晚霞,宋同清,等.稻草覆盖对红壤丘陵茶园的生态调控效应[J].生态学杂志,2006,25(5):507-511.
[2] 许咏梅.中国茶叶出口国际竞争力比较分析[J].世界农业,2006,321(1):27-28.
[3] 冯明光,李增智.虫霉菌及其利用[M]∥陈涛.有害生物的微生物防治原理和技术.武汉:湖北科学技术出版社,1995:273-291.
[4] 罗小刚.一种重要的昆虫病原真菌——蜡蚧轮枝菌[J].贵州农业科学,1988(1):57-64.
[5] 谢明,万方浩,邱卫亮,等.中国蜡蚧轮枝菌研究进展[M]∥倪汉祥,成卓敏.面向21世纪的植物保护发展战略.北京:中国科学技术出版社,2001: 226-231.
[6] Wang L, Huang J, You M, et al. Time-dose-mortality modeling and virulence indices for six strains ofVerticilliumlecaniiagainst sweetpotato whitefly,Bemisiatabaci(Gennadius)[J]. Journal of Applied Entomology, 2004,128(7):494-500.
[7] 郭友中.蜡蚧轮枝菌对桃蚜侵染力的主要影响因素研究[D].上海:中国科学院上海昆虫研究所,2000.
[8] Bowenk K L. Plant Pathology: Concepts and Laboratory Exercises[M]. Boca Raton, Florida: CRC Press LLC, 2003:278-290.
[9] Berger R D. Comparison of the Gompertz and Logistic equations to describe plant disease progress[J]. Phytopathology, 1981,071:716- 719.
[10] 唐启义,冯明光.实用统计分析极其计算机处理平台[M].北京:中国农业出版社,1997:1-407.
[11] Drummond J, Heale J B, Gillespie A T. Germination and effect of reduced humidity on expression of pathogenicity inVerticilliumlecaniiagainst the glasshouse whiteflyTrialeurodesvaporariorum[J]. Annals of Applied Biology, 1987,111(1):193-201.
[12] Cortez M H, Alatorre R R, Moraa A G, et al. Characterization of multisporic and monosporic isolates ofLecanicillium(Verticillium)lecaniifor the management ofToxopteraaurantiiin cocoa[J]. Biology Control, 2003,48(3):321-334.
[13] Hsiao W F, Bidochka M J, Khachatourians G G. Effect of temperature and relative humidity on the virulence of the entomopathogenic fungus,Verticilliumlecanii, toward the oat-bird berry aphidRhopalosiphumpadi(Hom., Aphididae)[J]. Journal of Applied Entomology, 1992,114(5):484-490.
[14] 周燚,王中康,喻子牛.微生物农药研发与应用[M]. 北京:化学工业出版社,2006:103-116.

