2型猪链球菌层粘连蛋白结合蛋白的原核表达及免疫原性检测*
潘秀珍,邵珠卿,李先富,刘文静,王长军,唐家祺
2型猪链球菌层粘连蛋白结合蛋白的原核表达及免疫原性检测*
潘秀珍1,2,邵珠卿1,2,李先富1,刘文静1,2,王长军1,唐家祺1
目的 表达2型猪链球菌(Streptococcus suis 2,S.suis 2)层粘连蛋白结合蛋白(Lmb)并检测其免疫原性。方法PCR检测lmb基因在不同血清型S.suis中的分布。将 S.suis 2中国强毒株05ZYH33的 lmb基因克隆至表达载体p ET32a,转化大肠杆菌 E.coli BL21,IPTG诱导表达,His亲和层析柱纯化重组蛋白。Western blot检测Lmb的免疫原性。结果lmb基因存在于大多数S.suis血清型中。诱导表达并纯化后获得较高纯度的重组蛋白。重组Lmb能够和感染05ZYH33全菌的猪恢复期血清反应。结论lmb基因在S.suis不同血清型中广泛分布,Lmb在细菌感染宿主过程中表达,可以作为疫苗开发的候选分子。
2型猪链球菌;层粘连蛋白结合蛋白;疫苗候选分子
猪链球菌(Streptococcus suis,S.suis)是一种 重要的人兽共患病病原菌,可感染猪或人并导致多种严重疾病[1]。根据其荚膜多糖抗原的不同,可将S.suis分为35个血清型[2]。其中,S.suis 1/2型、1型、2型、7型、9型及 14型都可致猪病,但以 S.suis 2分布最广,致病力最强[3]。1998年在江苏和2005年在四川相继暴发的 S.suis疫情,导致了严重的公共卫生事件[1,4],引起了世界范围内对 S.suis感染的关注。本课题组对 S.suis 2型两个强致病菌株全基因组测序的完成[5],使得在基因组水平筛选致病性相关的表面和分泌蛋白作为亚单位疫苗候选分子成为可能。
微生物表面的脂蛋白具有良好的免疫原性,能够同时刺激宿主的体液免疫和细胞免疫,引发宿主强烈的免疫防御机制[6]。链球菌层粘连蛋白结合蛋白(laminin binding protein,Lm b)是一种锌离子吸收相关表面受体,属于脂蛋白受体Ⅰ家族。Lmb与细菌的粘附相关,并在细菌的离子平衡和毒力中发挥功能[7-8],已有的研究证实,多种链球菌Lmb具有较好的免疫原性,能够在小鼠模型中发挥显著性的免疫保护性[9-10]。我们通过对S.suis 2型中国强毒株05ZYH 33的全基因组分析,发现了 lmb基因。序列分析发现该基因编码的蛋白具有脂蛋白受体Ⅰ家族的所有特征:①蛋白的氨基酸残基总数在300-330之间;②具有17-23个前导序列;③在前导序列的C末端具有一个(L/I/V)-(S/A)-(A/G)-C保守序列,作为信号肽酶Ⅱ的识别位点;④具有β1-α-β2组成的三级结构模型;⑤N末端有可以被脂类修饰的序列。本研究表达并纯化了S.suis 2编码的Lmb蛋白、鉴定了其免疫原性,并检测了该基因在不同链球菌中的分布,为进一步研究其作为疫苗候选分子的可能性奠定了基础。
1 材料和方法
1.1 材料和试剂
1.1.1 菌株 S.suis共35株。其中 S.suis 2 05ZYH 33来自中国;S.suis血清型标准参考株34株,由加拿大M arecelo Gottschalk教授惠赠。
1.1.2 试剂 引物由南京赛百胜生物公司合成。感染05ZYH33全菌的猪恢复期血清为本实验室保存,HRP标记兔抗猪IgG为Sigma公司产品,Ex Taq polymerase、dN TP、T4 DNA 连接酶、限制性内切酶 Eco RⅤ、XhoⅠ均购自大连宝生物工程公司,DNA Marker和蛋白M arker购自Fermentas公司,PCR回收试剂盒购自Promega公司,IPTG、PVDF膜购自南京生兴生物公司。其它所有试剂均为分析纯试剂。
1.2 方法
1.2.1 S.suis中lmb基因的生物信息学分析 用Blast软件从完成全基因组测序的S.suis 2全基因组序列中筛选Lmb编码基因,并与 GenBank中的链球菌Lmb序列进行同源性分析。利用ClustalW软件将不同细菌编码的Lm b氨基酸序列进行序列比对。
1.2.2 PCR检测 lmb在S.suis不同血清型的分布 根据序列比对结果,在 lmb的保守区设计引物,分别以多种 S.suis血清型菌株的基因组为模板,PCR扩增 lmb目的基因。1%琼脂糖凝胶电泳检测是否有lmb目的片段。
1.2.3 PCR扩增 S.suis 2 05ZYH33的 lmb基因
根据筛选所得序列设计合成引物,进行PCR扩增Lmb截去跨膜信号肽编码区的基因片段。上游引物 为 5’- GA TA TCGAAGCGAGTCAAGTACAGCCAG-3’,划线部分为 Eco RⅤ酶切位点;下游引 物 为 5’-CTCGAGCGGTCGA TAGAA TTCGGCCTTTTA-3’,划线部分为 XhoⅠ酶切位点。PCR程序为95℃5 min;95℃30 s;58℃30 s;72℃1 min,共25个循环,最后72℃延伸10 m in。
1.2.4 目的片段的克隆测序 PCR产物经1%琼脂糖凝胶电泳,用胶回收试剂盒回收目的片段。将此目的片段与p EASY-T1连接,转化至DH5α感受态细菌,菌液经PCR检测为阳性者用试剂盒提取质粒,酶切,电泳鉴定。
1.2.5 重组表达载体p ET32a::lmb的构建和鉴定质粒p EASY-T1::lmb和p ET32a载体分别用EcoR V/Xhol I双酶切,并用胶回收试剂盒回收。T4 DNA连接酶连接后转化DH5α感受态,菌液经PCR检测为阳性者用试剂盒提取质粒,酶切,电泳鉴定。结果为阳性者送往上海英俊生物技术有限公司进行测序,对测定结果进行分析。
1.2.6 Lmb的表达及其产物的纯化 将重组表达载体转化 E.coli BL 21(DE3),加入1mmol/L IPTG(异丙基-β-D-半乳糖苷)诱导表达,收集菌体超声破碎。离心后取上清进行SDS-PA GE电泳,明确是否有目的蛋白的表达。将重组菌扩大培养并经IPTG诱导表达,超声裂解,离心后的上清用Ni2+亲和层析柱纯化融合蛋白,12%SDS-PAGE电泳鉴定目的蛋白的分子量。
1.2.7 Lmb的免疫原性分析 将提取的蛋白样品经12%SDS-PAGE电泳后,采用电转印法将蛋白转移至硝酸纤维素膜上,5%脱脂奶37℃封闭1h,加感染S.suis 2 05ZYH33的猪恢复期血清(1∶100稀释),4℃孵育过夜,二抗为 HRP标记的兔抗猪IgG(1∶1 000稀释),37℃孵育1h,DAB显色。
2 结 果
2.1 lmb基因具有高度的保守性 通过与 Gen-
Bank中已知的蛋白序列进行同源性分析发现,S.suis 2四川分离株05ZYH33全基因组中的开放阅读框CDS SSU 0330编码 lmb基因。序列比对发现05ZYH33与 GenBank上的肺炎链球菌(Strep tococcus pneum oniae)、无乳链球菌 (Streptococcus agalactiae)、化脓链球菌(Strep tococcus pyogenes)、停乳链球菌(Streptococcus dysgalactiae)氨基酸序列相似性分别为 75%、70%、69%、67%。同时,该蛋白在S.suis 2不同分离株表现出极为保守的特征,中国强毒株05ZYH33编码的Lmb与中国强毒株98HA H33、欧洲分离株 P1/7、北美分离株 89/1591的Lmb的氨基酸序列相似性均达到97%。
2.2 lmb基因在S.suis不同血清型中广泛分布根据序列比对结果,在 lmb基因的保守区设计一对引物,对不同的 S.suis菌株进行 PCR扩增,发现在所有检测的 S.suis血清型中的30个血清型中有lmb存在。

表1 PCR检测lmb基因在各菌株中的分布Table 1 The distribution of lmb in different S.suis serotypes
2.3 目的基因的克隆 以提取的05ZYH33的基因组DNA为模板,对目的基因(lmb)进行 PCR扩增,产物进行琼脂糖凝胶电泳检测(图1)。结果显示,PCR扩增产物分子量约为900bp,大小与lmb基因的大小(867bp)相符。

图1 PCR扩增结果Fig.1 Agarose gel electrophoresis of PCR 1:The products of PCR;2:1kb DNA marker
2.4 重组表达载体p ET32a::lmb的鉴定 将构建好的重组表达载体p ET32a::lmb用Eco R V+Xho l I双酶切后,进行1%琼脂糖电泳,结果显示 lmb片段的长度约900bp,序列测定显示该片段全长867 bp,编码289个氨基酸(图2)。
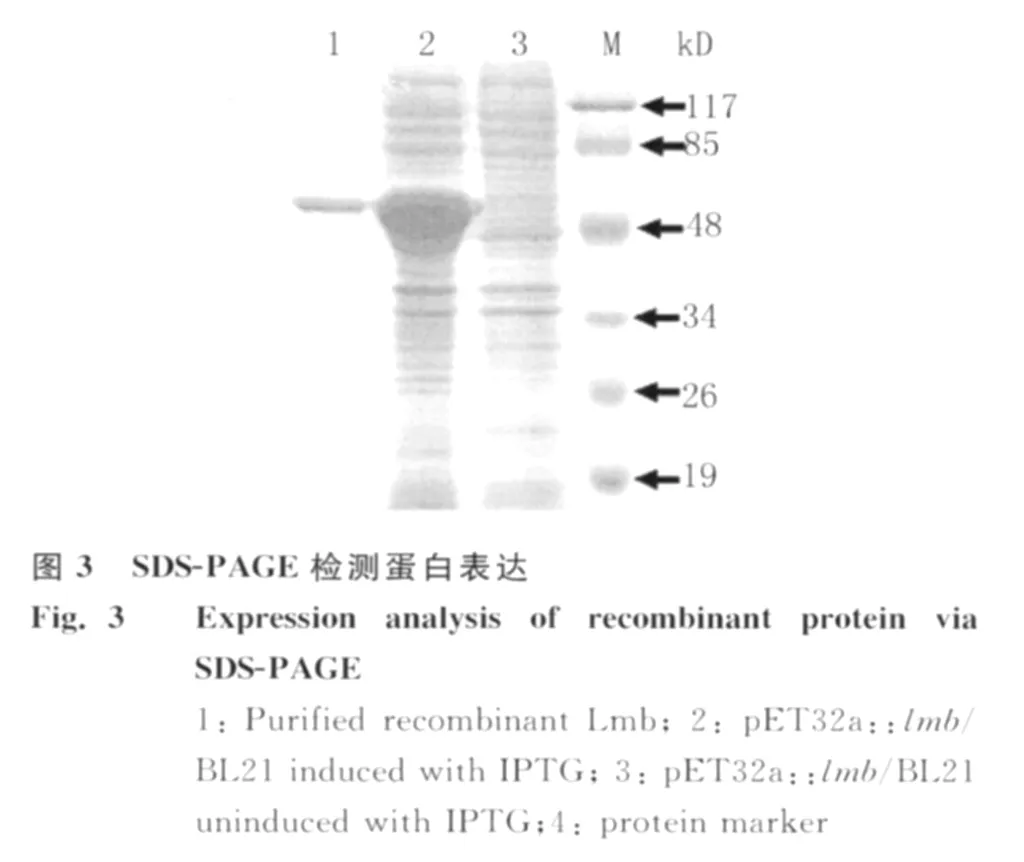
2.5 重组蛋白的表达及纯化 构建好的重组表达质粒 p ET32a::lmb转化大肠杆菌 BL21后,经IPTG诱导,SDS-PAGE分析表明在约50kD处有一明显的新生蛋白条带(图3),分子量大小与预期一致。利用 His-Resin对表达产物进行了纯化,纯化后的表达产物只有一条特异的条带,获得了较纯的Lmb重组蛋白(图3)。2.6 Lmb的免疫原性 Western blot的结果显示,Lmb可以与感染05ZYH33的猪恢复期血清反应,在特定位置处有明显的条带(图4)。

图2 重组质粒pET32a::lmb的酶切鉴定1:Eco RⅤ和 XhoⅠ双酶切 p ET32a::lmb;M.1kb DNA分子量标准;2:Eco RⅤ单酶切p ET32a::lmbFig.2 Identif ication of the recombinant plasm id pET32a::lmb by double restriction enzymes digestion.1:p ET32a::lmb/Eco RⅤ+XhoⅠ;M:1kb DNA marker;2:p ET32a::lmb/Eco RⅤ
3 讨 论

脂蛋白受体抗原Ⅰ(lipoprotein recep to r antigenⅠ,L raⅠ)家族是一类链球菌表面蛋白,其家族成员在血液链球菌(Streptococcus sanguis)粘附到唾液腺表皮、副血链球菌(Streptococcus parasanguis)同血小板基质的结合以及肺炎链球菌(Streptococcus pneumoniae)粘附到肺Ⅱ型上皮细胞过程中发挥重要作用[11-13]。Lm b是一种分子量在35kd左右的L raⅠ家族成员,在多种链球菌中广泛存在。Lmb不仅在链球菌中发挥锌离子吸收的功能,提高细菌在宿主中锌离子限制条件下的生存能力[14];还可以与宿主细胞的层粘连蛋白结合,参与细菌的黏附过程[7];还能促进细菌穿透人血脑屏障,与细菌的毒力相关[15]。
近年来,大规模爆发人感染S.suis 2的严重公共卫生事件,并出现“中毒性休克综合征”等严重的临床症状,显示对S.suis 2感染的预防和控制亟待加强。因此对S.suis 2疫苗的研究显得十分重要。在S.suis 2致病机制尚不明确的条件下,表面蛋白、分泌蛋白和毒力相关因子成为有潜力的亚单位疫苗的候选分子[16]。Lmb作为一个在链球菌中广泛存在的表面蛋白,与细菌的黏附和毒力相关。已有研究发现其对多种链球菌编码的Lmb具有较好的免疫保护性,能够在小鼠模型中发挥较强的保护作用[8,9],但是关于 S.suis的Lm b的研究尚未见诸报道。本研究通过原核表达系统p ET32a::BL21获得了含有标签为20kD左右的融合蛋白,Western blot表明该重组蛋白具有较好的免疫原性。本研究结果显示Lmb在不同地域分离的菌株中具有高度的保守性。除此之外,lmb基因在S.suis的35个血清型中的30个血清型中广泛分布。Lm b较好的免疫原性、高度的保守性和基因分布的广泛性显示该蛋白是一个理想的疫苗候选分子。
[1]Tang J Q,Wang C J,Feng Y J,et al.Strep tococcal toxic shock syndrome caused by Streptococcus suis serotype 2[J].PLoS Medicine,2006;3(5):e151.
[2]Staats JJ,Feder I,Okw umabua O,et al.Streptococcus suis:past and p resent[J].Vet Res Commun,1997;21:381-407.
[3]Hill JE,Gottschalk M,Brousseau R,et al.Biochemical analysis,cpn60 and 16S rDNA sequence data indicate that Streptococcus suis serotypes 32 and 34,isolated from pigs,are Streptococcus orisratti[J].Vet Microbiol,2005,107(1-2):63-69.
[4]Yu H,Jing H,Chen Z,et al.Human Strep tococcus suis outbreak,Sichuan,China[J].Emerg Infect Dis,2006,12(6):914-920.
[5]Chen C,Tang J,Dong W,et al.A Glimpse of Streptococcal Toxic Shock Syndrome from Comparative Genomics of S.suis 2 Chinese Isolates[J].PLoSONE,2007,2(3):e3 l 5.
[6]Brightbill HD,Libraty DH,Krutzik SR,et al.Host defense mechanisms triggered by microbial lipoproteins through toll-like recep tors[J].Science,1999,285(5428):732-736.
[7]Elsner A,Kreikemeyer B,Braun-Kiewnick A,et al.Involvement of Lsp,a member of the L ra I-lipoprotein family in Streptococcus pyogenes,in eukaryotic cell adhesion and internalization[J].Infect Immun,2002,70(9):4859-4869.
[8]Loisel E,Jacquamet L,Serre L,et al.AdcA II,a new pneumococcal Zn-binding protein homologouswith ABC transporters:biochemical and structural analysis[J].JMol Biol,2008,381(3):594-606.
[9]A randa J,Garrido ME,Cortés P,et al.Analysisof the p rotective capacity of three Streptococcus suis proteins induced under divalent-cation-limited conditions[J].Infect Immun,2008,76(4):1590-1598.
[10]A randa J,Garrido M E,Fittipaldi N,et al.Protective capacities of cell surface associated proteins of Streptococcus suis mutants defictent in divalent cation up take regulato rs[J].Microbiology,2009,155(5):1580-1587.
[11]Jenkinson HF.Cell surface protein receptors in oral streptococci[J].FEMSMicrobiol Lett,1994,121(2):133-140.
[12]Viscount HB,M unro CL,Burnette-Curley D,et al.Immunization with Fim A p rotects against Streptococcus parasanguis endocarditis in rats[J].Infect Immun,1997,65(3):994-1002.
[13]Berry AM,Paton JC.Sequence heterogeneity of PsaA,a 37-kilodalton putative adhesin essential for virulence of Streptococcus pneumoniae[J].Infect Immun,1996,64(12):5255-5262.
[14]Weston BF,Brenot A,Caparon M G.The metal homeostasis protein,Lsp,of Streptococcus pyogenes is necessary for acquisition of zinc and virulence[J].Infect Immun,2009,77(7):2840-2848.
[15]Tenenbaum T,Spellerberg B,Adam R,et al.Streptococcus agalactiae invasion of human brain microvascular endothelial cells is promoted by the laminin-binding protein Lmb[J].M icrobes Infect,2007,9(6):714-720.
[16]Baum s CG,Valentin-Weigand P.Surface-associated and secreted facto rs of Strep tococcus suis in epidemiology,pathogenesis and vaccine development[J].Anim Health Res Rev,2009,10(1):65-83.
Expression and immunogen icity identification on lam in in binding protein of Strep tococcus suis 2
PAN Xiu-zhen,SHAO Zhu-qing,L IXian-fu,L IU Wen-jing,WANG Chang-jun,TANG Jia-qi
(Research Institute for M edicine of N anjing Comm and,Nanjing 210002,China)
To detect the distribution of lmb gene in different serotypesof Streptococcussuis(S.suis),bioinformatics analysisof the w hole genome of Streptococcussuis 2(S.suis 2)was carried out to find the lmb gene.The results indicated that the ORF SSU 05-0330 encoded the lm b gene of S.suis 2 virulent strain 05ZYH33.PCR with a pair of primers specific to lmb showed that lmb gene could be found in 30 S.suis sero types.The lmb encoding ORF from the genomic DNA in the virulent strain 05ZYH33 wasamp lified by PCR using a pair of specific primersand subcloned into p ET32a expression vecto rwith double digestion of Eco RⅤand Xho I.Subsequently,the recombinant plasmid was transformed to E.coli BL21(DE3)after the identification of restriction endonuclease digestion and DNA sequencing.After induction with IPTG,E.coli cells expressing HtpS were harvested by centrifugation and lysed by sonication.Follow ing sonication,bacterial lysate was subjected to centrifugation for the removal of the insoluble pellets.The supernatant was filtered with a 0.22μm po re-size filter and purified using a Ni-NTA column.SDS-PAGE demonstrated that E.coli BL21 containing the recombinant plasmid could express a distinct band with a molecularweightof 50 kDa,which was similar to the p redicted band of recombinant Lmb protein.Western blotwas carried out to detect the immunogenicity of Lmb,and sera of convalescent-phase swine collected from SPF-pigs survived from infection by S.suis2 05ZYH33 were used as the first antibody.The result showed that recombinant Lmb could reactwith convalescent-phase sera from pigs infected by S.suis 2,indicating that H tpSwas expressed and exposed in vivo and could be recognized by the immune system and elicit a host response during natural infection of S.suis 2.Taken together,Lmb is an in vivo expressed immunogenic protein,and potential to be a vaccine candidate of S.suis 2.
Strep tococcus suis;laminin binding protein;vaccine candidate
2.南京师范大学生命科学学院,南京 210046
R378.1
A
1002-2694(2011)07-0583-04
*国家自然科学基金(30730081,81071317,30972638);江苏省自然科学基金资助项目(BK2010113,BK2010114,BK2010025,BK2009042)
潘秀珍,Email:panxiuzhen-2004@163.com
1.南京军区军事医学研究所,南京 210002;
2010-07-30;
2011-02-16

