催化动力学分光光度法测定痕量铜的研究与应用
张 诺 李 燕 孙韶华 贾瑞宝
(1.济南市供排水监测中心,济南 250021; 2.济南市质量技术监督局历城分局,济南 250100)
铜是一种过渡性元素,广泛分布于自然界中,是人体及动植物必需的微量元素之一,对机体的新陈代谢有重要的调节作用[1]。人体摄取铜主要从食品及环境中获得,若饮用水和食品中Cu(Ⅱ)含量过高,不但影响水质和食品的质量,也危害人体的健康,因此,生命组织及环境中痕量铜的测定及研究日趋引起了人们的重视。
铜的测定方法有火焰原子吸收光谱法[2]、荧光法[3,4]、分光光度法[5]和流动注射分析法[6]等,其中分光光度法因具有快速、灵敏度高、选择性好、仪器价廉易得等特点,而在铜的检测中得到广泛应用。同时,由于铜具有较大的催化活性,可催化许多化学反应,目前多采用催化动力学分光光度法对铜进行分析[7-11]。该法具有灵敏度高、所需仪器设备少、操作简便、快速等优点,克服了原子吸收法和萃取分光光度法测定痕量铜的不足。近年来,随着新显色剂的不断发现,表面活性剂对显色反应增溶、增敏的应用,铜的催化动力学分光光度分析有了新的发展与突破,灵敏度、分析速度与选择性均有大幅提高。笔者以下对近5年来痕量铜的催化动力学分光光度分析进行评述。
1 催化褪色动力学分光光度法
1.1 催化氧化褪色动力学分光光度法
H2O2是一种强氧化剂,由于其发生氧化反应后,不会形成干扰离子,目前已被广泛应用于催化光度分析中[12-14]。铜对H2O2氧化还原性试剂催化动力学分光光度法的不同体系列于表1。
对表1中的总体数据进行分析后可知,Cu(Ⅱ)对H2O2氧化还原性试剂的催化能力较强,从灵敏度来看,其检出限均在ng/mL级以上。从线性范围来看,各体系的lg(A0/A)或ΔA与Cu(Ⅱ)的浓度在一定的范围内呈良好的线性关系,但各自的线性范围不同。铜对其他氧化剂氧化还原性试剂催化动力学分光光度法体系列于表2。
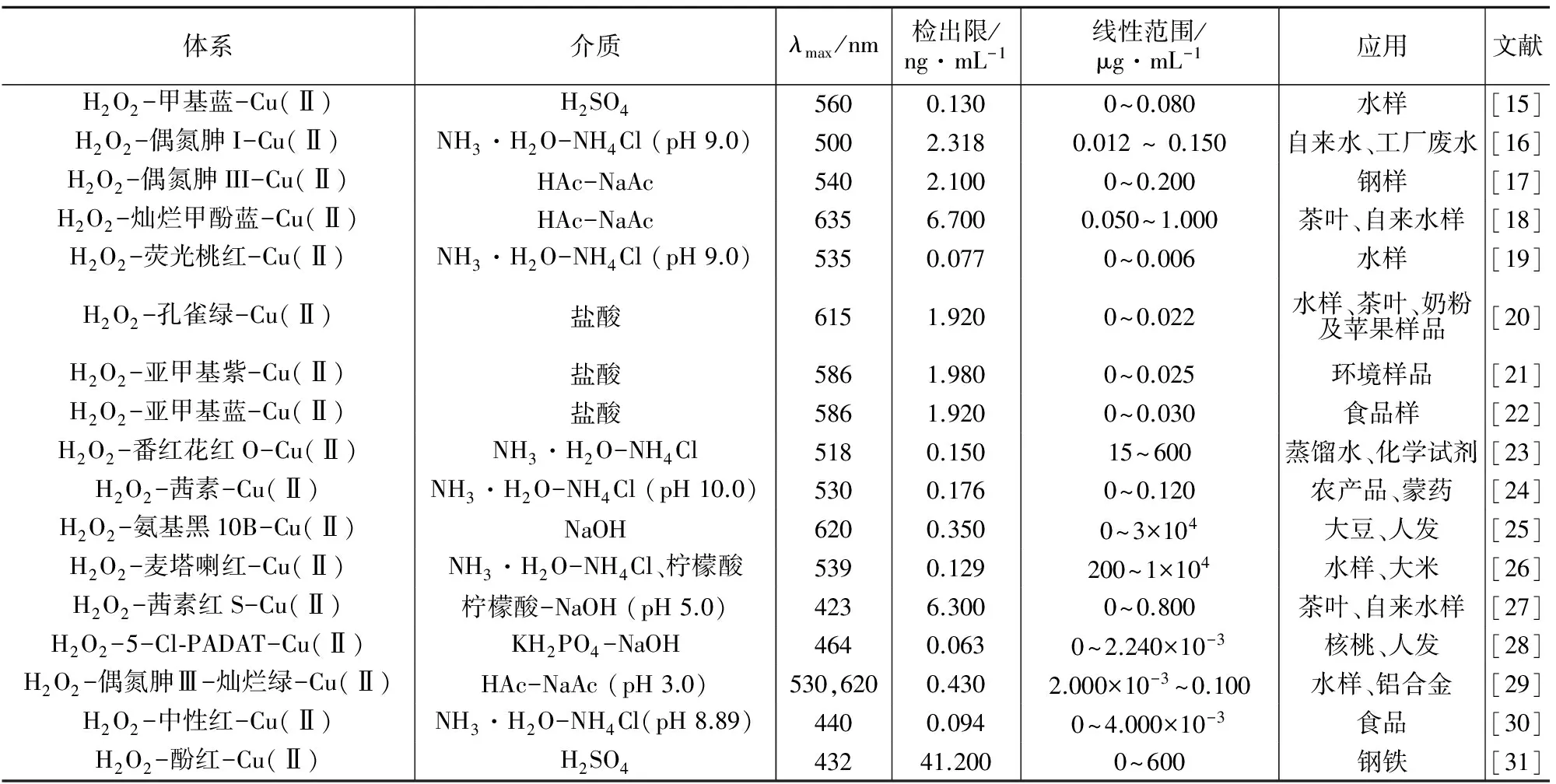
表1 铜对H2O2氧化还原性试剂催化动力学分光光度法

表2 铜对其它氧化剂氧化还原性试剂催化动力学分光光度法
从表2可以看出,目前此法中较好的是周之荣[33]等研究的溴酸钾-溴甲酚紫-Cu(Ⅱ)体系,此法灵敏度高,检出限在0.023 ng/ mL,线性范围为0~1.000×10-3μg/mL,该法成功地应用于地质、人发及植物样品中痕量铜的测定。
1.2 催化还原褪色动力学分光光度法
催化还原褪色动力学分光光度法中,最常见的还原剂就是抗坏血酸(VC),它是一种较弱的还原剂,在分析测定中有着广泛的用途[38,39]。铜对抗坏血酸还原氧化性试剂褪色反应具有很好的催化作用。铜对抗坏血酸还原氧化性试剂褪色的催化动力学分光光度法体系汇总列于表3。
中性红是一种氧化还原指示剂,变色范围pH为6.8~8.0,酸式呈红色,碱式显橙黄色。王志军[44]等研究发现在弱碱性介质中,Cu(Ⅱ)强烈催化双氧水还原中性红褪色反应,灵敏度很高,选择性也好,并提出该反应作为催化光度法测定痕量铜的新指示反应,建立了利用该反应测定痕量铜的新方法。此方法具有线性范围宽、干扰离子少的优点,检出限为0.520 ng/mL,线性范围为0~0.116 μg/mL,用于人发、指甲中痕量铜的测定获得满意结果。
表3铜对抗坏血酸还原氧化性试剂催化动力学分光光度法
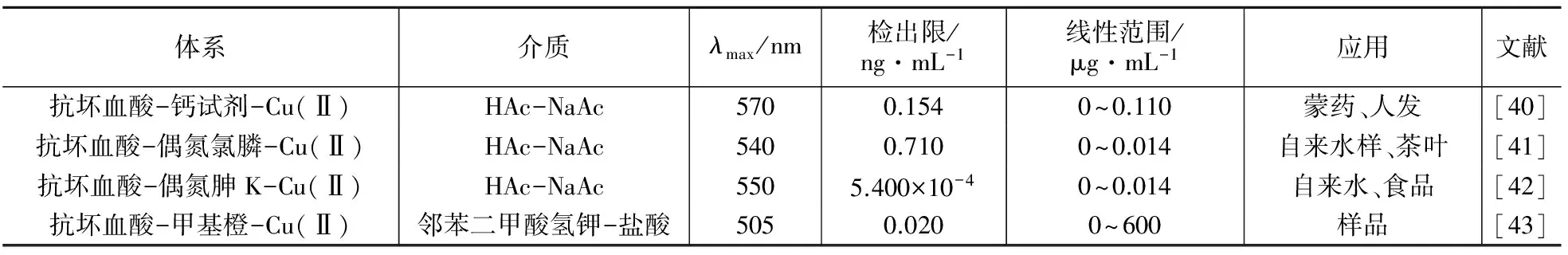
体系介质λmax/nm检出限/ng·mL-1线性范围/μg·mL-1应用文献抗坏血酸-钙试剂-Cu(Ⅱ)HAc-NaAc5700.1540~0.110蒙药、人发[40]抗坏血酸-偶氮氯膦-Cu(Ⅱ)HAc-NaAc5400.7100~0.014自来水样、茶叶[41]抗坏血酸-偶氮胂K-Cu(Ⅱ)HAc-NaAc5505.400×10-40~0.014自来水、食品[42]抗坏血酸-甲基橙-Cu(Ⅱ)邻苯二甲酸氢钾-盐酸5050.0200~600样品[43]
2 催化显色动力学分光光度法
催化显色动力学分光光度法测定痕量铜较催化褪色动力学分光光度法方面的研究要少。
2.1 催化氧化显色动力学分光光度法
在pH值为7.6的磷酸二氢钾-硼砂缓冲介质中,痕量Cu(Ⅱ)可灵敏地催化H2O2氧化N,N-二甲基苯胺(DMA)与3-甲基-2-苯并噻唑-酮腙(MBTH)的氧化还原显色反应,反应速率适中,而且灵敏度较高,是催化动力学分光光度法测定痕量铜的新方法。该方法的线性范围为1.500×10-3~7.700×10-3μg/mL,检出限为0.463 ng/mL 。该法被用于测定水样中铜的含量,获得满意结果[45]。
任健敏[46]等基于Cu(Ⅱ)催化氯酸钾氧化盐酸苯肼继而与α-萘胺偶合显色的反应,建立了催化动力学光度法测定痕量铜的新方法。通过正交试验得到测定痕量铜的最佳条件。在合适条件下,催化和非催化反应吸光度差(ΔA)与反应时间(t)呈线性关系,该方法的线性范围为0~0.080 μg/mL,检出限为6.260×10-1ng/mL。大多数离子无干扰,Fe3+干扰可加入NaF掩蔽。用于管网水中痕量铜的测定,回收率为96.8%和98.8%。
2.2 催化还原显色动力学分光光度法
丁素芬[47]等研究了H3PO4介质中铜对抗血酸还原钼酸铵生成钼蓝显色反应的催化作用,建立了测定铜的新方法,用于人发中痕量铜的测定,灵敏度可达0.154 g/mL。
3 阻抑动力学分光光度法
阻抑动力学光度法即反催化动力学光度法是一种不依赖大型仪器而灵敏度很高、简单易行的动力学分析方法,该方法基于某些化学反应加入适当的催化剂,在一定条件下可减慢氧化剂氧化还原某些有色物质褪色反应的反应速度。反应速度往往与催化剂的量有一定比例关系,所以从一个反应速度的变化,可以测定催化剂(或抑制剂)的量。对于反催化法,由于温度不需过高,使实验易于控制;但在中性介质中酸度不易控制而使吸光度数值易发生变化。
李国清[48]等基于在酸性介质中,以K2S2O8为氧化剂,溴甲酚紫为指示物质,Cu(Ⅱ)强烈阻抑K2S2O8氧化溴甲酚紫褪色反应,褪色反应程度在一定范围内随Cu(Ⅱ)浓度增大而降低,据此建立测定Cu(Ⅱ)反催化动力学光度分析法,并确定了测定最佳条件,方法的线性范围为0.012~0.060 μg/mL,检出限为33 ng/mL。用于测定水系、蔬菜中的痕量Cu(Ⅱ),结果满意。
晏细元[49]研究了在酸性条件下,Cu(Ⅱ)可催化空气氧化碘化钾生成碘,但当Cu(Ⅱ)的质量浓度小于0.020 μg/mL时有阻抑作用。利用Cu(Ⅱ)对反应的阻抑作用建立测定痕量铜的动力学光度法,该方法的检出限为0.005 ng/mL,线性范围为0~2.000×10-3μg/mL。该法用于测定人发中的痕量Cu(Ⅱ),结果满意。
张东[50]等研究发现,在乙酸介质中,铜能灵敏地阻抑高碘酸钾氧化玫瑰桃红R的褪色反应,而且阻抑程度与铜的量在一定范围内呈正比关系,据此,建立了测定痕量铜的新方法。该法的检出限为0.390 ng/mL,线性范围为0~0.008 μg/mL,该法应用于部分食品中铜含量的测定,结果满意。
4 结语
综上所述,近年来痕量铜的催化动力学分光光度分析技术发展很快,应用也越来越广泛。但其灵敏度和线性范围并不是非常理想,有待于研究者从以下几个方面进行加强:
(1)研究新的高灵敏度指示反应;
(2)寻找新的活化剂,研究提高催化动力学分析法选择性的途径;
(3) 提高监测技术的灵敏度;
(4)对反应的机理进行研究以对实际应用进行指导;
(5)将催化动力学分析与其它分析技术相结合,以提高方法的灵敏度和分析速度。
[1] 王夔.生命科学中的微量元素[M].北京:中国计量出版社,1991.
[2] 陕方,等.光谱学与光谱分析.2002,22(3):480.
[3] 袁小英,等.1999,19(4):572.
[4] 陈兰化.分析化学.1997,25(8):937.
[5] 丁素芳.光谱学与光谱分析.2000,20(2):250.
[6] 周焕英,等.光谱学与光谱分析.2000,20(4):525.
[7] 李艳辉,等.分析化学研究报告,2004,11(11):1 421-1 425.
[8] 王传娥,等.分析实验室.1999,18(3):71-73.
[9] 朱其永.光谱实验室,2005,22(1):173-175.
[10] 莎仁,等.内蒙古师范大学学报,2005,25(4):61-63.
[11] 于京华,等.济南大学学报,2005,19(1):29-31.
[12] 王晓菊.冶金分析,2002,22(3):53-54.
[13] 栗凤珍.天津化工,1996,(3):33-35.
[14] Huiming Mao. Microchemica Juornal, 1996(53): 303 - 307(Eng).
[15] 余倩,等.冶金分析,2005,25(4):73-75.
[16] 王洪福,等.绵阳师范学院学报,2007,26(5):39-42.
[17] 邓必阳,等.分析实验室,2004,23(3):65-67.
[18] 朱其永.光谱实验室,2005,22(1):173-175.
[19] 宋学省.临沂师范学院学报,2005,27(3):33-34.
[20] 郑怀礼,等.光谱学与光谱分析,2004,24(1):114-117.
[21] 童建颖.广东微量元素科学,2007,14(6):40-43.
[22] 应一红.杭州师范学院学报(自然科学版),2006,5(2):123-125.
[23] 庄会荣.冶金分析,2004,24(4):43-45.
[24] 莎仁.宝鸡文理学院学报(自然科学版),2005,25(3):191-194.
[25] 庄会荣.冶金分析,2004,24(5):20-22.
[26] 徐文军,等.冶金分析,2006,26(1):25-27.
[27] 陈贤光,等.分析实验室,2006,25(5):40-44.
[28] 张昕,等.分析实验室,2004,23(10):58-60.
[29] 孙登明,等.冶金分析,2007,27(9):45-47.
[30] 周之荣,等.食品工业科技分析检测,2005,(5):162-164.
[31] 吴芳辉.安徽工业大学学报,2007,24(2):166-168.
[32] 孙国良,等.浙江工业大学学报,2005,33(2):155-157.
[33] 周之荣,等.稀有金属,2005,29(1):119-122.
[34] 王玉宝,等.烟台师范学院学报(自然科学版),2005,21(2):136-137.
[35] 黄森科,等.漳州师范学院学报,2006(4):83-86.
[36] 宋学省.冶金分析,2005,25(4):55-57.
[37] 莎仁,等.冶金分析,2005,25(4):61-63.
[38] SafaviA, et al.Talanta,2001,54(2):397-402.
[39] Nakano, et al. Bunseki Kagaku,1999,48(3):285-297.
[40] 莎仁,等.应用化学,2006,23(10):1 179-1 181.
[41] 葛慎光,等.济南大学学报(自然科学版),2008,22(1):46-48.
[42] 于京华,等.济南大学学报(自然科学版),2005,19(1):29-31.
[43] 王文雷,等.化学分析计量,2006,15(5):20-22.
[44] 王志军,等.光谱实验室,2004,21(3):559-562.
[45] 倪永年,等.南昌大学学报(理科版),2005,29(6):511-513.
[46] 任健敏,等.冶金分析,2006,26(5):81-83.
[47] 丁素芬.光谱学与光谱分析,2000,20(2):250-257.
[48] 李国清,李金钏.韶关学院学报(自然科学版),2006,27(12):73-76.
[49] 晏细元.江西师范大学学报(自然科学版),2006,30(5):464-465.
[50] 张东,等.广东微量元素科学,2004,11(10):46-49.

